Escolar Documentos
Profissional Documentos
Cultura Documentos
TERMOQUIMICA
Enviado por
Chuck BartowskyDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
TERMOQUIMICA
Enviado por
Chuck BartowskyDireitos autorais:
Formatos disponíveis
2. TERMOQUMICA. 2.1 Introduccin. La termoqumica estudia los cambios de energa asociados a las transformaciones qumicas.
Cuando en una reaccin qumica los reactivos (R) y los productos (P) se encuentran a la misma presin (frecuentemente la presin atmosfrica ), el calor puesto en juego durante el P) se denomina variacin de entalpa (H = Qp). En los procesos qumicos proceso (R exotrmicos donde se desprende calor H < 0, mientras que en los endotrmicos, donde se absorbe calor, H > 0. La variacin de entalpa de algunas transformaciones qumicas puede determinarse experimentalmente por medida del calor involucrado en las mismas, con un equipamiento relativamente sencillo. A fin de poder obtener datos experimentales precisos debe procurarse un aislamiento trmico efectivo de los sistemas objeto de estudio. Un dispositivo experimental que conjuga sencillez y eficacia es un calormetro, como el representado esquemticamente en la figura adjunta.
Termmetro .
tapa perforada .
CALORMETRO
imn agitador .
Un funcionamiento ideal de un dispositivo como el indicado implica el total aislamiento trmico entre el sistema y los alrededores (el laboratorio), as como la no absorcin ni cesin de energa por parte del recipiente durante el proceso. Dado que el calormetro que se va a utilizar no es ideal, como paso previo a la determinacin de las variaciones de entalpa de los procesos indicados tendremos que proceder a determinar la capacidad calorfica del calormetro. 2.2 Objetivos. Por lo tanto, el desarrollo de esta prctica implica tres etapas bien diferenciadas: 1) Determinacin de la capacidad calorfica del calormetro, 2) Determinacin experimental de H asociada a la neutralizacin entre un cido fuerte y una base fuerte 3) Obtencin del calor de disolucin de un slido inico. 2.3. Bibliografa 1. Fichas de seguridad y Etiquetas: Vase el apartado de Normas de Seguridad en la pgina web del laboratorio: http://www.uv.es/fqlabo/ 2. P.W.Atkins, Qumica General, Ed. Omega, Barcelona 1992. Tema 6. 3. R.H. Petrucci, W.S. Harwood, F.G. Herring, Qumica General, Ed. Prentice Hall, Madrid 2003. Tema 7. 14
2.4. Cuestiones previas. 1. Repasa los conceptos de calor, transferencia de calor, calor de reaccin, entalpa y estudia el guin de la experiencia. 2. En una experiencia se mezclaron en el seno de un calormetro 50 mL de agua a 50.0 C con 50 mL de agua a 25.2 C. La temperatura del equilibrio fue 37.1 C. Calcula la capacidad calorfica del calormetro.(ver apartado 2.6.1) (datos: c(H2O) = 4.18 J.g-1.K-1; (H2O) = 1 g.cm-3) 3. Cuando 5.00 g de hidrxido sdico se disolvieron en 100 mL de agua a 25.0 C en el seno del calormetro de la cuestin anterior la temperatura ascendi hasta 36.9 C. Calcula la entalpa molar de disolucin para el proceso : NaOH(s)+ H2O(l) Na+(aq) + OH-(aq) 4. Dadas las entalpas de formacin estndar siguientes, calcula la entalpa de la reaccin: H3O+(aq) + OH-(aq) 2 H2O(l) Hfo(H3O+(aq)) = -285.9 kJ.mol-1; Hfo(OH-(aq))= -229.8 kJ.mol-1 Hfo(H2O(l))= -285.9 kJ.mol-1.
Reactivos HCl 1.2 M NaOH 1 M KNO3(s)
Material calormetro agitador magntico imn pesasustancias vidrio de reloj
3 Probetas de 10 mL cuentagotas termmetro digital varilla de vidrio cronmetro
papel indicador horno microondas balanza
2.5. Precauciones, seguridad y residuos. Al introducir el termmetro en el calormetro debe asegurarse que el bulbo est sumergido en el lquido, procurando que la agitacin no sea excesivamente vigorosa a fin de evitar que el imn agitador golpee con demasiada energa al termmetro. Mantener en todos los experimentos la misma velocidad de agitacin. Debe tenerse especial precaucin en el manejo del cido clorhdrico y de la disolucin de hidrxido sdico. El residuo generado en la prctica de disolucin de cloruro sdico no es especialmente peligroso por lo que puede verterse en la pila una vez finalizada cada experiencia, tomando la precaucin de dejar abierto el grifo de agua al realizar el vertido. 2.6. Procedimiento experimental. 2.6.1. Determinacin de la capacidad calorfica del calormetro. Consideraciones previas. Para la determinacin de la capacidad calorfica del calormetro (k) utilizaremos el denominado mtodo de las mezclas que, por su sencillez y eficacia, resulta el ms aconsejable. Dicho mtodo consiste en mezclar en el interior del calormetro dos masas de agua (m1 y m2) a diferentes temperaturas (t1, t2) midiendo la temperatura final una vez alcanzado el equilibrio trmico (te). De acuerdo con el primer principio de la termodinmica podemos escribir: {Calor cedido por el agua caliente} {calor absorbido por el agua fra} 15 {calor absorbido por el calormetro}
La nica dificultad experimental que implica el proceso es la correcta determinacin de la temperatura de equilibrio te. Dado que el calormetro no es un aislante perfecto, hay prdidas de calor por radiacin desde el sistema hacia los alrededores. Estas prdidas cabe esperar que sean aproximadamente constantes tras la mezcla de las dos masas de agua, por lo que una representacin grfica de la temperatura del sistema en funcin del tiempo debera reflejar una variacin aproximadamente lineal (y cuantitativamente poco importante) despus de un corto periodo inicial requerido para que el sistema se homogenece y alcance el equilibrio trmico. Por ello, en lugar de realizar una nica lectura tras la mezcla, procederemos a realizar una serie de ellas a intervalos constantes de tiempo, obteniendo por extrapolacin la temperatura de equilibrio. Procedimiento experimental. Medir, con la probeta, 10 mL de agua desionizada, e introducirlos en el calormetro. Introducir despus el imn agitador. Tapar el calormetro y esperar a que se estabilice la temperatura mientras contina la agitacin. Anotar la temperatura (t1). Calentar una pequea cantidad de agua en el horno microondas durante no ms de un minuto (si no se alcanzan los 60 C calentar de nuevo durante unos segundos ms). Medir, con la probeta, 10 mL de agua caliente. Medir su temperatura y transferirla al calormetro, anotando la ltima temperatura (t2) justo antes de aadirla sobre el agua fra. Tapar el calormetro inmediatamente y poner en marcha el cronmetro. Anotar la temperatura de la mezcla cada 20 segundos durante un periodo de tres minutos. Repetir la experiencia y calcular la capacidad calorfica del calormetro con ambos juegos de medidas. Si se obtiene un resultado similar pasar al apartado siguiente. En caso contrario, repetir hasta obtener un resultado reproducible. Los distintos calormetros tienen capacidades distintas, por ello, una vez determinada la capacidad calorfica, se han de realizar las siguientes experiencias con el mismo calormetro. Clculo de la capacidad calorfica del calormetro Datos : masa de agua caliente = m2 masa de agua fra = m1 temperatura del agua caliente = t2 temperatura del agua fra = t1 Representa grficamente el valor de la temperatura de la mezcla en funcin del tiempo, y obtn el valor de la temperatura de equilibrio (te) por extrapolacin a tiempo 0 de los puntos experimentales correspondientes al tramo lineal observado. Calcula la capacidad calorfica del calormetro (k) mediante la expresin : C(H2O).m2.(t2 te ) = C(H2O).m1.( te- t1 ) + k .(te t1) Los datos de calor especfico y densidad para el agua se toman de la cuestin nmero 2.
2.6.2. Determinacin de H asociada a la neutralizacin entre un cido fuerte y una base fuerte Consideraciones previas. Para la realizacin de esta experiencia mezclaremos en el calormetro una disolucin de base de molaridad conocida con un volumen igual de disolucin de cido, de tal modo que, en la disolucin final, exista un ligero exceso de cido. Al mezclar ambos reactivos, cabe esperar un aumento de la temperatura (dado que el proceso es exotrmico), cuyo valor mximo corresponder a la temperatura de equilibrio. Puesto que es posible que las temperaturas de las disoluciones iniciales de cido y base no sean idnticas, el balance energtico cabe establecerlo en los siguientes trminos:
16
{calor desprendido por la reaccin} =
{calor absorbido por la disolucin de NaOH}
{calor absorbido por la disolucin de HCl} +
{calor absorbido por calormetro}
Procedimiento experimental Introducir 10 mL de una disolucin NaOH 1 M en el calormetro (ms el imn agitador) taparlo y medir la temperatura (tb) mientras se agita. Tomar 10 mL de HCl 1.2M, medir su temperatura (ta) con el termmetro limpio y seco y aadirlos al calormetro. Observa atentamente la evolucin de la temperatura de la mezcla mientras se agita. Anotar el valor mximo alcanzado por sta (te). Con una varilla de vidrio tocar la disolucin y comprobar, mediante papel indicador, que la disolucin resultante tiene carcter cido. El residuo del calormetro se recoge en el bote marcado como Residuos cidos de calorimetra. Determinacin de la entalpa de neutralizacin del cido clorhdrico y el hidrxido sdico. Datos : masa de la disolucin de NaOH = mb temperatura de la disolucin de NaOH = tb masa de la disolucin de HCl = ma temperatura de la disolucin de HCl = ta moles de NaOH que han reaccionado = nNaOH El calor desprendido lo podremos determinar mediante la expresin: Qreac = C(H2O)mb.(te tb ) +C(H2O)ma.(te ta ) + k (te tb ) La densidad y el calor especfico de las disoluciones se supondrn iguales a las del agua. A partir de Qreac y el valor de nNaOH, determina la entalpa de neutralizacin para la reaccin: HCl(aq) + NaOH(aq) NaCl(aq) + H2O(l) Compara el valor obtenido con el que previamente se ha calculado en la cuestin nmero 3.
2.6.3. Determinacin del calor de disolucin de un slido inico El proceso de disolucin de un slido inico lleva asociada una variacin de entalpa cuyo signo depender de la magnitud de la energa reticular del slido y de las energas de hidratacin de los iones. En esta experiencia, teniendo en cuenta que el proceso es endotrmico, el balance energtico se puede expresar del siguiente modo: [Calor absorbido por la reaccin] = [Calor cedido por la disolucin] + [Calor cedido por el calormetro] Procedimiento experimental. Se introducen en el calormetro 9 mL de agua destilada junto con el imn agitador y se anota la temperatura (td). Se pesa, utilizando un pesasustancias de plstico, alrededor de 1 g de nitrato potsico, en balanza de tres cifras y se anota la cantidad exactamente pesada (ejemplos: 1,039 g; 0,997 g, etc.). Se introduce el slido en el calormetro, con precaucin de que no se quede pegado a las paredes, para ello, se puede aprovechar que el pesasustancias es flexible y se pueden doblar ligeramente sus extremos. 17
Se observa la disminucin de la temperatura y se anota el valor mnimo alcanzado, que consideraremos la temperatura de equilibrio (te). El residuo del calormetro se recoge en el bote marcado como KNO3. Este residuo se emplea como reactivo limpio en la realizacin del puente salino de la prctica de electroqumica. Determinacin de la entalpa de disolucin del nitrato potsico en agua. Masa de disolucin = md = masa de agua + masa de KNO3 td. te. Qdisol = C(H2O)md.(td -te ) + k (td - te ) Expresar el calor de disolucin por mol de nitrato potsico. 2.7. Cuestiones post-laboratorio. 1. Por qu se trabaja con un exceso de cido en la determinacin de la entalpa de neutralizacin? 2. En la experiencia que se realiza para determinar la entalpa de neutralizacin entre HCl y NaOH trabajamos con disoluciones 1M. Sera ms correcto hacerlo con disoluciones, por ejemplo, 0.1M? En caso afirmativo, Por qu no se realiza as? 3. En una parte de la prctica se ha determinado la entalpa de neutralizacin entre el HCl y NaOH. Obtendramos un valor muy diferente si hubiramos escogido HNO3 y KOH? 4. Hasta qu punto consideras correcto asumir que para las diferentes disoluciones con las que trabajamos los valores de calor especfico y densidad sean iguales a los del agua pura?
Apndice. El Laboratorio de Qumica General es uno de los Laboratorios Sostenibles de la Universitat de Valncia y que forma parte de Lab*s (Red Espaola de Laboratorios Sostenibles). Dentro de su poltica se encuentra la de rebajar la cantidad de reactivo inicial, que los estudiantes emplean en la realizacin de las prcticas, con el objetivo principal de rebajar la cantidad de residuos generados. En el caso de la presente prctica, el calormetro que los estudiantes utilizan actualmente (vase la foto de la derecha) es mucho ms pequeo que el que se empleaba hasta el ao 2005. La cantidad de KNO3 utilizada con el antiguo calormetro era de 10 gramos por estudiante; 100 mL de NaOH y 100 mL de HCl.
18
Você também pode gostar
- Calorimetro Mezcla AcidoDocumento5 páginasCalorimetro Mezcla AcidoJah MiloAinda não há avaliações
- Práctica 3 - TermoquimicaDocumento9 páginasPráctica 3 - TermoquimicaNelsonJhonAinda não há avaliações
- U1901 Guia de Trabajos Prácticos Módulo III y IV 2020Documento22 páginasU1901 Guia de Trabajos Prácticos Módulo III y IV 2020Sebastian Lizarazo SotoAinda não há avaliações
- Practica 3 TermoquimicaDocumento9 páginasPractica 3 TermoquimicaLiAinda não há avaliações
- Calor de ReaccionDocumento5 páginasCalor de ReaccionChino Hpta100% (1)
- l8 BorraDocumento16 páginasl8 BorraErika GarciaAinda não há avaliações
- Calor de NeutralizacionDocumento7 páginasCalor de NeutralizacionAlán López0% (3)
- Determinación del cambio térmico en reacciones químicasDocumento17 páginasDeterminación del cambio térmico en reacciones químicasanon_449912698Ainda não há avaliações
- Laboratorio TermoquimicaDocumento10 páginasLaboratorio TermoquimicaCrisologo Ulloa FernandoAinda não há avaliações
- P1 Termoquimica PDFDocumento15 páginasP1 Termoquimica PDFJorge Luis Zambrana OcañaAinda não há avaliações
- Determinación del calor de neutralización mediante calorimetríaDocumento5 páginasDeterminación del calor de neutralización mediante calorimetríaArmando Ibarra FernandezAinda não há avaliações
- CALORIMETRÍADocumento11 páginasCALORIMETRÍAMartamaria GamboaAinda não há avaliações
- Termoquimica2 Laboratorio de Fisicoquimica UNMSMDocumento19 páginasTermoquimica2 Laboratorio de Fisicoquimica UNMSMwaldir marcelinoAinda não há avaliações
- Entalpía de neutralizaciónDocumento5 páginasEntalpía de neutralizaciónValentinaAinda não há avaliações
- Guia de Trabajos Prácticos 2do Módulo 2do Semestre 2018Documento23 páginasGuia de Trabajos Prácticos 2do Módulo 2do Semestre 2018genaradolores texeiraAinda não há avaliações
- Laboratorio N4Documento6 páginasLaboratorio N4KAREN JULISSA Villa EspinosaAinda não há avaliações
- Diapositivas - Calor de Neutralizacion-2014Documento15 páginasDiapositivas - Calor de Neutralizacion-2014Anonymous yEGP9hnAinda não há avaliações
- LAB QMA - 111 Práctica 2 CalorimetríaDocumento4 páginasLAB QMA - 111 Práctica 2 CalorimetríaKarla RomeroAinda não há avaliações
- Ilovepdf MergedDocumento23 páginasIlovepdf MergedRocio Alba paciosAinda não há avaliações
- Guion Laboratorio TyC NyNDocumento12 páginasGuion Laboratorio TyC NyNRocio Alba paciosAinda não há avaliações
- Practica5 PDFDocumento4 páginasPractica5 PDFGleymii AngelimarAinda não há avaliações
- TERMOQUIMICADocumento13 páginasTERMOQUIMICADiana AncoAinda não há avaliações
- Informe de TermoquimicaDocumento15 páginasInforme de TermoquimicapanachosaurioAinda não há avaliações
- CALORIMETRIADocumento5 páginasCALORIMETRIAMonrroy Choque KevinAinda não há avaliações
- Determinacion Calor de Formacion Del Ch3coona SergioDocumento13 páginasDeterminacion Calor de Formacion Del Ch3coona SergioGerson Oswaldo Diaz ContrerasAinda não há avaliações
- Informe 3 de Fiqui Presion de VaporDocumento12 páginasInforme 3 de Fiqui Presion de Vaporjhamer rivera nuñezAinda não há avaliações
- Calor de NeutralizacionDocumento13 páginasCalor de NeutralizacionAldo Garcilazo LopezAinda não há avaliações
- Termoquímica Laboratorio UNA-La MolinaDocumento17 páginasTermoquímica Laboratorio UNA-La MolinaLourdes LuqueAinda não há avaliações
- Practica 5 Calor de NeutralizacionDocumento5 páginasPractica 5 Calor de NeutralizacionDiego JavierAinda não há avaliações
- Guia de Laboratorio 4. - Calor de NeutralizacionDocumento3 páginasGuia de Laboratorio 4. - Calor de NeutralizacionJhojans Enrriquex riveraAinda não há avaliações
- Laboratorio Nº8Documento13 páginasLaboratorio Nº8Armando Ibarra FernandezAinda não há avaliações
- Informe CalorimetríaDocumento5 páginasInforme CalorimetríaDanna Ramírez :3Ainda não há avaliações
- Calor de NeutralizaciónDocumento8 páginasCalor de NeutralizaciónDarryAinda não há avaliações
- Termoquímica: Calor de reaccionesDocumento18 páginasTermoquímica: Calor de reaccionesDylan St BuilesAinda não há avaliações
- Lab 8 II FisicoquimicaDocumento23 páginasLab 8 II FisicoquimicaGustavo CondarcoAinda não há avaliações
- Informe 1 Fisic QuimDocumento14 páginasInforme 1 Fisic QuimTeves Rober PkmAinda não há avaliações
- Calorimetría: Determinación del calor de neutralización y disoluciónDocumento20 páginasCalorimetría: Determinación del calor de neutralización y disoluciónReyes Beltrán Daniela IsabelAinda não há avaliações
- Informe de LabDocumento16 páginasInforme de LabAndrea JimenezAinda não há avaliações
- Informe Práctico 5 (Final)Documento4 páginasInforme Práctico 5 (Final)Micchi AstudilloAinda não há avaliações
- Informe de Laboratorio 7 PDFDocumento22 páginasInforme de Laboratorio 7 PDFFrank Perez ChavezAinda não há avaliações
- Lab 1 (Termoquimica)Documento6 páginasLab 1 (Termoquimica)Jean Franco Pereira GuerrieroAinda não há avaliações
- Ley de Hess (Termodinamica)Documento12 páginasLey de Hess (Termodinamica)Arnold José Aguas ZuñigaAinda não há avaliações
- TP3 - Propiedades Termoquímicas de Reacciones y Compuestos InorgánicosDocumento8 páginasTP3 - Propiedades Termoquímicas de Reacciones y Compuestos InorgánicosAlejandro FloresAinda não há avaliações
- Lab 2 Calor de Formacion Del Nh4clDocumento11 páginasLab 2 Calor de Formacion Del Nh4clCarlos Jhair RodriguezAinda não há avaliações
- Informe 2 FisicoquimicaDocumento16 páginasInforme 2 FisicoquimicaJoZe TorresAinda não há avaliações
- Informe 1 Qca FisicaDocumento6 páginasInforme 1 Qca FisicaMatilde Santibáñez MéndezAinda não há avaliações
- Determinación de la ley cero de la termodinámicaDocumento9 páginasDeterminación de la ley cero de la termodinámicaRONDAN PEREZ FABRICIO WILERAinda não há avaliações
- Practica16 PDFDocumento5 páginasPractica16 PDFMayela SandovalAinda não há avaliações
- Informe CalorimetriaDocumento4 páginasInforme CalorimetriaKEYLA VANESSA MORALES RODRIGUEZ ESTUDIANTEAinda não há avaliações
- Laboratorio 3 - Calor de NeutralizacionDocumento4 páginasLaboratorio 3 - Calor de NeutralizacionAlex Ostos AlvaAinda não há avaliações
- TermoquimicaDocumento12 páginasTermoquimicaV Mendizabal JocelynAinda não há avaliações
- FQ TermoquimicaDocumento21 páginasFQ TermoquimicaMax Gerson Fer FernandezAinda não há avaliações
- Informe 1 Fisicoquimica TermoquimicaDocumento15 páginasInforme 1 Fisicoquimica TermoquimicaElMaharajaAinda não há avaliações
- Informe Fisicoquímica Ambiental UnadDocumento53 páginasInforme Fisicoquímica Ambiental Unadc1e2s3100% (2)
- Reporte Práctica 3. CalorimetriaDocumento4 páginasReporte Práctica 3. CalorimetriaSebastianAinda não há avaliações
- Informe Ley de HessDocumento8 páginasInforme Ley de HessRodrigoTejadaGallegosAinda não há avaliações
- Lab. Calor de NeutralizacionDocumento8 páginasLab. Calor de NeutralizacionLeo DonadoAinda não há avaliações
- Entalpia de NautralizacionDocumento6 páginasEntalpia de Nautralizacionantony usecheAinda não há avaliações
- Practica 5 de LaboratorioDocumento6 páginasPractica 5 de LaboratorioCarlitos AlvaradoAinda não há avaliações
- Aspectos de Seguridad Con CalderasDocumento11 páginasAspectos de Seguridad Con Calderastecnoscar1972Ainda não há avaliações
- Medicion Presion y CaudalDocumento20 páginasMedicion Presion y CaudalchapinoAinda não há avaliações
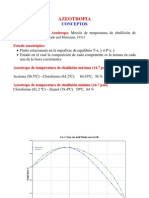
- AzeotropiaDocumento25 páginasAzeotropiaRicardo KobainAinda não há avaliações
- Conjuntos Numéricos-Guión de Clase #1Documento7 páginasConjuntos Numéricos-Guión de Clase #1Chuck BartowskyAinda não há avaliações
- Etanol Costos y PreciosDocumento102 páginasEtanol Costos y PreciosPeru2007Ainda não há avaliações
- Simulación de Procesos en Disoluciones de Alta ConcentraciónDocumento10 páginasSimulación de Procesos en Disoluciones de Alta ConcentraciónChuck BartowskyAinda não há avaliações
- Importancia Del Diseño IndustrialDocumento2 páginasImportancia Del Diseño IndustrialChuck BartowskyAinda não há avaliações
- Agentes contaminantes químicos del aire: Monóxido de carbono, Dióxido de azufre y otrosDocumento66 páginasAgentes contaminantes químicos del aire: Monóxido de carbono, Dióxido de azufre y otrosJessica NeyraAinda não há avaliações
- EnsayoDocumento6 páginasEnsayoFernando FariñasAinda não há avaliações
- Módulo 5 - Semana 2Documento3 páginasMódulo 5 - Semana 2CaraLuna SegoviaAinda não há avaliações
- El CompusDocumento2 páginasEl CompusELIAZAR FRANCISCO CHOQQUE TTITOAinda não há avaliações
- Guia de Quimica Periodo: Cuarto Grado: Octavo Docente: Ing. Anderson Camilo Preciado 2022Documento6 páginasGuia de Quimica Periodo: Cuarto Grado: Octavo Docente: Ing. Anderson Camilo Preciado 2022Ariana RicoAinda não há avaliações
- Formacion de Mezclas Homogenias y HeterogeniasDocumento4 páginasFormacion de Mezclas Homogenias y HeterogeniasHenry Vizcarra0% (1)
- Geología y Sus Efectos en VoladuraDocumento9 páginasGeología y Sus Efectos en VoladuraElder Molocho DiazAinda não há avaliações
- Clase Biologia I Sucesiones PDFDocumento31 páginasClase Biologia I Sucesiones PDFMaria Alexandra MendozaAinda não há avaliações
- Eras GeológicasDocumento2 páginasEras GeológicasTiare MontecinosAinda não há avaliações
- Biblioteca-cafeteria de la Academia de Artes Escénicas Utopía renovada en edificio históricoDocumento12 páginasBiblioteca-cafeteria de la Academia de Artes Escénicas Utopía renovada en edificio históricolaura100% (1)
- Cinematica Prueba-De-Fisica-Tema-EnergiaDocumento4 páginasCinematica Prueba-De-Fisica-Tema-EnergiaOSCARAinda não há avaliações
- De Guadalajara: Del Área MetropolitanaDocumento180 páginasDe Guadalajara: Del Área MetropolitanaHECTOR CASTELLANOS VILLALPANDOAinda não há avaliações
- 1er Parci Eln 125 Resp PDFDocumento4 páginas1er Parci Eln 125 Resp PDFAlex Paredes SaavedraAinda não há avaliações
- BASICODocumento70 páginasBASICOLuis BustamanteAinda não há avaliações
- Proyecto Piedra LargaDocumento232 páginasProyecto Piedra LargaLuis Alberto Otero HerreraAinda não há avaliações
- Ser y Deber SerDocumento2 páginasSer y Deber SerMaggie M'GillAinda não há avaliações
- TERMODINÁMICA SEMANA 1Documento47 páginasTERMODINÁMICA SEMANA 1Sebastian Salazar Oñate100% (1)
- 1 - Una Breve Historia de Casi Todo - Bill BrysonDocumento12 páginas1 - Una Breve Historia de Casi Todo - Bill BrysonArturo Dais Hernandes0% (1)
- Cap. I Resumen EjecutivoDocumento35 páginasCap. I Resumen EjecutivoalcidesAinda não há avaliações
- DE - Guía de Ejercicios N°1 (Rev. 0.2)Documento41 páginasDE - Guía de Ejercicios N°1 (Rev. 0.2)Igna DimAinda não há avaliações
- Conferencia Sobre WotanismoDocumento9 páginasConferencia Sobre WotanismoMarkku_VisigodoAinda não há avaliações
- INF3-Inclusiones Fluidas Aplicadas A La Exploración de Los Yacimientos Minerales Tipo Porfidos y SkarnDocumento19 páginasINF3-Inclusiones Fluidas Aplicadas A La Exploración de Los Yacimientos Minerales Tipo Porfidos y SkarnJENNIFER RUIZ100% (1)
- Exámen Final Geografía Turística. Yonaidis SotoDocumento3 páginasExámen Final Geografía Turística. Yonaidis SotoYonaidis SotoAinda não há avaliações
- Taller Ecuaciones y Reacciones Químicas 1.0Documento2 páginasTaller Ecuaciones y Reacciones Químicas 1.0wilson rodriguezAinda não há avaliações
- Energías renovables y medio ambienteDocumento152 páginasEnergías renovables y medio ambienteRENZO7624Ainda não há avaliações
- TurbiditasDocumento26 páginasTurbiditasLuis Meza ArroyoAinda não há avaliações
- Excavaciones y Zanjas Marcobre Marzo 2018Documento88 páginasExcavaciones y Zanjas Marcobre Marzo 2018VenancioArpiMamaniAinda não há avaliações
- Número de Reynolds: predicción del flujo laminar o turbulentoDocumento8 páginasNúmero de Reynolds: predicción del flujo laminar o turbulentoOrlando TolentinoAinda não há avaliações
- Trabajo de TermodinamicaDocumento6 páginasTrabajo de TermodinamicaBryan Milla TrejoAinda não há avaliações
- Marquerhua Ponce-Valverde ApfataDocumento122 páginasMarquerhua Ponce-Valverde ApfataJUAN JOSE JUNIOR MUÑIZ TORRESAinda não há avaliações