Escolar Documentos
Profissional Documentos
Cultura Documentos
Determinación de La Ka Del Ácido Acético
Enviado por
Roger ManzanarezTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Determinación de La Ka Del Ácido Acético
Enviado por
Roger ManzanarezDireitos autorais:
Formatos disponíveis
6. VALORACIN POTENCIOMTRICA: DETERMINACIN DE LA CONSTANTE DE ACIDEZ DEL CIDO ACTICO. I.-Introduccin.
La determinacin potenciomtrica de la concentracin de iones hidrgeno, [H+], requiere la utilizacin de un electrodo de vidrio acoplado a un pHmetro (potencimetro). El electrodo con membrana de vidrio sumergido en una disolucin de pH desconocido (Figura 1) establece una diferencia de potencial entre la parte interna de la membrana (en contacto con la disolucin interna del mismo y de pH constante) y la parte externa de la membrana en contacto con la disolucin problema. Esta diferencia de potencial, respecto a un electrodo de referencia, es proporcional a la diferencia en concentracin de H+ en ambas disoluciones. El pHmetro mide esta diferencia de potencial y la transforma en una escala de pH. As, el mtodo potenciomtrico nos permite seguir cuantitativamente la concentracin de H+ en el transcurso de una reaccin cido-base. El mtodo potenciomtrico es ms general y as la utilizacin de electrodos selectivos de otros iones (ej. iones metlicos) proporciona medidas cuantitativas de la concentracin de stos de forma anloga a la descrita anteriormente.
II.- Objetivos. El objetivo de la prctica es doble, por una parte introducir al alumno en el campo cuantitativo donde, a diferencia del cualitativo, la medicin exacta de todas las variables es de capital importancia y por otra parte, ilustrar la utilizacin del mtodo potenciomtrico en dos de sus aplicaciones ms importantes: (1) valoracin potenciomtrica cido-base y (2) utilizacin de los datos potenciomtricos obtenidos en una valoracin para la determinacin de una constante de acidez. La valoracin potenciomtrica de un cido frente a una base permitir determinar el volumen de equivalencia, a partir del cual podremos calcular la concentracin de uno de ellos siempre y cuando conozcamos con exactitud la concentracin del otro. Es pues de enorme importancia la medicin exacta de los volmenes de los reactivos que se van a utilizar a lo largo de la prctica. El tratamiento cuantitativo de los valores de pH obtenidos en la valoracin permitir determinar el valor de la constante de acidez. Es pues igualmente importante medir los valores de pH lo ms exactamente posible. Cualquier error en la medicin, tanto de volmenes como de pH, ser un error en la constante determinada.
29
Bibliografa: 1.P.W.Atkins. Qumica General. 1989 Tema 15. Ed. Omega. 2.Tabla de indicadores cido-base (ver Anexo 5). 3. Tabla de constantes de ionizacin (ver Anexo 6). III.- Cuestiones preliminares. Lee atentamente cada uno de los apartados de esta prctica y a continuacin intenta responder a las siguientes cuestiones antes de realizar las experiencias propuestas. 1. A partir de los datos que figuran en la etiqueta o en la ficha de seguridad, indica los posibles riesgos que puede implicar la manipulacin del hidrxido sdico y las precauciones que se deben de tomar en su manipulacin. 2. Discute y razona los balances de masas y cargas (ecuaciones (6) y (7) y deduce las ecuaciones (8) y (9). 3. Discute y comprueba numricamente las indicaciones de la NOTA del ltimo apartado. 4. Calcula los mililitros de una disolucin de NaOH 0.1 M que se requieren para "neutralizar" 100 mL de una disolucin (a) 0.01 M en HCl, (b) 0.01 M en HAc y (c) 0.01 M en cido oxlico. 5. Calcula el pH resultante cuando a 100 mL de una disolucin 0.01 M en HCl se le aaden los siguientes volmenes de una disolucin de NaOH 0.1 M: a) 9 mL, b) 10 mL, c) 11 mL. 6. Haz lo mismo que en la cuestin 4 pero, remplazando la disolucin de HCl por una de HAc de la misma concentracin (Ka=1.8 10-5). Calcula [HAc] y [Ac-] en cada punto.
Figura 2. Montaje de la prctica
IV.- Experimental. (a) Material y Reactivos: Montaje y calibrado de pHmetro. A continuacin se indica el material y reactivos especficos de esta prctica. Reactivos anlogos correspondientes a otras prcticas no deben de usarse en sta. En la Figura 2 se indica el montaje que debe realizarse. Antes de realizar cualquier medida de pH el pHmetro debe calibrarse con tampones de pH 4 y 7. Para este calibrado se consultar la hoja de instrucciones que hay junto al pHmetro.
30
Material. 1) pHmetro y electrodo de vidrio. 2).Agitador magntico y barrita imantada para agitar. 3) Dos vasos de precipitados de 100 mL de plstico y uno de 150 mL de vidrio. 4) Pipeta de 10 mL y propipeta. 5) Una bureta de 25 mL y una de 50 mL para el agua. 6) Papel milimetrado y calculadora. Reactivos. 1) Disolucin de cido clorhdrico exactamente valorada (aprox. 0.1 M). 2) Disolucin de NaOH aprox. 0.1 M para ser valorada. 3) Disolucin de cido actico aprox. 0.1 M para ser valorada. 4) Disoluciones tampn de pH 4 y 7 para calibrar el pH-metro
(b) Valoracin cido fuerte-base fuerte. Se toman 10 mL, medidos con pipeta, de "HCl valorado" (No se pipetean directamente del frasco, sino que se ponen unos 15 mL en un vasito limpio) y se trasvasan a un vaso de 150 mL. Se aaden 90 mL de agua destilada con la bureta de 50 mL. Finalmente se coloca el electrodo en la misma. A criterio del profesor se podr aadir 2 gotas de fenolftalena. En la bureta de 25 mL se introduce la disolucin de "NaOH a valorar" y se enrasa a cero. Desde sta se deja caer la disolucin de NaOH sobre el vaso, con intervalos de 0.5 mL, agitando continuamente y se mide el pH despus de cada vertido. En las proximidades del punto final, cuando en una adicin el valor del pH vara considerablemente respecto de las anteriores, las adiciones debern ser cada vez ms pequeas pero no inferiores a 0.1 mL. Continuar la valoracin hasta haber aadido un total de aproximadamente 20 mL de la sosa.
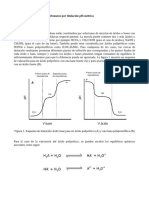
(c) Valoracin del cido actico. En esta experiencia se hace exactamente lo mismo que en la anterior (apartado b) pero en lugar de poner 10 mL de HCl se aaden 10 mL de la disolucin "HAc a valorar". En este caso es muy importante obtener lecturas de pH estables, para ello se debe comprobar la constancia de la misma en cada adicin. V.- Resultados y Discusin. Determinacin de la concentracin de NaOH y HAc. En cada una de estas experiencias se representan grficamente los valores de pH frente al volumen del valorante en mL (VB). El punto de inflexin de las curvas nos determina el volumen del valorante en el punto de equivalencia (ver Figura 3 y la cuestin 5), a partir del cual y utilizando la ecuacin (1) se calcula la concentracin de la especie a valorar (por ejemplo A) si conocemos exactamente la concentracin de la otra (ej. B). VA . CA = VB . CB (1)
As, puesto que la concentracin del cido HCl es conocida, se puede calcular la concentracin de la disolucin de NaOH (aqu VA=10 mL y VB= volumen de equivalencia obtenido en el apartado
31
(IV.b)). Anlogamente y una vez calculada la concentracin de NaOH, se puede calcular la del cido actico (en este caso VA=10 mL y VB= vol. eq. del apartado (IV.c)). Determinacin del producto inico del agua Kw El producto inico del agua (o constante de autoprotlisis), Kw se define segn (2), de la cual podemos deducir (3). Kw = [OH-].[H3O+] log[OH-] = logKw + pH (2) (3)
A partir de los puntos (pH, VB) tomados inmediatamente despus del salto de la curva de valoracin HCl-NaOH (apartado IV.b), podemos calcular tericamente el valor de [OH-] segn (4), mientras que los de pH sern los obtenidos potenciomtricamente para los correspondientes VB (la definicin de los smbolos se da ms abajo). [OH-] = (VB.CoB - VA.CoA)/VT (4)
Una representacin de los valores de log[OH-] frente a los de pH nos proporcionar una recta de pendiente unidad y de ordenada en el origen logKw. Determinacin de la Constante de Acidez del cido Actico. La disociacin del cido actico en agua corresponde al equilibrio HAc + H2O = Ac- + H3O+ que tiene una constante de equilibrio Ka ( constante de acidez) Ka = [Ac-].[H3O+]/[HAc] (5)
Es claro que para determinar el valor de Ka necesitamos conocer [Ac-], [HAc] y [H3O+] en el equilibrio. Si bien [H3O+] puede determinarse potenciomtricamente, no disponemos de "aparatos" anlogos capaces de medir [Ac-] y [HAc]. Para poder deducirlas tendremos que utilizar nuestros conocimientos sobre el equilibrio qumico y desarrollar ecuaciones matemticas que lo permitan. Muy comunes y tiles son los llamados balances de masas y de cargas (ecuaciones (6) y (7) respectivamente). CHAc = [Ac-] + [HAc] (6) [Na+] + [H3O+] = [OH-] + [Ac-] (7) A partir de (6) y (7) fcilmente podemos deducir las ecuaciones (8) y (9) que nos proporcionan los valores de [Ac-] y [HAc] respectivamente. [Ac-] = VB.CoB/VT + [H3O+] - Kw/[H3O+] [HAc] = VHAc.CoHAc/VT - [Ac-] (8) (9)
32
En donde se ha tenido en cuenta que [OH-] = Kw/[H3O+], CHAc = VHAc.CoHAc/VT y [Na+] es la concentracin del in sodio debido solamente a la adicin de NaOH (es decir [Na+] = VB.CoB/VT). El significado de los dems parmetros se indican a continuacin: VT = Volumen total de la disolucin en cada punto ( VT= VB+Vo ). Vo = Volumen inicial de la disolucin ( 100 mL). VB = Volumen de NaOH aadido. VHAc= Volumen de HAc aadido. COB =Concentracin de NaOH utilizada. COHAc = Concentracin de HAc utilizado. Kw = Constante de autoprotlisis del agua (en las condiciones de la prctica, pKw=13.85). NOTA.- Se ha introducido la variable VT para tener en cuenta la dilucin de los reactivos por la adicin de NaOH. As pues, para cualquier punto (VB, pH) de la curva de valoracin podemos calcular las correspondientes concentraciones de Ac- y HAc existentes en el equilibrio y determinar Ka mediante la ec.(5). Sin embargo, cuando se dispone de una curva completa de valoracin se puede trabajar de la forma que se describe a continuacin, en donde se minimizan los errores y se verifica la bondad de la experiencia realizada. De la expresin (5) se deduce fcilmente la (10), pH = pKa + lg[Ac-]/[HAc] (10)
Si representamos el pH (en ordenadas) en funcin de lg[Ac-]/[HAc], obtendremos una lnea recta de pendiente la unidad y cuya ordenada en el origen es pKa. Para ello tomaremos los puntos ms representativos del equilibrio, es decir los comprendidos en el intervalo a-b (figura 4), o sea, los comprendidos entre un 10 y un 90% de la valoracin aproximadamente. * NOTA.-Es claro que para pH inferiores a 6, el ltimo trmino de la ecuacin (8), Kw/[H3O+] puede eliminarse. Adems, aunque en los primeros puntos de la valoracin el segundo trmino, [H3O+], puede tener cierta influencia, para pH superiores a 4 5 puede eliminarse tambin.
VI.-Cuestiones. 1.- Comentar la forma de las curvas de valoracin (HCl y HAc) y calcular el pH del punto final en cada una de ellas. 2.- Deducir las concentraciones de Ac- y HAc para las cuales pH = pKa. Utiliza la curva de valoracin para determinar el valor correspondiente de VB. Discutir el valor encontrado. 3.- Por qu es mucho ms importante obtener medidas de pH estables en la valoracin de HAc que en la de cido fuerte-base fuerte?. 4. Se puede utilizar el indicador fenolftalena para determinar el punto de equivalencia en la valoracin cido actico-sosa?
33
34
Você também pode gostar
- P4.determinacion de Calcio en Tabletas, Con EdtaDocumento10 páginasP4.determinacion de Calcio en Tabletas, Con EdtaArt UR ML67% (3)
- FT Cesol PVCDocumento4 páginasFT Cesol PVCSebastian Bdya50% (4)
- INFORME PermanganometriaDocumento20 páginasINFORME PermanganometriaMay_LOVEme0% (4)
- Determinación de La Eficiencia de Los Electrodos de VidrioDocumento4 páginasDeterminación de La Eficiencia de Los Electrodos de VidrioElizabeth ChavanaAinda não há avaliações
- Previo Sintesis de B NerolinaDocumento13 páginasPrevio Sintesis de B NerolinaUlises Ramírez MatheyAinda não há avaliações
- Determinación Del Calor Específico de Los MetalesDocumento10 páginasDeterminación Del Calor Específico de Los Metaleslaurase444Ainda não há avaliações
- Informe Bioquímica AminoácidosDocumento10 páginasInforme Bioquímica AminoácidosGeraldine100% (1)
- Practica EQUIPO 3 Dureza Del AguaDocumento4 páginasPractica EQUIPO 3 Dureza Del AguaRicardo Aragón100% (1)
- Ex Posicion EsDocumento26 páginasEx Posicion EsJosse RodriguezAinda não há avaliações
- Hiperconjugacion DefinicionDocumento2 páginasHiperconjugacion DefinicionDiego Guayacan100% (1)
- Titulaciones AmperometricasDocumento3 páginasTitulaciones AmperometricasJuzif AltairAinda não há avaliações
- Diseño de Prototipo Cilindro-ÉmboloDocumento16 páginasDiseño de Prototipo Cilindro-ÉmboloMiguel DominguezAinda não há avaliações
- PRACTICA #6-QUIMICA ANALITICA-VOLUMETRÍA de PRECIPITACION - Determinación de La Concentraciòn de Cloruros en El Agua PotableDocumento8 páginasPRACTICA #6-QUIMICA ANALITICA-VOLUMETRÍA de PRECIPITACION - Determinación de La Concentraciòn de Cloruros en El Agua PotableCynthia GonzalesAinda não há avaliações
- Informe KpsDocumento3 páginasInforme KpsHeyder EduardoAinda não há avaliações
- Determinación Del PKa Del Azul de BromotimolDocumento4 páginasDeterminación Del PKa Del Azul de BromotimoldanielAinda não há avaliações
- Complejometria. InformeDocumento11 páginasComplejometria. InformeDavid Espinosa SuárezAinda não há avaliações
- Informe # 1 Estandarización de NaOHDocumento13 páginasInforme # 1 Estandarización de NaOHTania Álvarez OliveraAinda não há avaliações
- TareaDocumento15 páginasTareaLuis Alberto Apaza ArceAinda não há avaliações
- Calor de Neutralización (Lab.)Documento3 páginasCalor de Neutralización (Lab.)Maryyy BatistaAinda não há avaliações
- TITULACIÓN PotenciometricaDocumento5 páginasTITULACIÓN PotenciometricaAlvi-pba SantiagoAinda não há avaliações
- Informe de Agua Bioquimica PDFDocumento3 páginasInforme de Agua Bioquimica PDFGabriel Cerra100% (1)
- Proyecto 3 Agua OxigenadaDocumento6 páginasProyecto 3 Agua OxigenadaHumbertoSalamancaAinda não há avaliações
- Aplicaciones de Las Titulaciones de Neutralización (C)Documento7 páginasAplicaciones de Las Titulaciones de Neutralización (C)Necroz182100% (1)
- Informe Valoracion Potenciometrica Acido-BaseDocumento16 páginasInforme Valoracion Potenciometrica Acido-BasePaola Valverde100% (1)
- Ejercicios Ácidos Polipróticos y ComplejosDocumento22 páginasEjercicios Ácidos Polipróticos y ComplejosSantiago100% (2)
- Determinar Constante de Acidez Del Ácido AcéticoDocumento3 páginasDeterminar Constante de Acidez Del Ácido AcéticoludinAinda não há avaliações
- Metodologia Determinación de Acidez Total Por PotenciometriaDocumento4 páginasMetodologia Determinación de Acidez Total Por PotenciometriaEd José BuenoAinda não há avaliações
- Estudio de La Cinética de Oxidacion Del Ion Ioduro Con Peroxido de HidrogenoDocumento8 páginasEstudio de La Cinética de Oxidacion Del Ion Ioduro Con Peroxido de Hidrogenojorge11daAinda não há avaliações
- Efecto de Los Electrolitos Sobre El Equilibrio QuímicoDocumento14 páginasEfecto de Los Electrolitos Sobre El Equilibrio QuímicoValentina PeñaAinda não há avaliações
- Determinación Volumétrica de Haluros Por Formación de PrecipitadosDocumento6 páginasDeterminación Volumétrica de Haluros Por Formación de PrecipitadosJorly Torres100% (1)
- Informe 5Documento4 páginasInforme 5LEIDY CORDERO PÉREZAinda não há avaliações
- Informe Coeficiente de Reparto RealDocumento20 páginasInforme Coeficiente de Reparto RealDaniel MoralesAinda não há avaliações
- Calibración de Un Calorímetro Por El Método de Dilución de H2SO4Documento14 páginasCalibración de Un Calorímetro Por El Método de Dilución de H2SO4Andrea MelendezAinda não há avaliações
- Determinación de Cloruros Por El Método de FajansDocumento5 páginasDeterminación de Cloruros Por El Método de FajansMontserrat CansinoAinda não há avaliações
- INFORME PRACTICA 3 CALOR DE DISOLUCION Y DE NEUTRALIZACION-comprimidoDocumento13 páginasINFORME PRACTICA 3 CALOR DE DISOLUCION Y DE NEUTRALIZACION-comprimidoDimar MontejoAinda não há avaliações
- Taller Anal 4Documento7 páginasTaller Anal 4Anonymous chYtaltebAinda não há avaliações
- Agua Cloruros Dureza Alcalinidad UNIVERSDocumento73 páginasAgua Cloruros Dureza Alcalinidad UNIVERSvanessa tatiana garzon galindoAinda não há avaliações
- Mezcla de Acidos Practica 1Documento4 páginasMezcla de Acidos Practica 1Anthonio MothaAinda não há avaliações
- Sintesis de K3 (MN (OX) 3) .3H2ODocumento4 páginasSintesis de K3 (MN (OX) 3) .3H2OCARLOS EDUARDO ZORRO RIVERAAinda não há avaliações
- INFORME-IVDocumento2 páginasINFORME-IVsilviaAinda não há avaliações
- Práctica 5 Análisis Carbonatos BicarbonatosDocumento4 páginasPráctica 5 Análisis Carbonatos BicarbonatosFranklin Pastrana ArteagaAinda não há avaliações
- Practica 10Documento4 páginasPractica 10Oscar AlmazánAinda não há avaliações
- Informe Inorganica II Prectica Complejos Octaedricos CorregidoDocumento9 páginasInforme Inorganica II Prectica Complejos Octaedricos Corregidozaira aguirre100% (1)
- Analisis de Niquel en Muestra de Acero Por Espectrofotometria Uv-VisibleDocumento6 páginasAnalisis de Niquel en Muestra de Acero Por Espectrofotometria Uv-VisibleJulio BlancoAinda não há avaliações
- Teoria Analitica IDocumento28 páginasTeoria Analitica IAle JoAinda não há avaliações
- Determinacion Acidez en VinagreDocumento3 páginasDeterminacion Acidez en VinagreAngie Rozo0% (1)
- Guía Ley de RepartoDocumento1 páginaGuía Ley de RepartoCarolina RoblesAinda não há avaliações
- Informe Constante de Producto de Solubilidad, Kps y Efecto Ion Común (Química General) - UNALMDocumento15 páginasInforme Constante de Producto de Solubilidad, Kps y Efecto Ion Común (Química General) - UNALMAndres Atilio Durand CrucesAinda não há avaliações
- Determinacion de La Curva de Solubilidad FINALDocumento10 páginasDeterminacion de La Curva de Solubilidad FINALmariaAinda não há avaliações
- Informe 3Documento5 páginasInforme 3Santiago Ospina AreizaAinda não há avaliações
- Evaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDocumento3 páginasEvaluaciòn Del Porcentaje de Acidez de Vinagre ComercialDayana BotelloAinda não há avaliações
- Cromatografia (1) - 1Documento5 páginasCromatografia (1) - 1MORALES SERGIOAinda não há avaliações
- Soluciones AmortiguadorasDocumento6 páginasSoluciones AmortiguadorasAndrea LopezAinda não há avaliações
- Conductividad MolarDocumento3 páginasConductividad MolarLeonardo Medina GermanottaAinda não há avaliações
- Reporte No. 2 (Diagrama de Flood)Documento26 páginasReporte No. 2 (Diagrama de Flood)Pablo José Rosales100% (1)
- Taller Neutralización Ácido-BaseDocumento17 páginasTaller Neutralización Ácido-BaseXiomara SanchezAinda não há avaliações
- Cuestionario 1 FQIIDocumento4 páginasCuestionario 1 FQIIBryan BautistaAinda não há avaliações
- ValoracionesDocumento6 páginasValoracionesescherichioAinda não há avaliações
- PotenciometriaDocumento10 páginasPotenciometriatroy6959Ainda não há avaliações
- 10 Curvas de Titulacion Acido BaseDocumento4 páginas10 Curvas de Titulacion Acido BaseAlejandro GómezAinda não há avaliações
- Conferencia 2Documento10 páginasConferencia 2Denis Lopez MartinezAinda não há avaliações
- More Than Simulators - Ref 3180 - SIMULADOR PARA INYECCIONES FACIALES - MODELO AVANZADODocumento2 páginasMore Than Simulators - Ref 3180 - SIMULADOR PARA INYECCIONES FACIALES - MODELO AVANZADORoger ManzanarezAinda não há avaliações
- Conferencia Unidad 1 - Parte 2Documento34 páginasConferencia Unidad 1 - Parte 2Roger ManzanarezAinda não há avaliações
- IESALDocumento161 páginasIESALUriel TorresAinda não há avaliações
- Guia Vida Util en AnalquelDocumento33 páginasGuia Vida Util en AnalquelFelipe Florian Santiago Gomez100% (1)
- Matricectomía Química Con FenolDocumento2 páginasMatricectomía Química Con FenolRoger ManzanarezAinda não há avaliações
- Unidad 3 Conferencia 1 PublicDocumento48 páginasUnidad 3 Conferencia 1 PublicRoger ManzanarezAinda não há avaliações
- Toma, Manejo y Preservación de Muestras de AlimentosDocumento52 páginasToma, Manejo y Preservación de Muestras de AlimentosRoger ManzanarezAinda não há avaliações
- Lab #5 - Determinación Colorimétrica de CHO TotalesDocumento7 páginasLab #5 - Determinación Colorimétrica de CHO TotalesRoger ManzanarezAinda não há avaliações
- Conferencia Unidad 1 Public PDFDocumento22 páginasConferencia Unidad 1 Public PDFLuden Javier Dávila AcuñaAinda não há avaliações
- Conferencia Unidad 1 - Parte 2Documento34 páginasConferencia Unidad 1 - Parte 2Roger ManzanarezAinda não há avaliações
- Decreto PDFDocumento48 páginasDecreto PDFKaled ChaconAinda não há avaliações
- Compilacion LEGISLACION AMBIENTAL NICARAGUADocumento14 páginasCompilacion LEGISLACION AMBIENTAL NICARAGUAEnoc TerceroAinda não há avaliações
- CVPPCODocumento25 páginasCVPPCORoger ManzanarezAinda não há avaliações
- Lab #5 - Determinación Colorimétrica de CHO TotalesDocumento7 páginasLab #5 - Determinación Colorimétrica de CHO TotalesRoger ManzanarezAinda não há avaliações
- Mejoramiento Torres NicaraguaDocumento16 páginasMejoramiento Torres NicaraguaharrylopAinda não há avaliações
- Determinación Analítica de LípidosDocumento19 páginasDeterminación Analítica de LípidosRoger ManzanarezAinda não há avaliações
- Decreto PDFDocumento48 páginasDecreto PDFKaled ChaconAinda não há avaliações
- Folleto Metrologa General PDFDocumento81 páginasFolleto Metrologa General PDFRoger ManzanarezAinda não há avaliações
- Cepal Tipología Der AmbDocumento35 páginasCepal Tipología Der AmbJuan ValerAinda não há avaliações
- Certificación de Calidad de Alimentos LA PDFDocumento44 páginasCertificación de Calidad de Alimentos LA PDFRoger ManzanarezAinda não há avaliações
- Compilacion LEGISLACION AMBIENTAL NICARAGUADocumento14 páginasCompilacion LEGISLACION AMBIENTAL NICARAGUAEnoc TerceroAinda não há avaliações
- Póster MTIL 2019Documento1 páginaPóster MTIL 2019Roger ManzanarezAinda não há avaliações
- Ingenieria Del Software - Benet Campderrich FalguerasDocumento321 páginasIngenieria Del Software - Benet Campderrich FalguerasTheGuilleAinda não há avaliações
- Ley No. 705 PDFDocumento7 páginasLey No. 705 PDFRoger ManzanarezAinda não há avaliações
- Codex AlimentariusDocumento58 páginasCodex AlimentariusJosé Esqueda LeyvaAinda não há avaliações
- Toma, Manejo y Preservación de Muestras de AlimentosDocumento52 páginasToma, Manejo y Preservación de Muestras de AlimentosRoger ManzanarezAinda não há avaliações
- Medición de Campos Electromagnéticos en Cali, ColombiaDocumento10 páginasMedición de Campos Electromagnéticos en Cali, ColombiaRoger ManzanarezAinda não há avaliações
- Plan de Manejo Ambiental Por Contaminación ElectromagnéticaDocumento21 páginasPlan de Manejo Ambiental Por Contaminación ElectromagnéticaRoger ManzanarezAinda não há avaliações
- Ing. Del Software LibreDocumento314 páginasIng. Del Software LibreCompirry CocoAinda não há avaliações
- Recomendación UIT-T K52Documento48 páginasRecomendación UIT-T K52Roger ManzanarezAinda não há avaliações
- Eficiencia TermicaDocumento12 páginasEficiencia TermicaDanilo AlvarengaAinda não há avaliações
- Prácticas Biquimica Primera Parte-2022Documento7 páginasPrácticas Biquimica Primera Parte-2022NATALIA ALEJANDRA GONZALEZ IBAÑEZAinda não há avaliações
- 3.1 PPT Teorías AtómicasDocumento17 páginas3.1 PPT Teorías AtómicasEstefany AvalosAinda não há avaliações
- Mapa ConceptualDocumento2 páginasMapa ConceptualMiriam HernandezAinda não há avaliações
- Guía 6 - Determinar Acidez Total, Fija, Volátil 2020Documento5 páginasGuía 6 - Determinar Acidez Total, Fija, Volátil 2020Celina Ramos CervantesAinda não há avaliações
- Laboratorio de Cual-2Documento17 páginasLaboratorio de Cual-2Odalis Mallqui RiosAinda não há avaliações
- 1 9Documento8 páginas1 9DanielaAinda não há avaliações
- Transferencia de Calor en Los Yacimientos Petroleros y Sus Ecuaciones de EstadoDocumento35 páginasTransferencia de Calor en Los Yacimientos Petroleros y Sus Ecuaciones de EstadoAlfredo Serrano100% (1)
- Compuestos Organometálicos de PT (II) y Ru (II) Con El Grupo Electroactivo FerroceniloDocumento397 páginasCompuestos Organometálicos de PT (II) y Ru (II) Con El Grupo Electroactivo FerroceniloAna Gil QuirogaAinda não há avaliações
- Practica #7Documento6 páginasPractica #7Jimena AlvaradoAinda não há avaliações
- Determination of Particulate Matter Emission From Stationary SourcesDocumento43 páginasDetermination of Particulate Matter Emission From Stationary SourcesJuan Carlos Ramirez A.Ainda não há avaliações
- Sincado y Decapado de CobreDocumento13 páginasSincado y Decapado de CobrePamelita JulcaAinda não há avaliações
- 1°aa-Equipos & SistemasDocumento36 páginas1°aa-Equipos & SistemasValentina Ivana GERONIMO FADU - UBAAinda não há avaliações
- AQ Práctica N 6Documento8 páginasAQ Práctica N 6javierAinda não há avaliações
- Proyecto FinalDocumento216 páginasProyecto FinalPaola katerine GrajalesAinda não há avaliações
- L. A - Practica #3Documento10 páginasL. A - Practica #3CarmenAinda não há avaliações
- Prueba de Conductividad Del Abrasivo HT INGENIERIA & CONSULTORIA S.a.C. 191120Documento2 páginasPrueba de Conductividad Del Abrasivo HT INGENIERIA & CONSULTORIA S.a.C. 191120Roberto RicraAinda não há avaliações
- Practico 1Documento3 páginasPractico 1escalanteveizagajussetaldahirAinda não há avaliações
- Eficiencia Energética Ciclos Combinados Marzo 2014Documento6 páginasEficiencia Energética Ciclos Combinados Marzo 2014carloreysotoAinda não há avaliações
- Evolucion Modelo AtomicoDocumento5 páginasEvolucion Modelo AtomicoAzInes02Ainda não há avaliações
- Compuestos Inorgánicos y OrganicosDocumento14 páginasCompuestos Inorgánicos y OrganicosDitxiz senpaiAinda não há avaliações
- Practica de Laboratorio Semana 13 - Grupo 3Documento18 páginasPractica de Laboratorio Semana 13 - Grupo 3Liga Distrital DE Los Baños DEL IncaAinda não há avaliações
- Historia Del BencenoDocumento2 páginasHistoria Del BencenoGuadalupeAinda não há avaliações
- Plan de Mejoramiento Química 11 p1Documento33 páginasPlan de Mejoramiento Química 11 p1FREDY RODRIGUEZAinda não há avaliações
- Físico Farmacia' Calculo FarmaceuticoDocumento4 páginasFísico Farmacia' Calculo FarmaceuticoCaterine VarelaAinda não há avaliações
- Ejemplo Pre OrgánicaDocumento32 páginasEjemplo Pre OrgánicaMafer Guerra0% (1)
- Gases RealesDocumento17 páginasGases RealesE.G.C.Ainda não há avaliações
- Protección Del Acero Por GalvanizadoDocumento5 páginasProtección Del Acero Por GalvanizadoAngel BuendiaAinda não há avaliações