Escolar Documentos
Profissional Documentos
Cultura Documentos
Determinacion Del PH Por El Metodo Electrometrico
Enviado por
Ariel Nina ChoqueTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Determinacion Del PH Por El Metodo Electrometrico
Enviado por
Ariel Nina ChoqueDireitos autorais:
Formatos disponíveis
DETERMINACION DEL PH POR EL METODO ELECTROMETRICO OBJETIVO Determinar el ph en agua de ingenio.
FUNDAMENTO TEORICO El pH es una medida de acidez o alcalinidad de una disolucin. El pH indica la concentracin de + iones hidronio [H3O ] presentes en determinadas sustancias. La sigla significa potencial hidrgeno, potencial de hidrgeno o potencial de hidrogeniones (pondus Hydrogenii o potentia Hydrogenii; del latn pondus, n. = peso; potentia, f. = potencia; hydrogenium, n. = hidrgeno). Este trmino fue acuado por el qumico dans S. P. L. Srensen (1868-1939), quien lo defini como el logaritmo negativo en base 10 de la actividad de los iones hidrgeno. Esto es:
Desde entonces, el trmino "pH" se ha utilizado universalmente por lo prctico que resulta para evitar el manejo de cifras largas y complejas. En disoluciones diluidas, en lugar de utilizar la actividad del ion hidrgeno, se le puede aproximar empleando la concentracin molar del ion hidrgeno. Por ejemplo, una concentracin de [H3O ] = 1 10 7 7 ya que: pH = log[10 ] = 7
+ 7
M (0,0000001) es simplemente un pH de
La escala de pH tpicamente va de 0 a 14 en disolucin acuosa, siendo cidas las disoluciones con pH menores a 7 (el valor del exponente de la concentracin es mayor, porque hay ms iones en la disolucin) y alcalinas las que tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolucin (cuando el disolvente es agua). En productos de aseo y limpieza se suele hacer uso del trmino "pH neutro". En este caso la neutralidad hace referencia a un nivel de pH 5,5. Debido a las caractersticas de la piel humana, cuyo pH es 5,5, se indica neutralidad de pH en este tipo de productos que estn destinados a entrar en contacto con nuestra piel para destacar su no agresividad. Si se aplicaran productos de pH 7 a nuestra piel se producira una variacin del pH cutneo con posibles consecuencias negativas. El valor del pH se puede medir de forma precisa mediante un potencimetro, tambin conocido como pH-metro (/pe achmetro/ o /pe ache metro/), un instrumento que mide la diferencia de potencial entre dos electrodos: un electrodo de referencia (generalmente de plata/cloruro de plata) y un electrodo de vidrio que es sensible al ion de hidrgeno. Tambin se puede medir de forma aproximada el pH de una disolucin empleando indicadores, cidos o bases dbiles que presentan diferente color segn el pH. Generalmente se emplea papel indicador, que se trata de papel impregnado de una mezcla de indicadores cualitativos para la determinacin del pH. El papel de litmus o papel tornasol es el indicador mejor conocido. Otros indicadores usuales son la fenolftalena y el naranja de metilo. A pesar de que muchos potencimetros tienen escalas con valores que van desde 1 hasta 14, los valores de pH tambin pueden ser an menores que 1 o an mayores que 14. Por ejemplo el cido de batera de automviles tiene valores cercanos de pH menores que uno, mientras que el hidrxido de sodio 1 M vara de 13,5 a 14.
Un pH igual a 7 es neutro, menor que 7 es cido y mayor que 7 es bsico a 25 C. A distintas temperaturas, el valor de pH neutro puede variar debido a laconstante de equilibrio del agua (kW).
La determinacin del pH es uno de los procedimientos analticos ms importantes y ms usados en ciencias tales como qumica, bioqumica y la qumica de suelos. El pH determina muchas caractersticas notables de la estructura y actividad de las biomacromolculas y, por tanto, del comportamiento de clulas y organismos. Diversas reacciones qumicas que se producen en solucin acuosa necesitan que el pH del sistema se mantenga constante, para evitar que ocurran otras reacciones no deseadas. Las soluciones reguladoras o bfer son capaces de mantener la acidez o basicidad de un sistema dentro de un intervalo reducido de pH. Estas soluciones contienen como especies predominantes, un par cido/base conjugado en concentraciones apreciables. La reaccin de neutralizacin: Es una reaccin entre un cido y una base, generalmente en las reacciones acuosas cido-base se forma agua y una sal. El organismo posee tres mecanismos para mantener el pH en valores compatibles con la vida: 1. Los amortiguadores. 2. La regulacin pulmonar de la CO2. 3. La reabsorcin y excresin renal de bicarbonato y la excrecin de cidos. El efecto del ion comn se basa en el producto de solubilidad (Kps) segn el cual, para disminuir la solubilidad de una sal se agrega uno de los iones. Al aumentar la concentracin de uno de los iones que forman el precipitado, la concentracin del otro debe disminuir para que el Kps permanezca constante, a una temperatura determinada. Este efecto es el que permite reducir la solubilidad de muchos precipitados, o para precipitar cuantitativamente un ion, usando exceso de agente precipitante. 1. El pH de una solucin se ve afectada por la concentracin molar. Una solucin muy concentrada no permite la libre movilidad de iones y por ello altera los valores. Hay que recordar que el mejor pH se mide en soluciones diludas. 2. La temperatura. Los valores de referencia de la ionizacin del agua se da a 25 Celsius, y el agua es el disolvente ms utilizado en las soluciones. Por ello al variar la temperatura, vara el equilibrio de la disolucin y ocurre un cambio (muy pequeo) de pH. 3. La estructura molecular de las sustancias. Si es un cido o base fuerte o dbil. O sea cunto se ioniza. PARTE EXPERIMENTAL material vaso precipitado piceta reactivo solucin buffer agua de ingenio equipo peachimetro
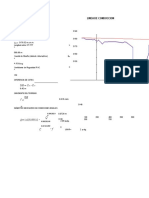
PROCEDIMIENTO Antes de usarse el peachimetro se lo limpia con agua destilada y se lo seca con un clnex pero no se le debe frotar. Luego debemos calibrarlo con substancias buffer.
Una de las substancias se lo coloca en un pequeo vaso precipitado su ph es de 4 y es de color rosado no debemos tocar las paredes del vaso con el peachimetro, se calibra el peachimetro y se empieza a medir ph. substancia agua de ingenio ph 10.73 temperatura 16.5C
OBSERVACIONES El peachimetro estaba descalibrado. Una de las substancias buffer el que usamos era de ph=4 de color rosado y era liquido se uso para calibrar el peachimetro. La temperatura era de 16.5C cuando tomamos el ph del agua de ingenio. CONCLUSIONES Podemos decir que el agua de ingenio esta en tratamiento ya q su ph es de 10.73 es alcalina puede llegar a disolver la piel pero no estn peligrosa, se concluyo la practica sin problemas ni complicaciones. Se puede decir se cumpli el objetivo de la practica que era obtener el ph de cierta agua. CUESTIONARIO
BIBLIOGRAFIA http://es.wikipedia.org/wiki/PH http://espanol.answers.yahoo.com/question/index?qid=20070730135500AA3UPS2
DETERMINACION DE LA CONDUCTIVIDAD OBJETIVO Determinar la conductividad elctrica, de una muestra de agua de ingenio. FUNDAMENTO TEORICO La conductividad elctrica es la medida de la capacidad de un material que deja pasar la corriente elctrica, su aptitud para dejar circular libremente las cargas elctricas. La conductividad depende de la estructura atmica y molecular del material, los metales son buenos conductores porque tienen una estructura con muchos electrones con vnculos dbiles y esto permite su movimiento. La conductividad tambin depende de otros factores fsicos del propio material y de la temperatura. La conductividad es la inversa de la resistividad, por tanto , y su unidad es -1 -1 el S/m (siemens por metro) o m . Usualmente la magnitud de la conductividad () es la proporcionalidad entre elcampo elctrico y la densidad de corriente de conduccin :
La conductividad electroltica en medios lquidos (Disolucin) est relacionada con la presencia de sales en solucin, cuya disociacin genera iones positivos y negativos capaces de transportar la energa elctrica si se somete el lquido a un campo elctrico. Estos conductores inicos se denominan electrolitos o conductores electrolticos. Las determinaciones de la conductividad reciben el nombre de determinaciones conductomtricas y tienen muchas aplicaciones como, por ejemplo: En la electrlisis, ya que el consumo de energa elctrica en este proceso depende en gran medida de ella. En los estudios de laboratorio para determinar el contenido de sales de varias soluciones durante la evaporacin del agua (por ejemplo en el agua de calderas o en la produccin de leche condensada). En el estudio de las basicidades de los cidos, puesto que pueden ser determinadas por mediciones de la conductividad. Para determinar las solubilidades de electrlitos escasamente solubles y para hallar concentraciones de electrlitos en soluciones por titulacin.
La base de las determinaciones de la solubilidad es que las soluciones saturadas de electrlitos escasamente solubles pueden ser consideradas como infinitamente diluidas. Midiendo la conductividad especfica de semejante solucin y calculando la conductividad equivalente segn ella, se halla la concentracin del electrlito, es decir, su solubilidad. Un mtodo prctico sumamente importante es el de la titulacin conductomtrica, o sea la determinacin de la concentracin de un electrlito en solucin por la medicin de su conductividad durante la titulacin. Este mtodo resulta especialmente valioso para las soluciones turbias o fuertemente coloreadas que con frecuencia no pueden ser tituladas con el empleo de indicadores. La conductividad elctrica se utiliza para determinar la salinidad (contenido de sales) de suelos y substratos de cultivo, ya que se disuelven stos en agua y se mide la conductividad del medio lquido resultante. Suele estar referenciada a 25 C y el valor obtenido debe corregirse en funcin de la temperatura. Coexisten muchas unidades de expresin de la conductividad para este fin, aunque las ms utilizadas son dS/m (deciSiemens por metro), mmhos/cm (milimhos por
centmetro) y segn los organismos de normalizacin europeos mS/m (miliSiemens por metro). El contenido de sales de un suelo o substrato tambin se puede expresar por la resistividad (se sola expresar as en Francia antes de la aplicacin de las normas INEN). El conductmetro es un dispositivo diseado para medir una caracterstica de todos los materiales que es la CONDUCTIVIDAD. La conductividad se mide en Siemens*m2/m, o lo que es lo mismo Sm*m. Siemens es una unidad, por el rea transversal del conductor, sobre la longitud del conductor (Un conductor mas "grueso" conduce mas y uno mas largo menos). En pocas palabras la conductividad dice que tan facil atraviesa la electricidad a ese material. La conductividad se puede medir de manera directa o inversa. De manera directa, se observa cuanta corriente pasa para determinada diferencia de voltaje entre los extremos de la muestra. Es bien conocido que la conductividad elctrica es la capacidad de un cuerpo para permitir el paso de los electrones, los mismos que forman a su paso una corriente elctrica. Los aspectos que vienen afectando a la conductividad es la resistencia o resistividad, esto en qumica depender del elemento que se este usando para la corriente electrica y de su ltima capa de electrones. Todas las sustancias se oponen en mayor o menor grado al paso de la corriente elctrica, esta oposicin es a la que llamamos resistencia elctrica. Los materiales buenos conductores de la electricidad tienen una resistencia elctrica muy baja, los aislantes tienen una resistencia muy alta. PARTE EXPERIMENTAL materiales vaso precipitado piceta equipos conductivimetro reactivos agua de ingenio
PROCEDIMIENTO Se coloca 100ml de agua de ingenio en el vaso precipitado y lo llevamos a medir su conductividad elctrica con el conductivimetro. conductividad elctrica 1.51*10s/m
substancia agua de ingenio
OBSERVACIONES El agua de ingenio era de color plomo cristalino. El conductivimetro era elctrico. CONCLUSIONES Podemos decir que el agua no es potable est muy alejado de serlo concluimos diciendo q se cumpli con el objetivo que era medir la conductividad elctrica del agua de ingenio.
BIBLIOGRAFIA http://es.wikipedia.org/wiki/Conductividad_el%C3%A9ctrica http://espanol.answers.yahoo.com/question/index?qid=20110206081519AAWg03M
Você também pode gostar
- 4500-Cl-B. Método ArgentométricoDocumento3 páginas4500-Cl-B. Método ArgentométricoJesús Munayco FloresAinda não há avaliações
- Determinación de Cloruros en El Agua InformeDocumento3 páginasDeterminación de Cloruros en El Agua InformeSelena Jimenez RamirezAinda não há avaliações
- Titulación de HCL y NaOhDocumento7 páginasTitulación de HCL y NaOhCiinThiia Lopez33% (3)
- Obtención de Indicadores Naturales de PHDocumento10 páginasObtención de Indicadores Naturales de PHCésar LópezAinda não há avaliações
- Practica de Laboratorio Alcalinidad y AcidezDocumento7 páginasPractica de Laboratorio Alcalinidad y Acidezuberkmilo6878Ainda não há avaliações
- 6 Determinación de SILICEDocumento12 páginas6 Determinación de SILICEMaria MilagrosAinda não há avaliações
- Determinación de PH Por El Método de ElectrométricoDocumento8 páginasDeterminación de PH Por El Método de Electrométrico74213801Ainda não há avaliações
- ME-FQ-002 Determinación de DBODocumento8 páginasME-FQ-002 Determinación de DBOAnonymous YwFJrk0yC100% (2)
- Métodos Estándar para El Examen de Aguas y Aguas ResidualesDocumento15 páginasMétodos Estándar para El Examen de Aguas y Aguas ResidualesGiovanna100% (1)
- Ejercicios Resueltos Espectrofotometría 2017Documento5 páginasEjercicios Resueltos Espectrofotometría 2017Diana Dominguez AquinoAinda não há avaliações
- Volumetria Por Precipitacion - PracticaDocumento5 páginasVolumetria Por Precipitacion - Practicafernanda_puga_6Ainda não há avaliações
- Determinacin de La Dureza Del AguaDocumento7 páginasDeterminacin de La Dureza Del AguaAgustina Zeri100% (3)
- Determinacion Materia OrganicaDocumento8 páginasDeterminacion Materia OrganicaEdwin DuqueAinda não há avaliações
- Laboratorio Qaii Práctica6Documento8 páginasLaboratorio Qaii Práctica6Rushwalker :3Ainda não há avaliações
- Determinación de Carbonato y Bicarbonato en Una MuestraDocumento2 páginasDeterminación de Carbonato y Bicarbonato en Una MuestraSantiago MoralesAinda não há avaliações
- Practica #2 Curva de ValoracionDocumento20 páginasPractica #2 Curva de ValoracionNnaLupizAinda não há avaliações
- AlcalinidadDocumento10 páginasAlcalinidadTanyz OyuelitosAinda não há avaliações
- Lab. 6 Determinacion de ClorurosDocumento34 páginasLab. 6 Determinacion de ClorurosElsa Daniela Escobar Perez ESTUDIANTE ACTIVOAinda não há avaliações
- Practica 15 Determinacion de La Acidez Del Vinagre Mediante Valoracion Con Un Indicador y Por PotenciometriaDocumento10 páginasPractica 15 Determinacion de La Acidez Del Vinagre Mediante Valoracion Con Un Indicador y Por PotenciometriaJosh Emg0% (1)
- Determinacion de Cromo TotalDocumento5 páginasDeterminacion de Cromo Totaljomi100% (1)
- Fru GoosDocumento7 páginasFru GoosSandra HgAinda não há avaliações
- CUESTIONARIODocumento3 páginasCUESTIONARIOIsaac VeraAinda não há avaliações
- Ley de StokesDocumento7 páginasLey de StokesmariedukAinda não há avaliações
- Mezclas AlcalinasDocumento9 páginasMezclas AlcalinasDehison Guerrero PurisAinda não há avaliações
- Preguntas de HCL y NaOHDocumento9 páginasPreguntas de HCL y NaOHSantiago NuñezAinda não há avaliações
- Métodos para La Determinación de Dióxido de Carbono en AguaDocumento2 páginasMétodos para La Determinación de Dióxido de Carbono en AguaLuis Vélez67% (3)
- Aplicación Industrial de La Yodometria 2Documento2 páginasAplicación Industrial de La Yodometria 2Jair Ayesta100% (1)
- Solucionario de Quimica Analitica Cuantitativa LaboratorioDocumento23 páginasSolucionario de Quimica Analitica Cuantitativa LaboratorioEva Raquel NinaAinda não há avaliações
- Informe Analítica - Permanganometría - M.AlfaroDocumento14 páginasInforme Analítica - Permanganometría - M.AlfaroJaviera Alfaro VicencioAinda não há avaliações
- 009-011 Calibrado y Empleo de Material VolumetricoDocumento5 páginas009-011 Calibrado y Empleo de Material VolumetricoAnita BGAinda não há avaliações
- Seminario 4 QGDocumento2 páginasSeminario 4 QGSergio Solano TacucheAinda não há avaliações
- Laboratorio N°2. MEZCLAS ALCALINAS.Documento13 páginasLaboratorio N°2. MEZCLAS ALCALINAS.Romina SantanderAinda não há avaliações
- Titulaciones ConductimétricasDocumento4 páginasTitulaciones ConductimétricasCarmeny NavaAinda não há avaliações
- Estandarización de NaOHDocumento19 páginasEstandarización de NaOHHarold Betancourt Perez100% (1)
- Laboratorio 7 Carbonatos y Bicarbonatos en SuelosDocumento22 páginasLaboratorio 7 Carbonatos y Bicarbonatos en SuelosJosmari Medrano80% (10)
- Valoracion ChemlabDocumento7 páginasValoracion ChemlababiAinda não há avaliações
- Fenoles Por ColorimetriaDocumento6 páginasFenoles Por ColorimetriaMasahiLeivaRiasAinda não há avaliações
- Titulación Ácido BaseDocumento9 páginasTitulación Ácido BaseAliceAinda não há avaliações
- Valoración Ácido-BaseDocumento5 páginasValoración Ácido-BasePriscillaLGAinda não há avaliações
- Lab. Analítica (Práctica 3)Documento3 páginasLab. Analítica (Práctica 3)Santiago Vallejo100% (1)
- Informe de PHDocumento10 páginasInforme de PHJosselyne LimoAinda não há avaliações
- Parámetros - Fisico-Quimicos. Equipo 1 ApaDocumento24 páginasParámetros - Fisico-Quimicos. Equipo 1 ApaEsmeralda ZuñigaAinda não há avaliações
- Lab. #2 - Determinación de Manganeso en AceroDocumento23 páginasLab. #2 - Determinación de Manganeso en AceroGean HalanoccaAinda não há avaliações
- Práctica 3 - ConductimetríaDocumento3 páginasPráctica 3 - ConductimetríaEsteban CortesAinda não há avaliações
- Preguntas de AdsorcionDocumento3 páginasPreguntas de AdsorcionMauro A. Parra100% (1)
- Aplicaciones Clasicas de Valoraciones de NeutralizaciónDocumento10 páginasAplicaciones Clasicas de Valoraciones de NeutralizaciónPabloSanchezAinda não há avaliações
- Ley de RoultDocumento20 páginasLey de RoultAlexis HuancaAinda não há avaliações
- Lab. Propiedades ColigativasDocumento2 páginasLab. Propiedades ColigativasMarithza Yadira Galindo LozanoAinda não há avaliações
- Analisis Por Via SecaDocumento10 páginasAnalisis Por Via SecaCcq QF Cesar100% (2)
- Guía de Ejercicios Precipitación y RedoxDocumento2 páginasGuía de Ejercicios Precipitación y Redoxfernanda100% (1)
- PolarimetriaDocumento13 páginasPolarimetriaMario RangelAinda não há avaliações
- Informe de AlquenosDocumento5 páginasInforme de AlquenosJhonier Jesús Ruiz PèrezAinda não há avaliações
- P Monsanto 2Documento4 páginasP Monsanto 2Brian Jeef Blancas SotoAinda não há avaliações
- Tiosulfato de SodioDocumento13 páginasTiosulfato de SodioJorge De Jesús Domínguez CatalánAinda não há avaliações
- Determinacion Del PH Por El Metodo ElectrometricoDocumento6 páginasDeterminacion Del PH Por El Metodo ElectrometricoOtidnanref EkilAinda não há avaliações
- Practica 6-Medición de Nivel de PHDocumento7 páginasPractica 6-Medición de Nivel de PHJonathan FloresAinda não há avaliações
- Laboratorio 4Documento8 páginasLaboratorio 4Torrejon Núñez del Prado Valeria BelénAinda não há avaliações
- Practica 1Documento7 páginasPractica 1Lyly Llanes CarreónAinda não há avaliações
- PH y AguaDocumento4 páginasPH y Aguaximena villegasAinda não há avaliações
- Indicadores de PH y Curvas de NeutralizacionDocumento22 páginasIndicadores de PH y Curvas de NeutralizacionAna Nayde ChristopherAinda não há avaliações
- Epanet y Cooperación (Introducción Al Cálculo Por Ordenador)Documento103 páginasEpanet y Cooperación (Introducción Al Cálculo Por Ordenador)Ariel Nina ChoqueAinda não há avaliações
- Paso Aereo para Tuberias de Sistea de Abastecimiento de Agua PotableDocumento10 páginasPaso Aereo para Tuberias de Sistea de Abastecimiento de Agua PotableAriel Nina ChoqueAinda não há avaliações
- Calculo Paso Quebrada 20.0 MetrosDocumento6 páginasCalculo Paso Quebrada 20.0 MetrosAriel Nina Choque100% (1)
- Calculo de Linea de Conduccion de Agua PotableDocumento5 páginasCalculo de Linea de Conduccion de Agua PotableAriel Nina ChoqueAinda não há avaliações
- ANÁLISIS Y DISEÑO MÉTODO LRFD Estructura Metálica Coliseo Tipo DomoDocumento27 páginasANÁLISIS Y DISEÑO MÉTODO LRFD Estructura Metálica Coliseo Tipo DomoAriel Nina ChoqueAinda não há avaliações
- Hidraulica I - 2Documento3 páginasHidraulica I - 2Ariel Nina Choque71% (7)
- .Calculadora CientificaDocumento49 páginas.Calculadora CientificaAriel Nina ChoqueAinda não há avaliações
- Trucha MenierDocumento3 páginasTrucha MenierPaola MoraAinda não há avaliações
- Endeudamiento y SolvenciaDocumento16 páginasEndeudamiento y SolvenciaYUDI ALEJANDRA RAMIREZ AYAAinda não há avaliações
- Sintesis de BenzoinaDocumento4 páginasSintesis de BenzoinaAnthonio MothaAinda não há avaliações
- PHM-018 Procedimiento de Limpieza Post Mantenimiento y Conciliación de PartesDocumento5 páginasPHM-018 Procedimiento de Limpieza Post Mantenimiento y Conciliación de PartesNathalieAinda não há avaliações
- Práctica 5. Estudio de Las Propiedades de Los Aldehídos y CetonasDocumento8 páginasPráctica 5. Estudio de Las Propiedades de Los Aldehídos y CetonasKAREN ZARATE TORIBIOAinda não há avaliações
- Producción y Comercialización de Aceite de Aguacate para Uso Cosmético en La Ciudad de Bogotá D.CDocumento54 páginasProducción y Comercialización de Aceite de Aguacate para Uso Cosmético en La Ciudad de Bogotá D.Cfervel01Ainda não há avaliações
- Brief Creativo ChocapicDocumento9 páginasBrief Creativo ChocapicJefferson LinoAinda não há avaliações
- Matriz AuditoriaDocumento2 páginasMatriz Auditoriacartera lacteosAinda não há avaliações
- Perfil de Gerente Administrativo - Funciones - Perfiles Profesionales PDFDocumento7 páginasPerfil de Gerente Administrativo - Funciones - Perfiles Profesionales PDFsandra fernandezAinda não há avaliações
- Catálogo Mor24 - Hello KittyDocumento42 páginasCatálogo Mor24 - Hello KittyJkbg13Ainda não há avaliações
- Estadistica TareaSemana6Documento6 páginasEstadistica TareaSemana6Ale Que AdasmeAinda não há avaliações
- Contrato Primer PisoDocumento2 páginasContrato Primer PisoKaren Torres IguiaAinda não há avaliações
- Anexo 2Documento3 páginasAnexo 2anon_31042099267% (3)
- Cat Roca CeroDocumento12 páginasCat Roca CeroarqaarondAinda não há avaliações
- Presentacion de Marketing - Coca ColaDocumento26 páginasPresentacion de Marketing - Coca ColaAdriana Ruiz Nicastro100% (1)
- Principios de Reactividad Quimica y Mecanisos de ReaccionDocumento82 páginasPrincipios de Reactividad Quimica y Mecanisos de ReaccionRichard Santos CastilloAinda não há avaliações
- B) Oportunidades en El Segmento de Mercado de Los Pequeños AerogeneradoresDocumento4 páginasB) Oportunidades en El Segmento de Mercado de Los Pequeños AerogeneradoresDaniel SacorAinda não há avaliações
- Máquina de Overlock G N 1 - Traducción Al Español PDFDocumento15 páginasMáquina de Overlock G N 1 - Traducción Al Español PDFfmaria6484% (74)
- Rectificadores TotalDocumento16 páginasRectificadores TotalJorge Ponce De Leon SolisAinda não há avaliações
- Caso Blaine TraducidoDocumento8 páginasCaso Blaine Traducidopatriciolivares3009Ainda não há avaliações
- Lazo TallerDocumento9 páginasLazo TallerMilade CantilloAinda não há avaliações
- Platillos Típicos de Las Grandes MontañasDocumento3 páginasPlatillos Típicos de Las Grandes MontañasEdd M. Prieto100% (2)
- Contenido Del Estudio de FactibilidadDocumento3 páginasContenido Del Estudio de FactibilidadAndres CamposAinda não há avaliações
- Captura de Pantalla 2022-12-06 A La(s) 08.41.02Documento1 páginaCaptura de Pantalla 2022-12-06 A La(s) 08.41.02Yessica Ramirez San MartínAinda não há avaliações
- Bolivia Pollos TesisDocumento50 páginasBolivia Pollos TesisAndreyGonzalezAinda não há avaliações
- Guion - Validacion y Pruebas Del ServicioDocumento4 páginasGuion - Validacion y Pruebas Del ServicioJose Carlos AquinoAinda não há avaliações
- ToyotaDocumento13 páginasToyotaoscar cauichAinda não há avaliações
- La Educación y El Modo de Producción FeudalDocumento2 páginasLa Educación y El Modo de Producción FeudalEsther MercedesAinda não há avaliações
- Actividad V RmifDocumento20 páginasActividad V RmifLisett AlvarezAinda não há avaliações
- UT2 S5 Ejercicio 5-DesbloqueadoDocumento2 páginasUT2 S5 Ejercicio 5-DesbloqueadoJuan Ramírez HernándezAinda não há avaliações