Escolar Documentos
Profissional Documentos
Cultura Documentos
Apa Sih Buffer Dan Manfaatnya
Enviado por
Elinira SubandiDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Apa Sih Buffer Dan Manfaatnya
Enviado por
Elinira SubandiDireitos autorais:
Formatos disponíveis
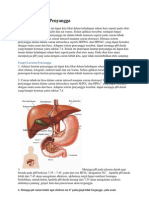
APA SIH BUFFER DAN MANFAATNYA? Setiap hari kalian makan.
Makanan yang masuk ke tubuh kalian tak hanya akan berhubungan dengan organ mulut, kerongkongan, lambung, dan usus saja. Pada pelajaran biologi kalian telah mempelajari proses transportasi makanan dalam tubuh, bukan? Makanan akan mengalami serangkaian proses metabolisme di dalam tubuh dan hasilnya akan diedarkan ke seluruh tubuh melalui darah. Tahukah kalian bahwa hasil metabolisme dapat bersifat asam ataupun basa, tergantung dari sifat makanan yang kita konsumsi? Nah, tentu saja hal ini akan berpengaruh terhadap pH darah. Padahal, agar dapat bekerja dengan baik, pH darah harus tetap stabil. Oleh karena itulah darah memiliki sistem buffer untuk dapat mempertahankan pH-nya. Lalu apakah buffer itu? Bagaimana sifatnya? Bagaimana peranannya dalam tubuh? Sistem larutan buffer sangat berperan dalam tubuh makhluk hidup. Oleh karena itu, darah yang berperan penting dalam metabolisme harus merupakan suatu larutan buffer yang dapat mempertahankan pH-nya, sehingga pH darah tetap stabil dengan adanya zat asam atau basa yang terlibat dalam metabolisme. Lain halnya dengan larutan bukan buffer yang tidak dapat mempertahankan pH-nya. Kerusakan organ tubuh atau bahkan kematian dapat terjadi jika darah bukan merupakan suatu larutan buffer. Dalam tubuh kita, pH darah berkisar 7,35 - 7,45. Agar pH darah tidak banyak berubah, maka di dalatnnya terdapat sistem buffer. Begitu juga enzim pemecah protein, yang hanya dapat bekerja dengan baik pada pH = 3. Agar pH cairan dalam lambung selalu berada dalam kisaran 3, maka dalarn lambung terdapat larutan buffer. Makanan yang kita konsumsi akan disalurkan ke seluruh tubuh, salah satunya melalui darah. pH darah relatif stabil dan tetap karena kandungan larutan buffer karbonat dalam darah mempunyai komposisi yang selalu tetap. Lantas bagaimana cara larutan buffer karbonat mempertahankan pH darah? Berikut gambaran mengenai proses tersebut. Jika yang dihasilkan oleh metabolisme adalah suatu basa, maka ion OH akan bereaksi dengan asam bikarbonat (H2CO3) menurut reaksi: H2CO3 + OH HCO3 + H2O
Sebaliknya, jika hasil metabolisme adalah suatu asam, maka ion H+ dari asam tersebut akan diikat oleh ion HCO3 menurut reaksi : H+ + HCO3 H2CO3 Dengan adanya kedua reaksi di atas, maka perbandingan konsentrasi karbonat dan bikarbonat selalu tetap, sehingga pH darah relatif tetap. Konsentrasi H2CO3 berasal dari gas CO2 terlarut dan konsentrasi HCO3berasal dari garam yang terkandung dalam air laut. Jika air hujan yang umumnya besifat asam tercurah ke laut atau air dari sungai-sungai mengalir ke laut dengan berbagai sifat asam dan basa maka sifat asam dan basa itu tidak akan mengubah pH air laut. Dengan kata lain, pH air laut relatif tetap. Jika Anda ingin memiliki larutan yang mempunyai nilai pH mulai dari 1 sampai 14 dan tahan lama di laboratorium, Anda dapat membuat larutan-larutan tersebut dari larutan penyangga. Nilai pH larutan penyangga tidak berubah walaupun disimpan dalam kurun waktu yang lama. Apabila mekanisme pengaturan pH dalam tubuh gagal, seperti dapat terjadi selama sakit, sehingga pH darah turun di bawah 7,0 atau naik ke atas 7,8, dapat menyebabkan kerusakan permanen pada organ tubuh atau bahkan kematian. Faktor-faktor yang dapat menyebabkan keadaan asidosis (penurunan pH) adalah penyakit jantung, penyakit ginjal, diabetes mellitus (penyakit gula), diare yang terus menerus, atau makanan berkadar protein tinggi dalam jangka waktu lama. Keadaan asidosis sementara dapat terjadi karena olahraga intensif yang dilakukan terlalu lama. Alkalosis (peningkatan pH darah) dapat terjadi sebagai akibat muntah yang hebat, hiperventilasi (bernapas terlalu berlebihan, kadang-kadang karena cemas atau histeris atau berada di ketinggian). Suatu penelitian yang dilakukan terhadap para pendaki gunung yang mencapai puncak Everest (8.848 m) tanpa oksigen tambahan menunjukkan pH darah mereka berada di antara 7,77,8. Hiperventilasi diperlukan untuk mengatasi tekanan oksigen yang amat rendah (kira-kira 43 mmHg) di tempat setinggi itu.
Você também pode gostar
- Jus Buah Sayuran Herbal Alami Untuk Menghilangkan Penyakit Asam Lambung Kelas Berat (GERD) Versi BilingualNo EverandJus Buah Sayuran Herbal Alami Untuk Menghilangkan Penyakit Asam Lambung Kelas Berat (GERD) Versi BilingualAinda não há avaliações
- Buku Masakan untuk Penyembuhan Skoliosis Anda: Jadikan tulang belakang lebih sehat dengan mengatur apa yang anda makan!No EverandBuku Masakan untuk Penyembuhan Skoliosis Anda: Jadikan tulang belakang lebih sehat dengan mengatur apa yang anda makan!Nota: 3.5 de 5 estrelas3.5/5 (4)
- Wrap Up ''Diare'' Cairan Skenario 3Documento15 páginasWrap Up ''Diare'' Cairan Skenario 3Rahman Madridista-Manchunian100% (1)
- Peraturan Lomba Bola VoliDocumento1 páginaPeraturan Lomba Bola VoliElinira Subandi80% (5)
- Larutan BufferDocumento14 páginasLarutan BufferRizki AdistaAinda não há avaliações
- Makalah Keseimbangan Asam BasaDocumento45 páginasMakalah Keseimbangan Asam BasaNhoPhie Destian Viana100% (2)
- Skenario 3 Blok CairanDocumento51 páginasSkenario 3 Blok CairanRencanyAinda não há avaliações
- Sistem Buffer TubuhDocumento14 páginasSistem Buffer TubuhMuhammad WahyuAinda não há avaliações
- Makalah Gangguan Keseimbangan Asam BasaDocumento22 páginasMakalah Gangguan Keseimbangan Asam BasaNabila Ulfany Ulfa75% (4)
- Review Jurnal Operational ResearchDocumento4 páginasReview Jurnal Operational ResearchElinira Subandi100% (1)
- Makalah Sistem Buffer TubuhDocumento9 páginasMakalah Sistem Buffer TubuhMaulyda Nurul FaizahAinda não há avaliações
- Peranan Larutan Penyangga Dalam KehidupanDocumento3 páginasPeranan Larutan Penyangga Dalam Kehidupandesisetianingsih757Ainda não há avaliações
- Larutan Penyangga Dalam Tubuh ManusiaDocumento4 páginasLarutan Penyangga Dalam Tubuh ManusiaMirna HariatiAinda não há avaliações
- Keseimbangan Asam Basa Dalam Tubuh Dan BiolistrikDocumento32 páginasKeseimbangan Asam Basa Dalam Tubuh Dan Biolistrikputrianisepti154Ainda não há avaliações
- Artikel Kimia Tentang Peranan Larutan PenyanggaDocumento5 páginasArtikel Kimia Tentang Peranan Larutan PenyanggaAndinifth100% (2)
- Sistem Buffer Pada Tubuh ManusiaDocumento3 páginasSistem Buffer Pada Tubuh ManusiaAgil CrAinda não há avaliações
- Keseimbangan Asam Basa Dalam TubuhDocumento9 páginasKeseimbangan Asam Basa Dalam TubuhDian PalinAinda não há avaliações
- Larutan PenyanggaDocumento5 páginasLarutan PenyanggaDani IbrahimAinda não há avaliações
- Fungsi Larutan Penyangga Dalam Tubuh Makhluk HidupDocumento4 páginasFungsi Larutan Penyangga Dalam Tubuh Makhluk HidupAlvinFloppeeAinda não há avaliações
- UntitledDocumento2 páginasUntitledUmamAinda não há avaliações
- Makalah Sistem Buffer Dan Cairan Tubuh ManusiaDocumento6 páginasMakalah Sistem Buffer Dan Cairan Tubuh Manusiaismul amriAinda não há avaliações
- Biokimia ASAM DAN BASA TUBUH Power Point 2Documento10 páginasBiokimia ASAM DAN BASA TUBUH Power Point 2Cici Kurnia PutriAinda não há avaliações
- Makalah Asam BasaDocumento27 páginasMakalah Asam Basanzi_eX6943100% (2)
- Makalah Asuhan Keperawatan Pada Pasien Dengan Gangguan Keseimbangan Asam BasaDocumento14 páginasMakalah Asuhan Keperawatan Pada Pasien Dengan Gangguan Keseimbangan Asam BasaNoka MamolaAinda não há avaliações
- Fungsi Larutan Penyangga Dalam Kehidupan SehariDocumento8 páginasFungsi Larutan Penyangga Dalam Kehidupan SehariDusfirah MajidAinda não há avaliações
- KimiaDocumento2 páginasKimiaPaskal StevanezAinda não há avaliações
- Laporan Pendahuluan Ketidak Seimbangan Asam BasaDocumento24 páginasLaporan Pendahuluan Ketidak Seimbangan Asam BasaAbdul LatiifAinda não há avaliações
- Buffer TambahanDocumento7 páginasBuffer TambahanVic TantriAinda não há avaliações
- Hand OutDocumento11 páginasHand OutWidia PangestikaAinda não há avaliações
- Sistem Buffer Tubuh ManusiaDocumento6 páginasSistem Buffer Tubuh ManusiaUpEngAinda não há avaliações
- Fungsi Larutan PenyanggaDocumento4 páginasFungsi Larutan Penyanggarafi_17Ainda não há avaliações
- Larutan PenyanggaDocumento3 páginasLarutan Penyanggadevilbath15Ainda não há avaliações
- Haidar Makalah Larutan PenyanggaDocumento8 páginasHaidar Makalah Larutan Penyanggadewi netAinda não há avaliações
- Larutan PenyanggaDocumento6 páginasLarutan PenyanggaSevriadyAinda não há avaliações
- Tugas Perbaikan PKMBDocumento23 páginasTugas Perbaikan PKMBgusti ayuAinda não há avaliações
- PermasalahanDocumento1 páginaPermasalahanAnggi SeptianiAinda não há avaliações
- PeranDocumento4 páginasPeranabdurahman farisyAinda não há avaliações
- RPP Larutan PenyanggaDocumento9 páginasRPP Larutan PenyanggaBurhan CfAinda não há avaliações
- Paper Metabolik AlkalosisDocumento11 páginasPaper Metabolik AlkalosisAnonymous YwnFebtAinda não há avaliações
- Sistem BufferDocumento20 páginasSistem BufferMust AgenkAinda não há avaliações
- PBL 7Documento24 páginasPBL 7RereAinda não há avaliações
- Fungsi Larutan PenyanggaDocumento4 páginasFungsi Larutan PenyanggaNur Desi YaniAinda não há avaliações
- Larutan PenyanggaDocumento2 páginasLarutan PenyanggaYunizar Farla PermataAinda não há avaliações
- HiperkalemiaDocumento74 páginasHiperkalemiaYudiatmaAinda não há avaliações
- Makalah Patologi KlinikDocumento20 páginasMakalah Patologi Klinikputra ersaAinda não há avaliações
- Fungsi Larutan PenyanggaDocumento3 páginasFungsi Larutan PenyanggaleajulianaAinda não há avaliações
- Pengertian Larutan PenyanggaDocumento12 páginasPengertian Larutan PenyanggaTiara MahardikaAinda não há avaliações
- Sistem Buffer Tubuh ManusiaDocumento4 páginasSistem Buffer Tubuh ManusiabarbarAinda não há avaliações
- PHDocumento9 páginasPHRozalianaAinda não há avaliações
- Manfaat Larutan BufferDocumento6 páginasManfaat Larutan BufferRyzal AzizAinda não há avaliações
- Aplikasi Larutan PenyanggaDocumento6 páginasAplikasi Larutan PenyanggaMariati AbdullahAinda não há avaliações
- Tugas Kelompok Dasar2 KMBDocumento10 páginasTugas Kelompok Dasar2 KMBMaulida nurlizaAinda não há avaliações
- Fungsi Larutan PenyanggaDocumento2 páginasFungsi Larutan PenyanggacindyokhotanAinda não há avaliações
- Lap 3aDocumento22 páginasLap 3aPelajaran ParsaAinda não há avaliações
- P HDocumento10 páginasP HRizky Fachrian RidloAinda não há avaliações
- Makalah Gangguan Keseimbangan Asam BasaDocumento28 páginasMakalah Gangguan Keseimbangan Asam BasaAuRora D' ORaAinda não há avaliações
- Keseimbangan KimiaDocumento13 páginasKeseimbangan KimiaWhieRa IcecreamAinda não há avaliações
- Aplikasi Larutan Buffer Dalam Kehidupan SehariDocumento5 páginasAplikasi Larutan Buffer Dalam Kehidupan SehariAnonymous iXl3xk0% (1)
- AGDDocumento10 páginasAGDAisyah ArrosyadaAinda não há avaliações
- Asam Basa K 1Documento15 páginasAsam Basa K 1Rizka VeliaAinda não há avaliações
- Rencana Pelaksanaan Pembelajaran Pert.2 Kelas KontrolDocumento4 páginasRencana Pelaksanaan Pembelajaran Pert.2 Kelas KontrolElinira SubandiAinda não há avaliações
- Rencana Pelaksanaan Pembelajaran Pert.3 Kelas EksperimenDocumento4 páginasRencana Pelaksanaan Pembelajaran Pert.3 Kelas EksperimenElinira SubandiAinda não há avaliações
- Rencana Pelaksanaan Pembelajaran Pert.3 Kelas EksperimenDocumento4 páginasRencana Pelaksanaan Pembelajaran Pert.3 Kelas EksperimenElinira SubandiAinda não há avaliações
- RPP KSP Green Chemistry Pert.1Documento7 páginasRPP KSP Green Chemistry Pert.1Elinira SubandiAinda não há avaliações
- RPP KSP Green Chemistry Pert.2Documento6 páginasRPP KSP Green Chemistry Pert.2Elinira SubandiAinda não há avaliações
- Handout 2Documento6 páginasHandout 2Elinira SubandiAinda não há avaliações
- Script 17 Agustus 2016Documento2 páginasScript 17 Agustus 2016Elinira SubandiAinda não há avaliações
- Undangan Rapat Koordinasi 17 AgustusDocumento1 páginaUndangan Rapat Koordinasi 17 AgustusElinira Subandi75% (4)
- Oksida Dan Hidroksida AmfoterDocumento6 páginasOksida Dan Hidroksida AmfoterElinira SubandiAinda não há avaliações
- Pencemaran Air Oleh DeterjenDocumento4 páginasPencemaran Air Oleh DeterjenElinira SubandiAinda não há avaliações