Escolar Documentos
Profissional Documentos
Cultura Documentos
Inhibicion y Sustrato
Enviado por
Yara Hernandez0 notas0% acharam este documento útil (0 voto)
2K visualizações3 páginasEste documento describe un experimento para determinar el tipo de inhibición producido por la anilina sobre la actividad de la enzima invertasa. Los resultados muestran que la anilina causa una inhibición no competitiva, disminuyendo la velocidad máxima de la reacción pero sin afectar la constante de Michaelis-Menten Km. El valor de Km calculado fue de 0.016, indicando una alta afinidad de la enzima por su sustrato.
Descrição original:
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoEste documento describe un experimento para determinar el tipo de inhibición producido por la anilina sobre la actividad de la enzima invertasa. Los resultados muestran que la anilina causa una inhibición no competitiva, disminuyendo la velocidad máxima de la reacción pero sin afectar la constante de Michaelis-Menten Km. El valor de Km calculado fue de 0.016, indicando una alta afinidad de la enzima por su sustrato.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
2K visualizações3 páginasInhibicion y Sustrato
Enviado por
Yara HernandezEste documento describe un experimento para determinar el tipo de inhibición producido por la anilina sobre la actividad de la enzima invertasa. Los resultados muestran que la anilina causa una inhibición no competitiva, disminuyendo la velocidad máxima de la reacción pero sin afectar la constante de Michaelis-Menten Km. El valor de Km calculado fue de 0.016, indicando una alta afinidad de la enzima por su sustrato.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 3
INSTITUTO POLITECNICO NACIONAL
ESCUELA NACIONAL DE CIENCIAS BIOLOGICAS
EFECTO DE LA ADICION DE INHIBIDORES SOBRE LA VELOCIDAD DE REACCION,
ELABORADO POR: ESPINOZA CASANOVA GLORIA Y HERNANDEZ OBREGON
YARA PATRICIA, LABORATORIO DE BIOQUIMICA Y BIOLOGIA MOLECULAR,
DEPARTAMENTO DE BIOQUIMICA, GRUPO: 3IV1, SECCION: V.
INTRODUCCION:
Muchas sustancias alteran la actividad de una enzima al combinarse con el mismo en una forma que afecta la
fijacin del sustrato y/o numero de recambio. Las sustancias que reducen la actividad de un enzima de esta manera
se denominan inhibidores.
Muchos inhibidores son sustancias que se parecen estructuralmente al sustrato del
enzima, pero que o bien no reaccionan o reaccionan muy lentamente con el sustrato.
Este tipo de inhibidores se utilizan usualmente para conocer la naturaleza qumica y
conformacional de un sitio de fijacin de sustrato
como parte de un esfuerzo para dilucidar el
mecanismo cataltico del enzima. Adems muchos
inhibidores enzimticos son agentes
quimioteraputicos efectivos.
Efecto de inhibidores en la actividad enzimtica
Una de las formas de regulacin de la actividad de una enzima es a travs de
molculas que disminuyen su velocidad de reaccin, llamadas inhibidores. Los
inhibidores pueden encontrarse de manera natural en las clulas para controlar la
velocidad de una reaccin metablica, o bien pueden ser compuestos sintticos que
se utilizan como herramientas experimentales para el estudio de las reacciones
enzimticas. Muchos compuestos txicos como antibiticos, pesticidas o herbicidas son inhibidores de enzimas
responsables de reacciones vitales para la clula. La interaccin de un inhibidor y una enzima vara dependiendo
de la naturaleza qumica del inhibidor y de la reaccin qumica que cataliza la enzima.
Para dilucidar el tipo de interaccin entre ambas molculas se determina el efecto del
inhibidor en las constantes cinticas de la enzima.
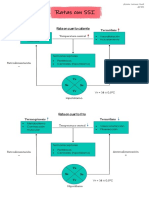
Tipos de inhibidores:
Inhibidor competitivo. Son molculas que tienen una similitud estructural y qumica
con el sustrato de la enzima, por lo que se pueden unir al sitio activo. Sin embargo,
debido a que el inhibidor no es idntico al sustrato, la enzima no es capaz de
convertirlo en producto y el inhibidor simplemente bloquea
el sitio activo, porque no es posible que tanto el inhibidor
como el sustrato se encuentren al mismo tiempo dentro de
ste. Si se adiciona ms sustrato (y el inhibidor no se une de
manera irreversible a la enzima) se reduce la inhibicin. En
un
grfico de dobles recprocos el intercepto en y es el mismo en ausencia y presencia del
inhibidor, es decir el inhibidor no afecta la Vmax de la enzima, sin embargo la pendiente
de la curva se incrementa. El incremento en la pendiente indica la fuerza de unin del
inhibidor. De tal manera que el valor de la Km de la reaccin catalizada por la enzima se
incrementa a este nuevo valor de Km se le llama Km aparente.
Inhibidor incompetitivo o acompetitivo. Es un inhibidor que no es capaz de unirse a la
enzima libre sino que slo se une al complejo enzima-sustrato. Lo anterior puede deberse a que la unin del
sustrato expone o crea sitios de acceso o unin para el inhibidor, en el sitio activo o fuera de ste. Una vez que el
inhibidor se une la enzima se previene la formacin de producto. El inhibidor incompetitivo altera tanto la Km
como la Vmax de la enzima pero no afecta la pendiente, por lo que las curvas de dobles recprocos a diferentes
concentraciones
de inhibidor son paralelas. Los valores nuevos de las constantes cinticas son Km aparente y Vmax aparente.
Inhibidor no competitivo. El inhibidor se une tanto a la enzima libre como al complejo
enzima-sustrato. Un inhibidor no competitivo puro es aquel que modifica tanto la Km de la
enzima como la pendiente de la curva de dobles recprocos, as las curvas en ausencia y
presencia del inhibidor presentan diferencias en ambos interceptos, 1/Vmax y 1/Km. La
mayor parte de los inhibidores no competitivos en realidad son inhibidores mixtos es decir
no slo se afecta la unin del sustrato sino tambin la conversin del sustrato a producto.
Debido a lo anterior, los inhibidores mixtos alteran tanto el valor de la Vmax como el de la
Km. Sin embargo, la grfica de dobles recprocos muestra que adems de que se afectan
ambos interceptos las curvas en ausencia y presencia de inhibidor se intersectan en el segundo
cuadrante.
OBJETIVO:
Se observo el efecto de la concentracin del sustrato
sobre la velocidad de la reaccin enzimtica y se
determino la constante de Michaelis-Menten por los
mtodos conocidos, asi como su aplicacin.
Se determino el tipo de inhibicin producido por una
sustancia (anilina) sobre la actividad de la invertasa.
RESULTADOS:
INHIBICIN ENZIMATICA:
Sin Inhibidos
Absorbencia 0.326 0.36
4
0.56
6
0.42
9
0.55
3
0.48
Azcar
reductor
2.95 3.25 5.25 3.93 4.86 4.2
Velocidad 0.295 0.32
5
0.52
5
0.39
3
0.48
9
0.42
Concentraci
n del
sustrato
0.022
5
0.04
5
0.06
7
0.11
2
0.18 0.22
5
Con inhibidor
Absorbencia 0.155 0.12
3
0.09
7
0.10
1
0.07
0
0.09
6
Azcar
reductor
1.05 1.35 1.36 1.40 1.43 1.46
Velocidad 0.105 0.13
5
0.13
6
0.14 0.14
3
0.14
6
Concentraci
n del
sustrato
0.022
5
0.04
5
0.06
7
0.11
2
0.18 0.22
5
La reaccin que se llevo acabo fue como sigue:
E + S ES E + P
+ I EI + I ESI
Michaelis-Menten:
0
0.1
0.2
0.3
0.4
0.5
0.6
0 0.05 0.1 0.15 0.2 0.25
sin inhibidor
con inhibidor
Lineweaver-Burk:
1/v = 0.03361/[s] + 2.0081
m= Km/V
m= Km/V
max
1/V
max
= 2
Km= mV
max
Km= 0.03361 (0.5)= 0.016
DISCUSIN:
El inhibidorse uni a la enzima en puntos distintos al
centro activo, su unin incapacita a la enzima para
desarrollar su accin cataltica, y en este caso, el
aumento en la concentracin de sustrato no revierte la
inhibicin. Su capacidad de unirse a la enzima est
sta en solitario o est unida al sustrato, da lugar a
que la V
mxima
. Se encuentre disminuida, mientras que
el Km no se modifica ya que la afinidad de la enzima
por el sustrato y su capacidad de unirse a l no se ve
disminuida.
Resultados:
Se obtuvo que la reaccin que se llevo acabo es una
inhibicin no competitiva, el valor de Km obtenido
por la ecuacin de lineweaver-Burk y michaelis-
menten es de 0.016 lo que significa que existe una
gran afinidad de la enzima por el sustrato.
BIBLIOGRAFIA:
1. NELSON DAVID L. (2009 )BIOQUMICA
LEHNINGER PRINCIPLES OF BIOCHEMISTRY
EDITORIAL: FREEMAN 5 ED
2. STRYER / BERG (2007) BIOQUMICA 6. ED.
EDITORIAL: REVERT
y = 0.0336x + 2.0081
y = 0.1167x + 6.3849
-2
0
2
4
6
8
10
12
-80 -60 -40 -20 0 20 40
Você também pode gostar
- Efecto de La Concentración de Sustrato Sobre La Velocidad de La ReacciónDocumento2 páginasEfecto de La Concentración de Sustrato Sobre La Velocidad de La ReacciónMariela Pérez RodarteAinda não há avaliações
- P5.2.Bioquímica..Efecto de La Concentracion de Enzima Sobre La Velocidad de ReaccionDocumento1 páginaP5.2.Bioquímica..Efecto de La Concentracion de Enzima Sobre La Velocidad de ReaccionGiovanni Gallo0% (2)
- Efecto de La Concentración de Sustrato e Inhibidores en La Velocidad de ReacciónDocumento3 páginasEfecto de La Concentración de Sustrato e Inhibidores en La Velocidad de ReacciónFabiruchiz OrtegaAinda não há avaliações
- Práctica No.5-1 Curva Tipo de Azucares ReductoresDocumento2 páginasPráctica No.5-1 Curva Tipo de Azucares ReductoresEvelyn Jim 329560% (5)
- Práctica 11 Química Analítica-Díaz Ruiz Luis Fernando 4FM1Documento4 páginasPráctica 11 Química Analítica-Díaz Ruiz Luis Fernando 4FM1Fernando diaz ruizAinda não há avaliações
- Bioquímica Reacciones Óxido-Reducción de La LDHDocumento1 páginaBioquímica Reacciones Óxido-Reducción de La LDHPaoli Ruiz100% (1)
- Practica 5.5 y 5.6 Sustrato e Inhibidores 1Documento4 páginasPractica 5.5 y 5.6 Sustrato e Inhibidores 1SergioEspejelAinda não há avaliações
- Bioquìmica ENCB DNA VegetalDocumento3 páginasBioquìmica ENCB DNA VegetalDioney TellezAinda não há avaliações
- Práctica No. 14 "Biodegradación de Plaguicidas Por Microorganismos Del Suelo".Documento7 páginasPráctica No. 14 "Biodegradación de Plaguicidas Por Microorganismos Del Suelo".David Ramírez100% (1)
- Aislamiento de Origen VegetalDocumento3 páginasAislamiento de Origen Vegetalfcbarcelona-08hotmail.comAinda não há avaliações
- Practica2 - Reacciones Aminoácidos ProteínasDocumento2 páginasPractica2 - Reacciones Aminoácidos ProteínasPam DianaAinda não há avaliações
- P2 Conceptos Básicos de HomeostasisDocumento11 páginasP2 Conceptos Básicos de Homeostasisangie creyesAinda não há avaliações
- Efecto de La Concentración de Enzima y PH Sobre La Velocidad de ReacciónDocumento3 páginasEfecto de La Concentración de Enzima y PH Sobre La Velocidad de ReacciónLuis AngelAinda não há avaliações
- Seminario de Actinomicetos.Documento28 páginasSeminario de Actinomicetos.Guillermo CasillasAinda não há avaliações
- Bitacora de TrabajoP11Documento3 páginasBitacora de TrabajoP11Alexis GudiñoAinda não há avaliações
- Practica 6 Energia de Las Reacciones QuimicasDocumento4 páginasPractica 6 Energia de Las Reacciones QuimicasLuis AngelAinda não há avaliações
- Reporte P.15 Reacciones Enzimáticas de Óxido-Reducción Part.2. SDH. y Citocromo OxidasaDocumento6 páginasReporte P.15 Reacciones Enzimáticas de Óxido-Reducción Part.2. SDH. y Citocromo OxidasaRubén Serrato CondeAinda não há avaliações
- Extracción de DNA de GuayabaDocumento3 páginasExtracción de DNA de GuayabaAdii González33% (3)
- Trabajo Final EcologíaDocumento76 páginasTrabajo Final EcologíaEncb Ipn100% (1)
- DNA Guayaba - Identificación Bases NitrogenadasDocumento3 páginasDNA Guayaba - Identificación Bases NitrogenadasRosalba Hernández100% (1)
- Practica 7 Reporte - Velocidad de ReaccionDocumento10 páginasPractica 7 Reporte - Velocidad de ReaccionBlackPork540% (1)
- Aislamiento de Dna PlasmídicoDocumento2 páginasAislamiento de Dna PlasmídicoGuillermo CasillasAinda não há avaliações
- Práctica 5.4 Efecto de La Temperatura Sobre La Velocidad de Reacción de La InvertasaDocumento3 páginasPráctica 5.4 Efecto de La Temperatura Sobre La Velocidad de Reacción de La InvertasaEvelyn Jim 3295Ainda não há avaliações
- PBQ13Documento2 páginasPBQ13mileny muñozAinda não há avaliações
- PDF Purificacion Parcial de Lisozima de Clara de Huevo - CompressDocumento7 páginasPDF Purificacion Parcial de Lisozima de Clara de Huevo - CompressAlejandro Rodriguez Zenteno100% (1)
- Determinaciòn Cuantitativa de Poblaciones Microbianas en El AireDocumento6 páginasDeterminaciòn Cuantitativa de Poblaciones Microbianas en El AireStarflyAinda não há avaliações
- Separacion de Fosfolipidos Por Cromatografia en Capa Fina-EDocumento2 páginasSeparacion de Fosfolipidos Por Cromatografia en Capa Fina-EAdii GonzálezAinda não há avaliações
- ADNDocumento3 páginasADNSamantha MTAinda não há avaliações
- Práctica No. 13 "Prueba de Biodegradación de Surfactantes Aniónicos de Acuerdo A La Normatividad".Documento5 páginasPráctica No. 13 "Prueba de Biodegradación de Surfactantes Aniónicos de Acuerdo A La Normatividad".David Ramírez100% (1)
- Reporte de Practica 4 Quimica Organica - ENCB-RecristalizaciónDocumento4 páginasReporte de Practica 4 Quimica Organica - ENCB-RecristalizaciónLilu Wrathe TempestAinda não há avaliações
- Bca y Bradford (20096) PDFDocumento20 páginasBca y Bradford (20096) PDFKenia VilchisAinda não há avaliações
- Carbohidratos y Acidos OrganicosDocumento5 páginasCarbohidratos y Acidos OrganicosLalo Tolentino100% (1)
- Aislamiento Del DNA de Origen Vegetal y Su Caracterización EspectrofotómetricaDocumento2 páginasAislamiento Del DNA de Origen Vegetal y Su Caracterización EspectrofotómetricaBren Gastaldi100% (1)
- Eco Práctica 6 FinalDocumento12 páginasEco Práctica 6 Finalmartha100% (1)
- Practica 2. Punto IsoelectricoDocumento2 páginasPractica 2. Punto IsoelectricoPierdant O-oAinda não há avaliações
- Practica 7. Sucesion de HongosDocumento7 páginasPractica 7. Sucesion de HongosDiego LunaAinda não há avaliações
- Reactor Quimico Practica No. 3Documento6 páginasReactor Quimico Practica No. 3Jordan Josue Torres100% (1)
- Caracterizacion Quimica Del GlucogenoDocumento2 páginasCaracterizacion Quimica Del GlucogenoFrida K. Lara100% (2)
- Hidrolisis de RNA y DNA e Identificación de Bases Púricas y Pirimídicas Por Cromatografía en Capa Fina.Documento2 páginasHidrolisis de RNA y DNA e Identificación de Bases Púricas y Pirimídicas Por Cromatografía en Capa Fina.Monse Blanquel25% (4)
- Práctica 1 - Transporte de Glucosa en Levaduras Seccion 2Documento38 páginasPráctica 1 - Transporte de Glucosa en Levaduras Seccion 2Tania Karen Rodriguez GarciaAinda não há avaliações
- Diagramas de RussekDocumento3 páginasDiagramas de RussekYoali Asiain LeconaAinda não há avaliações
- Reporte Práctica 1 - Método de SangerDocumento3 páginasReporte Práctica 1 - Método de SangerAndy AldamaAinda não há avaliações
- Reaccion de Transaminacion-EDocumento2 páginasReaccion de Transaminacion-EAdii GonzálezAinda não há avaliações
- Cromatografia Por AdsorcionDocumento3 páginasCromatografia Por AdsorcionLi ClementeAinda não há avaliações
- Medicion de PH y Capacidad ReguladoraDocumento5 páginasMedicion de PH y Capacidad ReguladoraManuel SalinasAinda não há avaliações
- P3 Balance de Masa en Un Mezclado (Fracción Masica) - Ok - OK PDFDocumento22 páginasP3 Balance de Masa en Un Mezclado (Fracción Masica) - Ok - OK PDFHelen100% (1)
- Practica No.3 Blance de Masa en Un Proceso de Mezclado Sin Reaccion PDFDocumento13 páginasPractica No.3 Blance de Masa en Un Proceso de Mezclado Sin Reaccion PDFOz HdzAinda não há avaliações
- REDOX SDH-citocromo C OxidasaDocumento2 páginasREDOX SDH-citocromo C OxidasaJoguard Lofcraft100% (1)
- Efecto de PH y La Concentración en La Intensidad de Fluorescencia de Riboflavina.Documento6 páginasEfecto de PH y La Concentración en La Intensidad de Fluorescencia de Riboflavina.Hector100% (1)
- Bitácora de Extracción y Caracterización de DnaDocumento4 páginasBitácora de Extracción y Caracterización de DnaOz HdzAinda não há avaliações
- Practica 4Documento8 páginasPractica 4Evelyn Jim 3295Ainda não há avaliações
- Adsorción de GibbsDocumento7 páginasAdsorción de GibbsvaneAinda não há avaliações
- Hidrolisis de RNA y DNA e Identificacion de Bases Puricas y Pirimidicas Por Cromatografia en Capa FinaDocumento2 páginasHidrolisis de RNA y DNA e Identificacion de Bases Puricas y Pirimidicas Por Cromatografia en Capa FinaBren CooperAinda não há avaliações
- Práctica No.10 Succinato Deshidrogenasa y CitocromosDocumento2 páginasPráctica No.10 Succinato Deshidrogenasa y CitocromosEvelyn Jim 3295100% (1)
- Destilacion de Una Mezcla TernariaDocumento2 páginasDestilacion de Una Mezcla TernariaAxelGomezRgAinda não há avaliações
- Evaluación de Microorganismos Cultivables de AguaDocumento5 páginasEvaluación de Microorganismos Cultivables de AguaPanchoAinda não há avaliações
- PRÀCTICA N6 Acido Fumarico Final FinalDocumento5 páginasPRÀCTICA N6 Acido Fumarico Final FinalJossLunaAinda não há avaliações
- Bitacora 6Documento4 páginasBitacora 6Morales Ramos PriscilaAinda não há avaliações
- Ejercicios de Inhibición-Activación y Efectos de PHDocumento3 páginasEjercicios de Inhibición-Activación y Efectos de PHaaron30102023Ainda não há avaliações
- Efecto de La Concentracion Del Sustrato.Documento3 páginasEfecto de La Concentracion Del Sustrato.Angie ChávezAinda não há avaliações
- Efecto PH IBQDocumento52 páginasEfecto PH IBQYara Hernandez100% (2)
- Nomenclatura de AmidasDocumento4 páginasNomenclatura de AmidasYara Hernandez100% (2)
- Sintesis de ParanitroanilinaDocumento2 páginasSintesis de ParanitroanilinaYara Hernandez0% (1)
- Torque Sobre Un Dipolo en Campo ExternoDocumento1 páginaTorque Sobre Un Dipolo en Campo ExternoYara Hernandez0% (1)
- Inhibicion EnzimaticaDocumento38 páginasInhibicion EnzimaticaAlex Pan de GraciaAinda não há avaliações
- Diagrama Entidad - RelaciónDocumento1 páginaDiagrama Entidad - Relacióncamilo.kuarkoAinda não há avaliações
- 4° BIOLOGÍA PRUEBA Enzimas 2020Documento2 páginas4° BIOLOGÍA PRUEBA Enzimas 2020Danniel AlexisAinda não há avaliações
- Anexo 2. Tarea 3 BioquimicaDocumento4 páginasAnexo 2. Tarea 3 Bioquimicaluisa rodriguezAinda não há avaliações
- Las EnzimasDocumento23 páginasLas EnzimasAntonio Solorzano100% (1)
- Seminario 7-Inhibicion EnzimaticaDocumento11 páginasSeminario 7-Inhibicion EnzimaticaAntonio CallejasAinda não há avaliações
- BiocatalizadoresDocumento17 páginasBiocatalizadoresEstephani RodriguesAinda não há avaliações
- Tema 5 Enzimas Presentacion PDFDocumento39 páginasTema 5 Enzimas Presentacion PDFJose Antonio Vargas GonzalezAinda não há avaliações
- Enzimas Digestivas Seminario Bioca FinalDocumento23 páginasEnzimas Digestivas Seminario Bioca FinalrusselAinda não há avaliações
- Enzymes in DDDocumento92 páginasEnzymes in DDDaniel Casas TelloAinda não há avaliações
- Parcial 1Documento6 páginasParcial 1Gabriel DannyAinda não há avaliações
- Enzimología Clínica 2019 - 1Documento21 páginasEnzimología Clínica 2019 - 1Naty Ale MayorgaAinda não há avaliações
- Enzimas Laboratorio - 1Documento12 páginasEnzimas Laboratorio - 1Alexis Gabriel Pumagualli84% (50)
- EnzimasDocumento70 páginasEnzimasLeonardo Galicia CasildoAinda não há avaliações
- Ejercicios de Cinetica EnzimaticaDocumento7 páginasEjercicios de Cinetica EnzimaticaJoseChesireAinda não há avaliações
- Modelo Cinetico de Michaelis Menten (Autoguardado)Documento11 páginasModelo Cinetico de Michaelis Menten (Autoguardado)Anonymous Cd0VIwdiAAinda não há avaliações
- Taller EnzDocumento6 páginasTaller EnzlhvillegasmAinda não há avaliações
- ENZIMASDocumento41 páginasENZIMASnicolehurtadosAinda não há avaliações
- Biologia Celular, CBC Uba ENZIMASDocumento60 páginasBiologia Celular, CBC Uba ENZIMASLu GonzálezAinda não há avaliações
- Semana 2 CT Proteinas EnzimasDocumento35 páginasSemana 2 CT Proteinas Enzimasesthefany floresAinda não há avaliações
- Bioquimica 37 Enzimología y Bioenergética Jessica OrozcoDocumento3 páginasBioquimica 37 Enzimología y Bioenergética Jessica OrozcoJessica OrozcoAinda não há avaliações
- Bioqumica Farmacia Unid Semana 2Documento47 páginasBioqumica Farmacia Unid Semana 2Vizcaino Rojas JosèAinda não há avaliações
- Formato de Entrega Tarea 3 DANIEL MAURICIO ADocumento7 páginasFormato de Entrega Tarea 3 DANIEL MAURICIO Adaniel abrilAinda não há avaliações
- Problemas Inhibición Por Sustrato Ingeniería EnzimáticaDocumento2 páginasProblemas Inhibición Por Sustrato Ingeniería EnzimáticaxxxtentacionAinda não há avaliações
- Informe BioquimicDocumento12 páginasInforme BioquimicDarwin AmasifuenAinda não há avaliações
- ENZIMASDocumento23 páginasENZIMASEsther Salazar Vásquez100% (1)
- Capítulo 6-El Flujo de Energía en La Vida de Una CélulaDocumento23 páginasCapítulo 6-El Flujo de Energía en La Vida de Una CélulaEdu Castro100% (1)
- Inhibición EnzimaticaDocumento2 páginasInhibición EnzimaticaJonathan R. EstradaAinda não há avaliações
- Enzimas y CoenzimasDocumento12 páginasEnzimas y CoenzimasJIMENA LETICIA MACHACA MAMANI100% (1)
- Enzimas (2021)Documento40 páginasEnzimas (2021)Aldii Soler100% (1)