Escolar Documentos
Profissional Documentos
Cultura Documentos
Solventes Proticos y Aproticos
Enviado por
Kevin Molina71%(24)71% acharam este documento útil (24 votos)
33K visualizações2 páginasTítulo original
Solventes proticos y aproticos.docx
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
71%(24)71% acharam este documento útil (24 votos)
33K visualizações2 páginasSolventes Proticos y Aproticos
Enviado por
Kevin MolinaDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 2
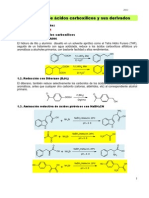
Dentro de los solventes polares, se encuentran:
1) los que son prticos
2) los que son aprticos.
Un solvente polar prtico, es aquel que es capaz de estabilizar las cargas al
formar puentes de hidrgeno con ellas. Por otro lado, uno aprtico y polar, es
aquel que es capaz de formar una capa fuerte de solvatacin solo alrededor de un
catin, sin formar puente de hidrgeno.
El solvente prtico es capaz de solvatar cationes y aniones puesto que ambos
polos de su dipolo estn fcilmente disponibles. En el ejemplo de ms abajo, que
corresponde a una molcula de alcohol, el protn que es la parte positiva del
dipolo del solvente, es muy pequeo y produce muy poco impedimento estrico al
oxgeno que es la parte negativa del dipolo.
En el caso de un solvente aprtico (el ejemplo corresponde a una molcula
de acetona), el oxgeno que es el polo negativo del dipolo, esta disponible para
solvatar una carga positiva. Sin embargo el polo positivo del solvente, que es el
carbono en este caso, queda oculto e impedido por el oxgeno y por los grupos
alquilo voluminosos. El polo positivo del solvente entonces no ser capaz de
acercarse al in negativo y solvatarlo. Por esta razn, los solventes polares
aprticos son capaces de solvatar slo las cargas positivas o cationes.
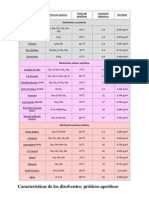
En la siguiente lista de solventes comunes, se cubre un rango de
polaridades y se los cataloga como de tipo prtico o aprticos:
Solvente Frmula Cte. Dielctrica Tipo polar
Agua H
2
O 78,5 Prtico
cido Frmico HCOOH 59,0 Prtico
Dimetilsulfoxido CH
3
SOCH
3
49,0 Aprtico
Dimetilformamida HCON(CH
3
)
2
36,7 Aprtico
Acetonitrilo CH
3
CN 36,2 Aprtico
Metanol CH
3
OH 32,6 Prtico
Hexametilfosforamida ((CH
3
)
2
N)
3
PO 30,0 Aprtico
Etanol CH
3
CH
2
OH 24,0 Prtico
Acetona CH
3
COCH
3
20,7 Aprtico
cido Actico CH
3
COOH 6,0 Prtico
R O
H
R
C O
R
R
PRTICO APRTICO
dificilmente disponible
por impedimento estrico
disponible
los dos polos del dipolo
estn fcilmente disponibles
Você também pode gostar
- Terpenos y carotenoides antioxidantes en la espinacaDocumento2 páginasTerpenos y carotenoides antioxidantes en la espinacaANA MARIA DIAZ BONILLAAinda não há avaliações
- Estructura Quimica de Las Ftalainas y Sus Miembros Mas ImportantesDocumento2 páginasEstructura Quimica de Las Ftalainas y Sus Miembros Mas ImportantesbrenchhhAinda não há avaliações
- Guia de Quimica Organica-Intermediarios de ReaccionDocumento7 páginasGuia de Quimica Organica-Intermediarios de ReaccionJose Hernandz0% (2)
- Recristalización Del Ácido AcetilsalicílicoDocumento4 páginasRecristalización Del Ácido AcetilsalicílicoGeraldineAinda não há avaliações
- Practica 1. Obtencion de CiclohexenoDocumento9 páginasPractica 1. Obtencion de Ciclohexenoosmar BAAinda não há avaliações
- Acidez de hidrógenos alfa en compuestos carbonílicosDocumento2 páginasAcidez de hidrógenos alfa en compuestos carbonílicosBeymar ContrerasAinda não há avaliações
- Informe Punto Isosbestico.Documento13 páginasInforme Punto Isosbestico.Jesus Gerardo Lopez ColmanAinda não há avaliações
- Condensación AldólicaDocumento7 páginasCondensación AldólicaGianfrancoAinda não há avaliações
- Propiedades y aplicaciones del butiraldehidoDocumento1 páginaPropiedades y aplicaciones del butiraldehidoRut Gabriela100% (1)
- 03 Lab Serie EspectroquimicaDocumento5 páginas03 Lab Serie EspectroquimicaDesmond MacLeod CareyAinda não há avaliações
- DeRIVADOS Halogenados (Obtencion de Bromuro de N-Butilo)Documento7 páginasDeRIVADOS Halogenados (Obtencion de Bromuro de N-Butilo).:("*"BLacK BuLLeT"*"):.92% (13)
- Obtención del éter β-naftil metílico (nerolina)Documento11 páginasObtención del éter β-naftil metílico (nerolina)MyriamAinda não há avaliações
- Mecanismo ChalconaDocumento1 páginaMecanismo ChalconaAna Martinez100% (3)
- Anteproyecto Destilacion Presion ReducidaDocumento3 páginasAnteproyecto Destilacion Presion Reducidaadriana6fernandaAinda não há avaliações
- Separacion de Carbohidratos Por Cromatografia en Capa FinaDocumento6 páginasSeparacion de Carbohidratos Por Cromatografia en Capa FinaFlor MarchiniAinda não há avaliações
- MSDS BenzofenonaDocumento5 páginasMSDS BenzofenonaJeefAndersonMaguiñaZuasnabarAinda não há avaliações
- Extracción Con Disolventes ActivosDocumento9 páginasExtracción Con Disolventes ActivosPablo Ramírez75% (4)
- Síntesis de CiclohexanoDocumento12 páginasSíntesis de CiclohexanoRicardo IbarraAinda não há avaliações
- Tabla de Disolventes OrganicosDocumento4 páginasTabla de Disolventes Organicosulises100% (1)
- Manual de Practicas de Organica IIDocumento42 páginasManual de Practicas de Organica IIEverardo Zamudio Hernandez67% (3)
- Practica N°2. Isomería Cis y Trans Isomerización Del Ácido Maleico A Fumarico PDFDocumento12 páginasPractica N°2. Isomería Cis y Trans Isomerización Del Ácido Maleico A Fumarico PDFRubén VeraAinda não há avaliações
- Práctica4. Síntesis de BenciloDocumento8 páginasPráctica4. Síntesis de BenciloSamantha Calvillo100% (1)
- BenzoinaDocumento20 páginasBenzoinajesus MaldonadoAinda não há avaliações
- Índice de KovatsDocumento15 páginasÍndice de KovatsNatalia0% (1)
- Sintesis de N-ButiraldehidoDocumento11 páginasSintesis de N-ButiraldehidoBrian Jeef Blancas SotoAinda não há avaliações
- Obtención del éter β-naftil metílico a partir de β-naftolDocumento7 páginasObtención del éter β-naftil metílico a partir de β-naftolMichelle50% (2)
- Practica 6 Peso Molecular Por Metodo de RastDocumento6 páginasPractica 6 Peso Molecular Por Metodo de RastJavier RG100% (2)
- Hiperconjugacion DefinicionDocumento2 páginasHiperconjugacion DefinicionDiego Guayacan100% (1)
- Cuestionario Cromatografia SimpleDocumento1 páginaCuestionario Cromatografia SimpleBrando Sedas40% (5)
- Antecedentes Destilación A Presión-Reducida PDFDocumento4 páginasAntecedentes Destilación A Presión-Reducida PDFPablo Ramírez85% (27)
- El SolucionarioDocumento2 páginasEl SolucionarioDiego HLAinda não há avaliações
- Práctica No. 8 - Extracción y Cristalización de Ácido AcetilsalicílicoDocumento7 páginasPráctica No. 8 - Extracción y Cristalización de Ácido AcetilsalicílicoJael Morales UrrutiaAinda não há avaliações
- Informe 5 Preparacion de 2-FenilindolDocumento11 páginasInforme 5 Preparacion de 2-FenilindolDani SantoyoAinda não há avaliações
- PESO MOLECULAR Por ViscosimetriaDocumento4 páginasPESO MOLECULAR Por Viscosimetriaalexadame2301100% (1)
- 2 FenilindolDocumento20 páginas2 FenilindolAna Soffia Gomez AriasAinda não há avaliações
- Halogenuros de Arilo: Características y ReactividadDocumento10 páginasHalogenuros de Arilo: Características y ReactividadAnDreAinda não há avaliações
- Columna de FraccionamientoDocumento3 páginasColumna de FraccionamientoMaria Sandoval100% (11)
- Determinacion de Peroxido de HidrogenoDocumento4 páginasDeterminacion de Peroxido de HidrogenoAle García60% (5)
- Regla de Los 18 ElectronesDocumento28 páginasRegla de Los 18 ElectronesJose Antonio Chavez Biais100% (3)
- El Ciclohexeno Caracteristicas y UsosDocumento2 páginasEl Ciclohexeno Caracteristicas y UsosAnali AnacoretaAinda não há avaliações
- Previo 2. Sustitución Nucleofílica Alifática. Obtención de N-Butilo.Documento4 páginasPrevio 2. Sustitución Nucleofílica Alifática. Obtención de N-Butilo.Arturo MezaAinda não há avaliações
- Reducción de Ácidos Carboxílicos y Sus DerivadosDocumento10 páginasReducción de Ácidos Carboxílicos y Sus DerivadosSilvia Rivera Sivila50% (2)
- Practica 4 Punto Isobestico Mi GrupoDocumento15 páginasPractica 4 Punto Isobestico Mi Grupoezequiel uzcateguiAinda não há avaliações
- (Antecedentes) EXTRACCIÓN CON DISOLVENTES ORGÁNICOSDocumento8 páginas(Antecedentes) EXTRACCIÓN CON DISOLVENTES ORGÁNICOSPablo Ramírez100% (3)
- BenzoinaDocumento16 páginasBenzoinaDiego MoralesAinda não há avaliações
- Extracción Con Disolventes OrgánicosDocumento9 páginasExtracción Con Disolventes OrgánicosPablo Ramírez100% (3)
- PRACTICA 2 Sintesis de 2-Metil-2-ButenoDocumento4 páginasPRACTICA 2 Sintesis de 2-Metil-2-ButenoDaniel James Arriaga100% (2)
- Características de disolventesDocumento4 páginasCaracterísticas de disolventesjuliob412Ainda não há avaliações
- Palmer Capitulo VDocumento10 páginasPalmer Capitulo VCesar Fernando Sarrin CepedaAinda não há avaliações
- Modelo de Glasman o de BenchDocumento1 páginaModelo de Glasman o de BenchKarla VTAinda não há avaliações
- Epoxidación SharplessDocumento14 páginasEpoxidación SharplessHezrra Perez KauffmanAinda não há avaliações
- Reporte Número 11 Obtención de Ciclohexanona Por Oxidación Con Hipoclorito de SodioDocumento11 páginasReporte Número 11 Obtención de Ciclohexanona Por Oxidación Con Hipoclorito de SodioJose Antonio Martinez MorenoAinda não há avaliações
- OXIRANODocumento5 páginasOXIRANOpakleon50% (2)
- Laboratorio Química OrgánicaDocumento133 páginasLaboratorio Química Orgánicanjugo99% (135)
- Ley Distribución NernstDocumento6 páginasLey Distribución NernstThalia Herrera50% (2)
- 11 Aldehidos y CetonasDocumento15 páginas11 Aldehidos y Cetonasedson0% (1)
- Examen Parcial de Quimica 2 Fia-Uni (Masguito)Documento9 páginasExamen Parcial de Quimica 2 Fia-Uni (Masguito)Ricardo ChuraAinda não há avaliações
- Solventes próticos y apróticosDocumento4 páginasSolventes próticos y apróticosdarkwolf1003Ainda não há avaliações
- Preparación de aldehídos: métodos oxidativos y reductivosDocumento39 páginasPreparación de aldehídos: métodos oxidativos y reductivosKEVIN SMITH SURICHAQUI PARHUAYAinda não há avaliações
- Identificación Aldehídos, Cetonas y Ácidos CarboxílicosDocumento32 páginasIdentificación Aldehídos, Cetonas y Ácidos CarboxílicosAndres SantiagoAinda não há avaliações
- Metalurgia Del HierroDocumento3 páginasMetalurgia Del HierroKevin MolinaAinda não há avaliações
- Conceptos Generales Del Arte IIDocumento31 páginasConceptos Generales Del Arte IIKevin MolinaAinda não há avaliações
- Metalurgia Del HierroDocumento3 páginasMetalurgia Del HierroKevin MolinaAinda não há avaliações
- La Camara OscuraDocumento4 páginasLa Camara OscuraKevin MolinaAinda não há avaliações
- Resumen de Química GeneralDocumento7 páginasResumen de Química GeneralRaybelAinda não há avaliações
- IMFORME-DE-PRACTICAS-PRE-PROFESIONALES Edu BarronDocumento88 páginasIMFORME-DE-PRACTICAS-PRE-PROFESIONALES Edu BarronCristhoferAinda não há avaliações
- Valvoline Unitrac Liquido HidraulicoDocumento1 páginaValvoline Unitrac Liquido HidraulicoElmer LagosAinda não há avaliações
- Guía de Trabajo 10Documento10 páginasGuía de Trabajo 10Carlos BarahonaAinda não há avaliações
- Práctica No. 4 Geometría MolecularDocumento15 páginasPráctica No. 4 Geometría MolecularAnyelo PirajanAinda não há avaliações
- Oxígeno DisueltoDocumento89 páginasOxígeno DisueltoAdri BellamyAinda não há avaliações
- Sales Biliares y Hormonas EsteroideasDocumento3 páginasSales Biliares y Hormonas EsteroideasValeria MoralesAinda não há avaliações
- Balance de Masas Del Proceso Del CaféDocumento24 páginasBalance de Masas Del Proceso Del CaféJUAN DIEGO HUERTAS SOLANILLAAinda não há avaliações
- Geoquímica del Stock Chinchiná-Santa RosaDocumento12 páginasGeoquímica del Stock Chinchiná-Santa RosaJuan David Salinas TrochezAinda não há avaliações
- 11111111111111111Documento2 páginas11111111111111111Mayvis PrinceAinda não há avaliações
- Expo1 Materiales G7Documento16 páginasExpo1 Materiales G7Andres LopezAinda não há avaliações
- Cuestionario Unidad 2 Materiales en IngenieríaDocumento3 páginasCuestionario Unidad 2 Materiales en IngenieríaMaiiky Ramirez Esparza100% (3)
- Ejemplo Rotulo Sustancias QuímicasDocumento3 páginasEjemplo Rotulo Sustancias QuímicasLinaMRojasRodriguezAinda não há avaliações
- Analisis de Furanos en TrasformadoresDocumento8 páginasAnalisis de Furanos en TrasformadoresCristian Stuardo GaticaAinda não há avaliações
- Determinación de pKa y pI de la glicina mediante titulación potenciométricaDocumento9 páginasDeterminación de pKa y pI de la glicina mediante titulación potenciométricaCeily Janine AcevedoAinda não há avaliações
- MULTIS EP 2 - 084738 - Argentina - Spanish - 20210128Documento12 páginasMULTIS EP 2 - 084738 - Argentina - Spanish - 20210128Cesar RivasAinda não há avaliações
- Alberto Manso Tarea S4Documento6 páginasAlberto Manso Tarea S4Alberto MansoAinda não há avaliações
- Duplalim desinfectante bactericida fungicida viricida especificaciónDocumento1 páginaDuplalim desinfectante bactericida fungicida viricida especificaciónCarlos VALDERA YSLAAinda não há avaliações
- DesencoladoDocumento3 páginasDesencoladoMirian Danidtza Fernandez cayoAinda não há avaliações
- Practicas de Laboratorio de Quim II para E.P Iq - EducaciónDocumento67 páginasPracticas de Laboratorio de Quim II para E.P Iq - Educación224979Ainda não há avaliações
- Título para documento de Química Analítica InstrumentalDocumento6 páginasTítulo para documento de Química Analítica Instrumentalbrayan jordi rodriguez guizadoAinda não há avaliações
- FDS-BB Biopinol Limpiador DesinfectanteDocumento3 páginasFDS-BB Biopinol Limpiador DesinfectanteKia PrideAinda não há avaliações
- 1º BACHILLERATO BIOLOGÍA. Niveles de Organización de Los Seres Vivos.Documento6 páginas1º BACHILLERATO BIOLOGÍA. Niveles de Organización de Los Seres Vivos.ElecpAinda não há avaliações
- Plan de ClasesDocumento3 páginasPlan de ClasesCecilia LopezAinda não há avaliações
- Estrategias para Mejorar La Producción de Biohidrógeno A Partir de Aguas Residuales de Yuca en Reactores de Lecho FijoDocumento10 páginasEstrategias para Mejorar La Producción de Biohidrógeno A Partir de Aguas Residuales de Yuca en Reactores de Lecho FijoLuis FigueroaAinda não há avaliações
- Equilibrio de protones y teoría de Brönsted-LowryDocumento12 páginasEquilibrio de protones y teoría de Brönsted-Lowryallison bffAinda não há avaliações
- Terapiantia Parasitaria ResumDocumento41 páginasTerapiantia Parasitaria ResumValentina Silva TammAinda não há avaliações
- Fluidos de Perforacion y Control de Solidos Lizeth Tania Huayllani Mamani PDFDocumento68 páginasFluidos de Perforacion y Control de Solidos Lizeth Tania Huayllani Mamani PDFRuddy Moreno CuellarAinda não há avaliações
- 2iv40 - Equipo 1 - Obtención de Eter MetilnaftílicoDocumento9 páginas2iv40 - Equipo 1 - Obtención de Eter MetilnaftílicoMarian Giselle Godines NicolasAinda não há avaliações
- Acero 2Documento35 páginasAcero 2Diego VillanuevaAinda não há avaliações