Escolar Documentos
Profissional Documentos
Cultura Documentos
Pembuatan Amonia
Enviado por
Ilham Surya AbadiDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Pembuatan Amonia
Enviado por
Ilham Surya AbadiDireitos autorais:
Formatos disponíveis
1
BAB I
PENDAHULUAN
Latar Belakang
Amonia (NH
3
) itu termasuk gas alkalin yang tidak berwarna, lebih ringan dari udara dan
punya aroma khas yang nyengat. Amonia saat ini dijadikan bahan baku pupuk, abu soda, asam
nitrat, nilon, plastik, pencelup, karet dan most of peledak. Pembuatan garam-garam amonia itu
sudah dimulai sejak abad keempat Sebelum Masehi. Gas amonia pertama kali diproduksi dalam
bentuk komponen murni thn 1774 oleh Priestly.
Seiring berkembangnya zaman populasi penduduk semakin meningka, kebutuhan pangan
juga meningkat. Pertanian dan perkebunan berkembang jadi bisnis yg menarik. Semua mulai
meneliti banyak hal, segala-galanya yang intinya dapat meningkatkan hasil pertanian. Tahun
1840, orang-orang mulai tahu kalau nitrogen itu salah satu komponen penting dari pupuk
mineral. dan amonia merupakan sumber nitrogen utama yang digunakan dalam pupuk mineral
tersebut.
Sintesis amonia langsung dari hidrogen dan nitrogen yang mempunyai skala komersial
pertama kali dirintis oleh Haber dan Bosch tahun 1913 yaitu dengan kapasitas 30 metrik ton
perhari di pabrik Badische Anilin und Soda Fabrik (BASF) di Ludwigshafen-Oppau Jerman.
Proses tersebut menggunakan peralatan dengan kondisi operasi tekanan dan temperatur tinggi
dengan katalis besi berpromotor yang sampai sekarang masih digunakan sebagai katalis sintesis
amonia. Antara thn 1930-1950, penekanan pembuatan amonia ada pada bidang pembangkitan
gas sintesis. Cadangan batubara di Eropa jadi bahan utama bagi pembuatan amonia saat itu.
Industri pembuatan amonia di Amerika Utara juga bergantung sepenuhnya terhadap
cadangan gas alam. Tahun 1963 merupakan tahun dimana teknologi terbesar dalam pembuatan
amonia digunakan. Pabrik Monsanto oleh The MW Kellog Company menandai digunakannya
kompresor sentrifugal yg terintegrasi penuh dengan sistem utilitas. Inovasi ini adalal batu
loncatan ke arah pembangunan pabrik-pabrik amonia terintegrasi berskala besar (berkapasitas
907 1500 ton perhari) yang dibangun dimana-mana pada thn 1970. Amonia punya berat
molekul 17,03. Amonia ditekanan atmosfer fasanya gas. Titik didih Amonia 33,35
o
C, titik
bekunya 77,7
o
C, temperatur & tekanan kritiknya 133
o
C & 1657 psi. Entalpi pembentukan
(H), kkal/mol NH
3(g)
pd 0
o
C, -9,368; 25
o
C, -11,04. Pada proses sintesis pd suhu 700-1000
o
F,
akan dilepaskan panas sebesar 13 kkal/mol.
2
BAB II
PEMBAHASAN
Amoniak
Rumus molekul amoniak adalah NH
3
.Terlihat amoniak terbentuk dari gugus N dan H
yang masing-masing dapat diperoleh dari H
2
(Hidogen) dan N
2
(Nitrogen). H
2
adalah salah satu
komponen gas synthesa yang diperoleh dari pemrosesan gas alam yang mengandung 80 95 %
CH
4
(Metan). Sedang N
2
diperoleh dari udara yang mengandung 79% N
2
dan 21% O
2
dengan
perbandingan molarnya 3:1. Amonia disintesis pake reaksi reversibel antara hidrogen dengan
nitrogen. Reaksinya dibawah:
Amonia (NH
3
) merupakan senyawa komersil nitrogen yang paling penting. Ia diproduksi
menggunakan proses Haber. Gas natural (metana, CH
4
) bereaksi dengan uap panas untuk
memproduksi karbon dioksida dan gas hidrogen (H
2
) dalam proses dua langkah. Gas hidrogen
dan gas nitrogen lantas direaksikan dalam proses Haber untuk memproduksi amonia. Amonia
(NH
3
) itu termasuk gas alkalin yang tidak berwarna, lebih ringan dari udara dan punya aroma
khas yang nyengat dapat dengan mudah dicairkan. Bahkan bentuk cair senyawa ini digunakan
sebagai pupuk nitrogen.
Pembuatan Amonia menurut proses Haber-Bosch, Nitrogen terdapat melimpah di udara,
yaitu sekitar 78% volume. Walaupun demikian, senyawa nitrogen tidak terdapat banyak di alam.
Satu-satunya sumber alam yang penting ialah NaNO
3
yang disebut Sendawa Chili. Sementara
itu, kebutuhan senyawa nitrogen semakin banyak, misalnya untuk industri pupuk, dan bahan
peledak. Oleh karena itu, proses sintesis senyawa nitrogen, fiksasi nitrogen buatan, merupakan
proses industri yang sangat penting. Metode yang utama adalah mereaksikan nitrogen dengan
hidrogen membentuk amonia. Selanjutnya amonia dapat diubah menjadi senyawa nitrogen lain
seperti asam nitrat dan garam nitrat.
Sifat-sifat amonia
Massa jenis and fase 0.6942 g/L, gas.
[3]
Kelarutan dalam air 89.9 g/100 ml pada 0 C.
Titik lebur -77.73 C (195.42 K)
Temperatur autosulutan 651 C
3
Titik didih -33.34 C (239.81 K)
Keasaman (pK
a
) 9.25
Kebasaan (pK
b
) 4.75
Dasar teori pembuatan amonia dari nitrogen dan hidrogen ditemukan oleh Fritz Haber
(1908), seorang ahli kimia dari Jerman. Sedangkan proses industri pembuatan amonia untuk
produksi secara besar-besaran ditemukan oleh Carl Bosch, seorang insinyur kimia juga dari
Jerman. Persamaan termokimia reaksi sintesis amonia adalah :
N
2
(g) + 3H
2
(g) 2NH
3
(g) ; Delta H = -92,4kJ Pada 25
o
C ; Kp = 6,2105
Berdasarkan prinsip kesetimbangan kondisi yang menguntungkan untuk ketuntasan
reaksi ke kanan (pembentukan NH3) adalah suhu rendah dan tekanan tinggi. Akan tetapi, reaksi
tersebut berlangsung sangat lambat pada suhu rendah, bahkan pada suhu 500
o
C sekalipun.
Dipihak lain, karena reaksi ke kanan eksoterm, penambahan suhu akan mengurangi rendemen.
Proses Haber-Bosch semula dilangsungkan pada suhu sekitar 500 derajat celcius dan
tekanan sekitar 150-350 atm dengan katalisator, yaitu serbuk besi dicampur dengan Al
2
O
3
, MgO,
CaO, dan K
2
O. Dewasa ini, seiring dengan kemajuan teknologi, digunakan tekanan yang jauh
lebih besar, bahkan mencapai 700 atm. Untuk mengurangi reaksi balik, maka amonia yang
terbentuk segera dipisahkan. Mula-mula campuran gas nitrogen dan hidrogen dikompresi
(dimampatkan) hingga mencapai tekanan yang diinginkan. Kemudian campuran gas dipanaskan
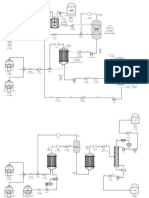
dalam suatu ruangan yang bersama katalisator sehingga terbentuk amonia. Diagram alur dari
proses Haber-bosch untuk sintesis amonia diberikan pada Gambar berikut:
4
Skema pembuatan amonia menurut proses Haber-Bosch
Tabel : Kondisi Optimum Pembuatan NH
3
No Faktor Reaksi : N
2
(g) + 3H
2
(g) 2NH
3
(g) H= -924 kJ Kondisi Optimum
1. Suhu 1. Reaksi bersifat eksoterm
2. Suhu rendah akan menggeser kesetimbangan
kekanan.
3. Kendala:Reaksi berjalan lambat
400-600
o
C
2. Tekanan 1. Jumlah mol pereaksi lebih besar dibanding dengan
jumlah mol produk.
2. Memperbesar tekanan akan menggeser
kesetimbangan kekanan.
3. Kendala Tekanan sistem dibatasi oleh kemampuan
alat dan faktor keselamatan.
150-300 atm
3. Konsentrasi Pengambilan NH
3
secara terus menerus akan _
5
menggeser kesetimbangan kearah kanan
4. Katalis Katalis tidak menggeser kesetimbangan kekanan,
tetapi mempercepat laju reaksi secara keseluruhan
Fe dengan campuran
Al
2
O
3
KOH dan garam
lainnya
Pengaruh katalis pada sistem kesetimbangan adalah dapat mempercepat terjadinya reaksi
kekanan atau kekiri, keadaan kesetimbangan akan tercapai lebih cepat tetapi katalis tidak
mengubah jumlah kesetimbangan dari spesies-spesies yang bereaksi atau dengan kata lain katalis
tidak mengubah nilai numeris dalam tetapan kesetimbangan. Peranan katalis adalah mengubah
mekanisme reaksi kimia agar cepat tercapai suatu produk.
Katalis yang dipergunakan untuk mempercepat reaksi memberikan mekanisme suatu
reaksi yang lebih rendah dibandingkan reaksi yang tanpa katalis. Dengan energi aktivasi lebih
rendah menyebabkan maka lebih banyak partikel yang memiliki energi kinetik yang cukup untuk
mengatasi halangan energi aktivasi sehingga jumlah tumbukan efektif akan bertambah sehingga
laju meningkat.
Prosses Pabrik Amonia.
Reaksi-reaksi yang terlibat dalam proses pembuatan NH
3
dan CO
2
adalah sebagai berikut:
6
Katalisator
Katalisator adalah suatu senyawa yang berfungsi untuk mempercepat suatu reaksi kimia.
Secara fisik katalisator tidak berubah bentuk walaupun terlibat dalam suatu reaksi kimia. Dari
bentuknya katalisator di pabrik Amoniak sebagian besar berbentuk padatan. Hanya DEA
(Dietanol Amione) yang berbentuk cairan.
Katalisator yang dalam bentuk padatan ini disuplai dari pembuatnya dalam kondisi masih
teroksidasi. Untuk mengaktifkanya katalisator harus terlebih dahulu direduksi (penurunan
bilangan oksida) menggunakan pereduksi H
2
dan CO
2
, akan tetapi yang umum dipakai adalah H
2
karena kenaikan temperatur yang dihasilkan dari aktifasi/reduksi katalis masih dapat
dikendalikan dibandingkan bila menggunakan CO sebagai pereduksi.
Berikut adalah salah satu contoh reaksi reduksi katalis Fe
3
O
4
dengan H
2
:
3Fe
2
O
3
+ H
2
2Fe
3
O
4
+H
2
O + Panas
Katalisator yang aktif (tereduksi) bila terkena udara ( O
2
) akan bereaksi dengan cepat
dan menghasilkan panas yang besar (pyrophoric) dan sulit dikendalikan, oleh karena itu
katalisator baru selalu disuplai oleh penjual dalam bentuk teroksidasi agar pada saat dibuka
drumnya ketika akan dimasukkan ke dalam reaktor tidak bereaksi dengan udara.
Untuk menjaga katalisator tetap tinggi aktifitasnya maka beberapa beberapa racun katalis
berikut harus dipastikan tidak masuk ke dalam sistem reaksi :
Sulfur
Carbon
CL
-
Phospat
Khusus untuk katalis synthesa amoniak disamping racun-racun diatas berikut racun-racun
lainnya yang dapat menurunkan aktifitas katalis :
CO
CO
2
H
2
O
7
Berikut ini adalah gambar proses pembuatan ammonia:
Tiga tahap dalam penyiapan gas synthesa.
Desulfurisasi.
Gas alam pada umumnya mengandung sulfur dalam bentuk H
2
S / Sulfur Anorganik dan
Sulfur Organik seperti mercaptan yang rumus molekulnya RS. Kadar sulfur anorganiknya di
dalam gas alam yang diterima industri pupuk adalah relatif kecil yaitu berkisar 0,18 -0.3 ppm
sedang sulfur organiknya relative tidak ada.
Kadar sulfur dalam gas alam yang diijinkan untuk memasuki Primary Reformer
maksimum adalah 0,1 ppm. Untuk menyerap sulfur dari gas yang dari gas alam digunakan ZnO
sebagai adsorbent ini bukan katalis, lihat reaksi no 1.
Keberhasilan adsorbsi sulfur anorganik praktis diadsorbsi pada temperatur yang lebih rendah
(200-250
o
C) dibandingkan dengan sulfur organik (250-400
o
C).
8
Kondisi operasi di Desulfurisasi:
Pressure : 35-40 kg/cm
2
G
Temperature Inlet : 350-400
o
C
Temperature Outlet : 330-380
o
C
Primary Reformer.
Ke dalam Primary Reformer dimasukan Steam bersama gas alam yang keluar dari
Desulfurisasi. Sebelum bertemu katalis yang berada dalam tube yang dipanasi secara radiasi oleh
burner-burner (seperti burner pada kompor gas), campuran steam dan gas terlebih dahulu
dipanasi hingga temperatur reaksi 530-650
o
C. Hal ini sesuai dengan jenis reaksinya yang
endotermis. Disamping reaksi reforming, reaksi shift juga terjadi di Primary Reformer seperti
pada reaksi no. 2 dan no. 3.
Untuk menjamin bahwa reaksi berjalan sesempurna mungkin rasio steam terhadap carbon yang
ada dalam gas alam (S/C) dijaga sekitar 3,1-4 (mol/mol)
Kondisi operasi Primary Reformer :
Pressure : 35 40 kg/cm
2
G
Temperature Inlet : 530 650
o
C
Temperature Outlet : 770 811
o
C
Kadar CH
4
Outle : 9 16 % berat
Kadar CO Outlet : 8 9 % berat
Kadar H
2
Outlet : 65 70 % berat.
Scondary Reformer.
Pada dasarnya Scondary Reformer berfunggsi untuk menyempurnakan reaksi reforming
yang telah terjadi di Primery Reforming. Kalau Primery Reformer sumber panas untuk reaksi
reforming yang endotermis disuplay oleh burner-burner yang memberikan panasnya secara
radiasi, maka sumber panas di Scondary Reformer disuplay oleh udara yang dimasukkan ke
Scondary Reformer menggunakan kompresor udara.
Reaksi pembakaran O
2
dari udara dengan H
2
hasil reaksi reforming di Primary Reformer :
O
2
+ H
2
H
2
O + Panas ( exothermic)
Akan menghasilkan panas yang akan dipakai oleh reaksi reforming Scondary Reformer.
Campuran hasil reaksi di Scondery Reformer ini akan menyisakan N
2
yang praktis tidak/belum
9
bereaksi dengan H
2
dan campuran gas lainnya. N
2
akan bereaksi dengan H
2
nantinya di
Converter Amoniak setelah menjalani berbagai proses pemurnian berikutnya.
Kondisi operasi di Scondary Reformer :
Pressure : 35-40 kg/cm
2
G
Temperature Inlet : 520-560
o
C
Temperature Outlet : 950-1050
o
C
CH
4
Outlet : 0,2-1,0 % berat
CO Outlet : 10-13 % berat
H
2
Outlet : 54-56 % berat
Tiga tahap proses pemurnian gas synthesa
CO Shift dibagi dalam dua tahap yaitu :
1. CO Shift Temperatur Tinggi / High Temperature Shift (HTS)
2. CO Shift Temperatur Rendah / Low Temperature Shift (LTS)
Tujuan Reaksi shift adalah untuk menyempurnakan pembentukan H
2
seperti telah
dilakukan pada reaksi reforming dengan mereakasikan CO dengan H
2
O menjadi H
2
dan CO
2
seperti telah dituliskan pada reaksi no. 3 di atas dan untuk mengurangi CO yang terbentuk di
Reformer yang merupakan racun bagi katalisator amoniak.
Pada tahap HTS dimana reaksi masih jauh dari kesetimbangan kimia maka reaksi
dilaksanakan pada temperature tinggi (360
o
C). Sedang pada LTS dimana reaksi sudah berada
pada kesetimbangan, penurunan temperature reaksi (210
o
C) akan menggeser kesetimbangan ke
kanan atau kearah terbentuknya H
2
. Dengan demikian LTS akan menyempurnakan reaksi yang
eksotermis ini ke arah produk.
Kondisi operasi HTS :
Pressure : 35-40 kg/cm
2
G
Temperature Inlat : 340-380
o
C
Temperature Outlet : 420 440
o
C
CO Inlet : 12-14,5 % berat
CO Outlet : 2,5-4,5 % berat.
10
Kondisi operasi LTS :
Pressure : 35-40 kg/cm
2
G
Temperature Inlet : 190-210
o
C
Temperature Outlet : 220-240
o
C
CO Inlet : 2,5-4,5 % berat
CO Outlet : 0,2-0,4 % berat
CO
2
Outlet : 16-18 % berat
CO2 Removal
Setelah CO diturunkan sampai kadar terendah, selanjutnya CO
2
diturunkan hingga 0,1 %
berat (1000 ppm). Penurunan CO
2
dilakukan dengan cara absorbsi oleh larutan K
2
CO
3
(
karbonat) yang konsentraasinya 25-30 % berat di dalam sebuah menara Absprber.
Gas Synthesa yang mengandung 16%-18% berat CO
2
dipertemukan dengan larutan
karbonat yang mengalir dari atas ke bawah sedang gas mengalir dari bawah ke atas. Selanjutnya
dalam pertemuan keduanya, CO
2
diserap oleh larutan karbonat sesuai reaksi no.5. Untuk
meningkatkan efektifitas penyerapan oleh K
2
CO
3
diberikan juga Dietanol Amine (DEA) dengan
konsentrasi 2,5-3 % berat.
Di Absorber penyerapan dilakukan dalam dua tahap. Absorbsi di bagian bawah absorber
dilakukan dengan larutan karbonat yang bertemperature 65-117
o
C, sedang absorbsi berikutnya
dilakukan di bagian atas Absorber dengan larutan Karbonat bertemperature 65-70
o
C. Tujuan
tahapan absorbsi ini adalah untuk meningkatkan penyerapan CO
2
.
Penyerapan CO
2
di menara Absorber berlangsung dengan kondisi :
Pressure : 27-35 kg/cm
2
G
Temperatur Gas Inlet : 100-130
o
C
Temperatur Gas Outlet : 65-70
o
C
Temperature Larutan Karbonat inlet :
o Ke Top menara : 65-70
o
C
o Ke Middle Menara : 115-117
o
C
CO
2
Inlet : 16-18 % berat
CO
2
Outlet : 0,04-0,1 % berat.
Sebagian besar K
2
CO
3
dalam larutan Karbonat yang telah banyak menyerap CO
2
(Rich
Solution) berubah menjadi KHCO
3
seperti terlihat pada reaksi no. 5. Selanjutnya KHCO
3
ini
11
harus kembali diubah menjadi K
2
CO
3
agar bisa disirkulasikan ke Absorber untuk menyerap CO
2
.
Hal ini dilakukan di Menara Regenerator dan reaksi yang tejadi adalah reaksi pada no 6.
Dari Absorber yang bertekanan 27-35 kg/cm
2
G larutan Karbonat (Rich Solution) dikirim ke
regenarator yang tekanan operasinya 0,4-0,8 kg/cm
2
G. Penurunan pressure yang cukup besar ini
akan menggeser kesetimbangan reaksi no. 6 ke kanan atau ke arah pelepasan CO
2
dan
pembentuan K
2
CO
3
.
Di samping dengan penurunan tekanan, pelepasan CO
2
dari larutan karbonat (Rich Solution)
juga dibantu dengan pemberian panas yang disuplay dari steam yang masuk dan dibangkitkan di
Reboiler-reboiler yang terletak di bagian bawah Regenator.
Kondisi operasi Regenarator :
Pressure : 0,4-0,8 kg/cm
2
G
Temberature Bottom : 120-130
o
C
Larutan Karbonat yang telah bebas CO
2
( Lean Solution) ini kemudian dikirim kembali ke
Absorber, sedangkan CO
2
yang keluar dari Regenarator dikirim ke Pabrik Urea.
Metanasi
Setelah keluar dari CO
2
Removal gas synthesa masih mengandung 0,3 % CO dan 0,1 %
CO
2
yang harus dikurangi lagi kadarnya hingga total CO+CO
2
maksimum 10 ppm. Pada
dasarnya reaksi metanasi yang terjadi adalah kebalikan dari reaksi reforming, seperti reaksi no.4.
Kondisi operasi Metanasi :
Pressure : 25-30 kg/cm
2
G
Temperature Inleet : 280-310
o
C
Temperature Outlet : 320-340
o
C
Synthesis Loop dan Refrigerasi.
Di dalam Synthesis loop ini terdapat converter amoniak yang berfungsi mereaksikan N
2
dengan H
2
untuk membentuk Amoniak /NH
3
. Gas synthesa dengan kadar CO+CO
2
maksimum
10 ppm sebelum dimasukkan ke Synthesis loop dinaikkan tekanannya terlebih dahulu ke 130-
210 kg/cm
2
G menggunakan kompressor Synthesis Gas.
Yang perlu diperhatikan adalah rasio H
2
/N
2
dijaga 3 atau sedikit dibawah dari 3. Hal ini penting
dipertahankan agar reaksi pembentukan amoniak berjalan maksimal. Pangaturan Ratio ini
dilakukan dengan mengatur laju udara yang dimasukkan ke Scondary Reformer.
12
Reaksi pembentukan amoniak ini berlangsung pada temperature inlet Converter 270
o
C
dan temperature 530
o
C. Dengan temperature setinggi ini, maka amoniak yang terbentuk
mustahil diperoleh dalam keadan cair. Untuk itu gas keluar Converter harus terlebih dahulu
menjalani pendinginan hingga temperature 6 (-5)
o
C. Pendinginan ke temperature ini dilakukan
dengan cara,melakukan pertukaran panas antara gas masuk dengan Converter dengan gas keluar
Converter, pembangkitan steam dan pemanasan air umpan boiler (BFW), pendinginan dengan
menggunakan air pendingin ( cooling water ) serta yang utama adalah pendinginan
menggunakan refrigerasi.
Gas yang telah didinginkan,karena masih mengandung H
2
dan N
2
yang tidak bereaksi, gas
dicampur dengan gas dari metanasi dikembalikan ke Converter amoniak. Sistem ini akhirnya
merupakan sebuah Loop atau siklue Amoniak.
Di dalam Loop ini juga ada gas-gas yang benar-benar tidak bereaksi yang disebut inert,
yaitu CH
4
yang berasal dari Metanasi dan Argon (Ar) yang berasal dari udara yang dimasukkan
ke Scondary Reformer. Inert ini konsentrasinya harus dijaga sekitar 7-11 % berat agar reaksi
pembentukan amoniak berlangsung maksimal.
Adapun gas dari metanasi yang mengandung CO, CO
2
dan H
2
O sebelum masuk ke dalam
synthesis Loop dipertemukan terlebih dahulu dengan gas keluar Converter yang sudah
didinginkan dan mengandung amoniak cair. Tujuannya adalah agar CO, CO
2
dan H
2
O yang ada
dalam gas dari Metanasi (make up gas) dapat larut dalam amoniak cair dan terbawa ke
refrigerasi, tidak ke inlet Converter amoniak.
Kondisi Operasi Converter :
Pressure : 230-210 kg/cm
2
G
Temperature Inlet : 250-270
o
C
Temperature Outlet : 480-530
o
C
NH
3
Inlet : 1,5-5 % berat
NH
3
Outlet : 13-20 % berat.
Refrigerasi
Produk amoniak cair dengan temperature 6
o
C (-5)
o
C ini selanjutnya dikirim ke
Refrigerasi untuk dimurnikan dari H
2
, N
2
, CO, CO
2
, H
2
O dan inert yang terlarut dalam amoniak
cair dan didinginkan hingga temperature -31
o
C. Pemurnian dilakukan dengan jalan menurunkan
tekanannya dari 130-210 kg/cm
2
G menjadi 17 kg/cm
2
G. Dengan jalan ini kelarutan gas-gas
tersebut diatas akan turun dan gas-gas akan lepas dari amoniak cair.
13
Refrigerasi ini seperti layaknya sebuah lemari es dilengkapi dengan kompresor
refrigerant. Kompressor ini berfungsi untuk menaikkan pressure uap amoniak agar mudah
dicairkan menggunakan air pendingin. Amoniak cair ini selanjutnya dikirim ke penukar panas
yang ada di synthesa loop yang dipakai untuk mendinginkan gas keluar Converter amoniak dan
mencairkan amoniak yang terdapat dalam gas keluar Converter. Pendinginan ini mampu
membuat amoniak cair keluar loop bertemperature 6-(-5
o
C).
Uap penukar panas yang keluar dari penukar panas diatas yang merukajan hasil dari
peristiwa pertukaaran panasdikirim ke Kompresor refrigeransi. Begitu pula dengan amoniak cair
dari hasil pemurnian.
Selanjutnya amoniak cair yang panas (25
o
C) yang merupakan hasil kondensasi uap amoniak
keluar kompressor/discharge dikirim ke pabrik Urea. Sedangkan amoniak cair yang dingin (-31
o
C)dari bagian suction komperssor dikirim ke Storage Amoniak.
Demikian proses pembuatan amoniak dan karbondioksida sebagai bahan baku pembuatan
Industri Pupuk Urea.
Nilai pH Amonia
Nilai pH atau potentiometric hydrogen pada dasarnya merupakan indikator untuk
mengukur kadar keasaman suatu larutan. Nilai pH suatu larutan diukur dalam skala logaritmik
dengan nilai 0,0 sebagai ukuran paling asam dan 14,0 sebagai nilai paling basa. Larutan dengan
pH 7,0 dianggap sebagai larutan netral. Oleh karena itu untuk mengetahui apakah suatu larutan
asam, basa, atau netral, nilai pH larutan tersebut harus diketahui.
Saat mengukur nilai pH suatu larutan, pada dasarnya kita menghitung jumlah ion
hidrogen (H +) dan ion hidroksil (OH-) yang terdapat dalam sampel. Peningkatan ion hidrogen
berarti larutan akan semakin asam, sementara pengurangan ion hidrogen (H +) dan penambahan
ion hidroksil (OH-) akan membuat larutan semakin basa. pH amonia sekitar 11,5 yang artinya
bersifat basa.
Amonia memiliki kemampuan menetralisir asam dan saat dilarutkan dalam air akan membentuk
amonium bermuatan positif (NH4 +) dan ion hidroksida bermuatan negatif (OH-).
Manfaat & Kegunaan Amonia
Amonia umum digunakan sebagai bahan pembuat obat-obatan. Amonia yang dilarutkan
dalam air dapat digunakan untuk membersihkan berbagai perkakas rumah tangga. Zat ini juga
digunakan sebagai campuran pembuat pupuk untuk menyediakan unsur nitrogen bagi tanaman.
14
DAFTAR PUSTAKA
http://bumbata.com/18207/amonia-sifat-kimia-ph-dan-kegunaannya/#ixzz29SUQyTzK
Kimia SMU Kelas XI
Você também pode gostar
- Azas Teknik Kimia 2Documento10 páginasAzas Teknik Kimia 2wisnusputra50% (2)
- Proses Pembuatan Amonia,,, MakalahDocumento7 páginasProses Pembuatan Amonia,,, MakalahDewideew100% (2)
- Industri AmoniaDocumento12 páginasIndustri Amoniamisna100% (1)
- Laporan 1. Analisis Kualitatif Zat OrganikDocumento21 páginasLaporan 1. Analisis Kualitatif Zat OrganikZeffAinda não há avaliações
- PropanolDocumento1 páginaPropanolHerlan MuhammadAinda não há avaliações
- DHDT Proses dan KomponenDocumento28 páginasDHDT Proses dan KomponenMayFifthAinda não há avaliações
- MSDS Ammonium Sulphate (Indo)Documento8 páginasMSDS Ammonium Sulphate (Indo)Evi PamayantiAinda não há avaliações
- AIK (Makalah Distilasi)Documento10 páginasAIK (Makalah Distilasi)Citra Kusuma ParahitaAinda não há avaliações
- AMINADocumento3 páginasAMINADina LestariAinda não há avaliações
- DESTILASIDocumento10 páginasDESTILASIrofiqaasriAinda não há avaliações
- Reaksi Aminasi 2Documento8 páginasReaksi Aminasi 2Dahliana AlamiAinda não há avaliações
- Bab 3 Hukum Laju Reaksi & Konsep Orde Reaksi - RevDocumento26 páginasBab 3 Hukum Laju Reaksi & Konsep Orde Reaksi - RevFiAinda não há avaliações
- Campuran Azeotrop Benzene-TolueneDocumento2 páginasCampuran Azeotrop Benzene-TolueneTri Palupi SundariAinda não há avaliações
- Dokumen - Tips - Neraca Massa Dengan ReaksiDocumento9 páginasDokumen - Tips - Neraca Massa Dengan ReaksiBayu D-scyzorAinda não há avaliações
- Anhidrida MaleatDocumento8 páginasAnhidrida MaleatIrwan Ir100% (1)
- Kinetika KimiaDocumento17 páginasKinetika KimiaPtm ZhullivanAinda não há avaliações
- Turbin UapDocumento7 páginasTurbin UapSiska MutiaraAinda não há avaliações
- Kuliah Termo IiDocumento34 páginasKuliah Termo IiIhans23Ainda não há avaliações
- PROSES LNGDocumento6 páginasPROSES LNGAhmad Hanif SoehendikAinda não há avaliações
- Alkil Halida Reaksi Substitusi Nukleofilik Dan Eliminasi-1Documento64 páginasAlkil Halida Reaksi Substitusi Nukleofilik Dan Eliminasi-1Dwi Evi IndriyaniAinda não há avaliações
- Tugas Pik AmoniaDocumento12 páginasTugas Pik AmoniaArdi RiyanAinda não há avaliações
- Komposisi Produk Uap dan Cair Batch DistilasiDocumento8 páginasKomposisi Produk Uap dan Cair Batch DistilasiNadhif EdmaAinda não há avaliações
- ALUMINIUM DAN SENYAWANYADocumento24 páginasALUMINIUM DAN SENYAWANYApebriAinda não há avaliações
- Kimia Fisika IDocumento38 páginasKimia Fisika IFarel Abdala ShiddiqAinda não há avaliações
- Proses Kimia Dalam IndustriDocumento27 páginasProses Kimia Dalam IndustriArif HidayatAinda não há avaliações
- JUDULDocumento8 páginasJUDULSalty SaltAinda não há avaliações
- Eter & EpoksidaDocumento12 páginasEter & EpoksidaIlham Surya AbadiAinda não há avaliações
- Optimasi Proses Konversi Acetylene Menjadi EtilenaDocumento2 páginasOptimasi Proses Konversi Acetylene Menjadi EtilenaAgus TriaAinda não há avaliações
- AKRILONITRIL DAN POLIMERDocumento5 páginasAKRILONITRIL DAN POLIMERRatna Paramitha SariAinda não há avaliações
- AminasiDocumento11 páginasAminasiDiaahLestiaNingrumAinda não há avaliações
- Soal Sintesis Organik Anorganik 1C-TKI 2016Documento24 páginasSoal Sintesis Organik Anorganik 1C-TKI 2016Anti100% (1)
- OPTIMASI KEBERADAAN FASA DALAM SISTEM SEDERHANADocumento52 páginasOPTIMASI KEBERADAAN FASA DALAM SISTEM SEDERHANAZul FikarAinda não há avaliações
- Korosi Kolom DistilasiDocumento6 páginasKorosi Kolom DistilasiImmanuel AgapaoAinda não há avaliações
- Kimia Fisika Satuan Studi 2Documento53 páginasKimia Fisika Satuan Studi 2Ezra SilalahiAinda não há avaliações
- ASAM NITRATDocumento23 páginasASAM NITRATMuhamad Fahmi Dermawan EndonesyAinda não há avaliações
- Pembuatan TawasDocumento9 páginasPembuatan TawaslonelynightskyAinda não há avaliações
- ASETILEN DARI KARBIDADocumento27 páginasASETILEN DARI KARBIDAAsnurul IsroqmiAinda não há avaliações
- OPTIMASI REAKSI KESETIMBANGANDocumento5 páginasOPTIMASI REAKSI KESETIMBANGANTazqia Jamil PratamiAinda não há avaliações
- Gas Ideal dan Gas NyataDocumento2 páginasGas Ideal dan Gas NyataWidya BestariAinda não há avaliações
- Lembar Kerja Siswa ReaksiDocumento9 páginasLembar Kerja Siswa ReaksiPriskilla RuthAinda não há avaliações
- Katalis AsamDocumento2 páginasKatalis AsamIca Hardiyanti HardiyantiAinda não há avaliações
- Rangkuman Materi LipidDocumento6 páginasRangkuman Materi LipidEpriella PuteriAinda não há avaliações
- Modul Kesetimbangan KimiaDocumento6 páginasModul Kesetimbangan KimiaArif FazlulHaq100% (1)
- Introduction OrganoDocumento12 páginasIntroduction OrganoimprasAinda não há avaliações
- OPTIMASI PROSES PEMBUATAN AMONIADocumento38 páginasOPTIMASI PROSES PEMBUATAN AMONIAYulia Nurul Ma'rifahAinda não há avaliações
- PANAS PEMBAKARAN STANDARDocumento8 páginasPANAS PEMBAKARAN STANDARSri Darmayanti100% (1)
- Silabus Minyak BumiDocumento9 páginasSilabus Minyak BumiIdea Prasidha LaelannaharAinda não há avaliações
- PROPANOL SEBAGAI BAHAN BAKARDocumento1 páginaPROPANOL SEBAGAI BAHAN BAKARVeny Veronika PurbaAinda não há avaliações
- Kesetimbangan Fasa pada Larutan IdealDocumento5 páginasKesetimbangan Fasa pada Larutan IdealshadshadsAinda não há avaliações
- Makalah Industri Proses Pembuatan Amonia Oleh PT Pusri Dan Pembuatan Ertas Oleh PT TelDocumento23 páginasMakalah Industri Proses Pembuatan Amonia Oleh PT Pusri Dan Pembuatan Ertas Oleh PT TelErza NggaraAinda não há avaliações
- Proses Kimia IndustriDocumento4 páginasProses Kimia IndustriYuliantoAinda não há avaliações
- Binary LiquidDocumento51 páginasBinary LiquidRio SanjayaAinda não há avaliações
- PROSES PENGOLAHANDocumento22 páginasPROSES PENGOLAHANSahrul RamadanaAinda não há avaliações
- AsetonDocumento2 páginasAsetonZahra AuliaAinda não há avaliações
- Hidrokarbon Aromatik Poliinti, Kel 6Documento32 páginasHidrokarbon Aromatik Poliinti, Kel 6Rahmadina BrodieAinda não há avaliações
- Etanol Banyak ManfaatDocumento3 páginasEtanol Banyak ManfaatYopaLim ZansTra AritonangAinda não há avaliações
- Industri Pembuatan AmoniaDocumento5 páginasIndustri Pembuatan AmoniaAnggiet HerdayantiAinda não há avaliações
- AMONIADocumento25 páginasAMONIAyazidAinda não há avaliações
- Tugas Pik-1 4 Ardian Fauzi Nh3Documento7 páginasTugas Pik-1 4 Ardian Fauzi Nh3Ardian FauziAinda não há avaliações
- Pembuatan Amonia Dengan Proses Haber BoschDocumento5 páginasPembuatan Amonia Dengan Proses Haber BoschJecky MarantikaAinda não há avaliações
- Nabi Daud AsDocumento1 páginaNabi Daud AsIlham Surya AbadiAinda não há avaliações
- Daftar Isi (Oke)Documento2 páginasDaftar Isi (Oke)Ilham Surya AbadiAinda não há avaliações
- Soda ApiDocumento16 páginasSoda ApiIlham Surya AbadiAinda não há avaliações
- Reaksi Polimerisasi KondensasiDocumento7 páginasReaksi Polimerisasi KondensasiIlham Surya AbadiAinda não há avaliações
- Iupac Polimer Termoplastik Polietilena Polipropilena: Polivinil Klorida (Documento1 páginaIupac Polimer Termoplastik Polietilena Polipropilena: Polivinil Klorida (Ilham Surya AbadiAinda não há avaliações
- Polimer: Sejarah dan Konsep DasarDocumento33 páginasPolimer: Sejarah dan Konsep DasarIlham Surya AbadiAinda não há avaliações
- Lipid Dan DetergenDocumento14 páginasLipid Dan DetergenIlham Surya AbadiAinda não há avaliações
- Iupac Polimer Termoplastik Polietilena Polipropilena: Polivinil Klorida (Documento1 páginaIupac Polimer Termoplastik Polietilena Polipropilena: Polivinil Klorida (Ilham Surya AbadiAinda não há avaliações
- Pembuatan UreaDocumento12 páginasPembuatan Ureailham_surya93Ainda não há avaliações
- Eter & EpoksidaDocumento12 páginasEter & EpoksidaIlham Surya AbadiAinda não há avaliações
- Asam SulfatDocumento13 páginasAsam SulfatIlham Surya Abadi0% (1)
- Asam Nukleat dan StrukturnyaDocumento20 páginasAsam Nukleat dan StrukturnyaIlham Surya AbadiAinda não há avaliações
- PolyethyleneDocumento15 páginasPolyethyleneIlham Surya AbadiAinda não há avaliações
- Hukum Termodinamika I Sistem Tertutup Dan PenerapannyaDocumento22 páginasHukum Termodinamika I Sistem Tertutup Dan PenerapannyaIlham Surya AbadiAinda não há avaliações
- ReaktorDocumento14 páginasReaktorIlham Surya AbadiAinda não há avaliações
- ALAT OPTIKDocumento1 páginaALAT OPTIKIlham Surya Abadi100% (1)
- FiltrasiDocumento13 páginasFiltrasiIlham Surya AbadiAinda não há avaliações
- Makalah Size Reduction FixDocumento16 páginasMakalah Size Reduction FixNanang Budianto100% (1)