Escolar Documentos
Profissional Documentos
Cultura Documentos
Ciclo Del Cobre
Enviado por
Dani SantoyoDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ciclo Del Cobre
Enviado por
Dani SantoyoDireitos autorais:
Formatos disponíveis
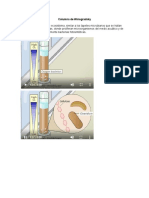
CICLO DEL COBRE
______________________________________________________________
Cristian Javier Lpez Mora; Daniela Santoyo Alemn
Universidad del Quindo
Facultad de Ciencias Bsicas y Tecnologas
Programa de Qumica
Resumen
En esta prctica de laboratorio se realiz el ciclo del cobre, sometiendo ste a las diferentes reacciones que
presenta y se observaron las caractersticas de cada una de ellas. Estas reacciones son de xido-reduccin,
deshidratacin y sustitucin. El cobre forma compuestos en sus dos estados de oxidacin, en este caso se trabaj
Cu +2 e
de
, la oxidacin del cobre con HNO 3 hace que los tomos de cobre metlico
Cu
2+
(ac)
0
(s)
2+
Cu , el cobre libera dos electrones, formndose el
reduccin del
N O3 2(ac)
Cu
con
Zn(s)
N O 3 2(ac)
Cu
, aqu el Zn reduce el catin
(Cu0) , se oxide a
que presenta una coloracin azul. La
2+
Cu a cobre slido
Cu(s )
2+
Cu(ac
, el Zn
)+ 2 e
es un buen dador de electrones por lo que le puede ceder fcilmente los electrones a los cationes
causando la formacin del cobre solido
2+
Cu ,
Cu 0(s ) . Al inicio de la prctica la lmina de cobre pes 69.5 mg y al
final se obtuvieron 60.3 mg de cobre con un rendimiento del 86 %.
Palabras clave: Cobre, xido-reduccin, estado de oxidacin, rendimiento.
Introduccin
El cobre es un metal tenaz, suave y dctil de color
rojizo, siendo sus conductividades elctrica y
calorfica solamente inferiores a las de la plata. Es
atacado por los halgenos, pero no es afectado por
cidos no oxidantes o no complejantes en ausencia
de aire.
El cobre reacciona fcilmente en
los cidos ntrico y sulfrico, en presencia del
oxgeno.
Los compuestos de cobre (I) son incoloros o
blancos, porque el ion tiene una configuracin
electrnica d10.Es decir, con un conjunto de orbitales
d llenos, no puede haber transiciones de electrones d
que causen absorcin de luz visible. El cobre no
1
se oxida fcilmente debido a que poseen un
potencial de reduccin positivo (+0.34V)
El objetivo de esta prctica es conocer
detalladamente el ciclo del cobre sometindolo a sus
reacciones caractersticas y despus de ellas
recuperar la misma cantidad de cobre inicial, lo
ideal es que el porcentaje de rendimiento del cobre
sea alto despus de ser sometido a las anteriores
reacciones.
Metodologa
Se tom una lmina de cobre de peso desconocido y
se coloc en un beaker de 50 mL, luego se
adicionaron unas gotas de cido ntrico concentrado,
esta reaccin es completa, exotrmica, hubo cambio de
color a azul y gases de color caf . Se enfri la solucin
y se adicionaron unas gotas de hidrxido de sodio
al 20% hasta que precipit completamente, no hubo
cambio de color y hubo liberacin de vapor blanco . Se
calent el slido formado, se obtuvo cambio de color
de azul a marrn oscuro, luego se transfiri el slido a
un tubo de ensayo y despus se centrifug el slido
formado y posteriormente se realizaron varios
lavados. Enseguida se
transfiri el slido
nuevamente al beaker y se adicionaron unas gotas
de cido sulfrico concentrado hasta que se disolvi
el slido en su totalidad, esta reaccin fue violenta,
exotrmica, efervescente y con un cambio de color azul
(color inicial). Luego se adicionaron pequeas
cantidades de zinc metlico en polvo, se continu
este proceso hasta desaparicin completa de su efecto,
con lo cual precipit el cobre. Se adicionaron unas
gotas de cido clorhdrico concentrado para
eliminar el exceso de zinc metlico. Posteriormente
se realiz un filtrado al vaco, lavado y secado del
cobre y por ltimo se pes el cobre para el clculo
del porcentaje de rendimiento de la reaccin.
Su peso fue de 60,3 mg y el peso terico era de 69,5
mg.
Rend=
Peso experimental
x 100
Peso terico
Rend=
60,3 mg
x 100 = 86%
69,5 mg
Resultados y discusin
Al agregar cido sulfrico a la lmina de cobre no hubo
ninguna reaccin, su reaccin oxido-reduccin:
Cu+ H 2 SO 4 CuSO 4 + H 2
El cido sulfrico no reacciona con el cobre, porque el
cobre tiene que estar una temperatura alta, por lo tanto
no hubo una reaccin espontnea, ya que esta es una
reaccin endotrmica, para que sea exotrmica necesita
presencia de oxgeno.
Al agregar cido clorhdrico al cobre no hubo ninguna
reaccin, esto lo explica el potencial de xido-reduccin,
las semireacciones sern:
2H+(ac) + 2e- H2 (g) E= 0
Cu (s) Cu+2 + 2 e- E= 0.34 V
E = 0 - 0.34 = - 0.34
El cobre tiene carga + por lo tanto no reacciona con los
H+. Una reaccin se da espontanea cuando su G < 0
G = - n.F.E
Por lo tanto, como G < 0, E tiene que ser mayor que
0.
Para el Cu E = 0 - (0.34) = -0.34 < 0 G > 0,
entonces la reaccin entre el cobre y cido clorhdrico
no es espontnea, ya que el H+ del cido reacciona con
metales que tengan un potencial menor a l.
Al adicionar HNO3 a la lmina de cobre ocurre una
oxidacin de sta pasando de Cu0 (estado
fundamental) a Cu2+, el color verde aguamarina,
corresponde al Cu(NO3)2, y el azul se presenta
2
debido a la presencia de iones Cu2+ en agua, y gases
de color caf al liberarse NO2, la reaccin fue:
N O3
2
Cu
Cu(s )+ 4 HN O 3(ac)
Se debe a que al reaccionar el cido ntrico y el cobre se
produce nitrato de cobre (II) (Cu(NO 3)2), agua y dixido
de nitrgeno (NO2), siendo este el gas que se liber.
Sin embargo el gas que al principio es liberado es el
incoloro y ligeramente txico (NO), pero al
contacto con el O2 del aire rpidamente se oxida a
NO2 que es de color marrn rojizo o naranja. El
anterior proceso responde a la reaccin:
Cu ( OH )2(s) Cu O(s )+ H 2 O
Posteriormente se transfiri el precipitado (CuO) y se
lav con agua destilada. Luego de lavar y centrifugar se
adicion gotas de cido sulfrico (H2SO4) concentrado,
se present una reaccin de sustitucin, formndose una
disolucin de CuSO4 y H2O, esta reaccin fue violenta,
exotrmica, efervescente y con un cambio de color azul
(color inicial), dicha reaccin fue:
CuO( s) + H 2 SO 4 ( ac ) Cu SO 4 ( ac )+ H 2 O(l)
La adicin de zinc metlico en polvo de manera
controlada (para evitar un exceso) promueve la
reduccin del cobre. La reaccin es:
Cu SO 4 ( ac )+ Zn( s) Cu (s )+ Zn SO 4 (ac )
2 N O(g) +O2 N O2
Posteriormente se precipit el cobre (Cu) en forma
de Cu(OH)2 usando NaOH, esto lo evidencia la
formacin del precipitado el cual se da por una
reaccin de doble sustitucin en la que el hidroxilo
del NaOH y el ion nitrato del Cu(NO3)2 se
intercambian.
Este proceso sigue la reaccin:
N O3
Cu
En esta reaccin se present liberacin de vapor blanco
al obtenerse hidrxido cprico Cu(OH)2 y nitrato de
sodio 2NaNO3, posteriormente se llev a calentamiento,
a baja temperatura, alrededor de cinco minutos, se
percibi un cambio de color de azul a marrn oscuro y
ocurri una reaccin de descomposicin, en la cual el
Cu(OH)2, se descompuso en CuO y agua, el proceso se
representa en la siguiente reaccin de descomposicin y
deshidratacin:
La reaccin ocurrida corresponde a una reduccin
del cobre, el cual pasa del estado de oxidacin +2 a
un estado neutro, volviendo de esta manera a su
condicin inicial. Igualmente tambin se presenta
una oxidacin del zinc, pasando de un estado
neutro a un estado de oxidacin +2. [4]
Al adicionar el zinc se observ que el color azul
empieza a disminuir ya que el CuSO 4 es remplazado
por ZnSO4 (ac), tambin se observ un burbujeo
correspondiente al hidrgeno del cido sulfrico
que es desplazado por el zinc.
Para la reduccin del cobre se pueden utilizar otros
metales pero se prefiere el zinc debido a que
algunos metales pueden desplazar el hidrgeno de
un cido o del agua, pero stos no lo hacen en la
misma proporcin, por esta razn las tablas ordenan
los metales de acuerdo a su actividad para realizar
esto, se dice que todos aquellos metales que se
encuentren ms arriba del hidrgeno en la tabla,
podrn desplazar los hidrgenos pero los otros no.
El magnesio est ms arriba del zinc pero se tiene
preferencia por el cinc ya que el magnesio es
3
extremadamente inflamable en especial si se
encuentra en polvo; al entrar en contacto con el aire
y algo de calor o con cidos, reacciona rpidamente
produciendo hidrogeno, por lo que hay que tener
precaucin al momento de su manipulacin.
Debido a que se observ un exceso de zinc al
terminar la reduccin del cobre, para eliminar el
zinc en exceso se adicion cido clorhdrico
concentrado el cual ataca al hidrgeno al zinc y no
al cobre dado que el zinc (Zn) es un metal ms reactivo
que el cobre (Cu), desprende hidrogeno (H 2) de los
cidos diluidos, lo que lo hace reaccionar con mayor
espontaneidad con el cido clorhdrico (HCl), mientras
el cobre no es atacado por cidos no oxidantes.
reacciones fuertes y aun as ser recuperado casi
en su totalidad, ya que ste posee una baja
reactividad, lo cual ayuda a ser uno de los
metales ms fciles de encontrar en estado puro
en la naturaleza.
El zinc es el mejor elemento metlico para
realizar la reduccin del cobre, ya que colabora
en la extraccin pura del Cu, gracias a su bajo
gasto de energa y su reactividad adecuada.
Los compuestos ms estables de cobre son
aquellos en los que este metal tiene el
estado de oxidacin +2.
La mayora de las reacciones son
reacciones de desplazamiento en el cual ya
sea un cido o una base interviene en el
proceso.
2 HCl (ac)+ Zn(s) ZnC l 2(ac)+ H 2(g )
El peso que se obtuvo experimentalmente fue de
60,3 mg, y el peso real de la lmina de cobre era de
69,5 mg. El porcentaje rendimiento fue del 86 %,
lo que indica que el cobre no se recuper en su
totalidad, esto se debe al tiempo de prctica y al tiempo
de reaccin del zinc, pues este ltimo es muy
prolongado, con lo que su reaccin para recuperar el Cu
no se complet, disminuyendo as la masa total
obtenida del compuesto de inters.
Bibliografa
Cotton A., Wilkinson G., Qumica Inorgnica
Avanzada, 4a ed. LIMUSA, 1985. p. 963-965,
p. 978-986.
Catherine E. H. y Alan G. S, Prentice Hall, (2005).
Seese W., Daub W., Qumica, 8a ed. Pearson
Educacin, 2005.
Petrucci R.H., Harwood W.S., Herring F.G.,
Qumica General, 8a ed. Prentice Hall, 2007.
Conclusiones
El ciclo del cobre, permite observar la manera
en que este metal puede ser sometido a
Você também pode gostar
- Informe - Práctica Ciclo Del CobreDocumento7 páginasInforme - Práctica Ciclo Del CobreJazmin Arellano0% (1)
- Práctica 6Documento6 páginasPráctica 6Salomé JácomeAinda não há avaliações
- Reporte de Practica 3 Quimica Del CobreDocumento9 páginasReporte de Practica 3 Quimica Del CobreBrandon Etian Barrera ArredondoAinda não há avaliações
- Practica 3 OrganicaDocumento8 páginasPractica 3 OrganicaQuique RosasAinda não há avaliações
- Cuestionario-Experiencia 5. Quimica ActualDocumento3 páginasCuestionario-Experiencia 5. Quimica ActualJhonier Jesús Ruiz PèrezAinda não há avaliações
- Acidos Duros y BlandosDocumento2 páginasAcidos Duros y BlandosLyn Portilla GarciaAinda não há avaliações
- Práctica #6 Estudio Estequiométrico de Una ReacciónDocumento19 páginasPráctica #6 Estudio Estequiométrico de Una ReacciónMariana GarcíaAinda não há avaliações
- Celdas GalvánicasDocumento10 páginasCeldas GalvánicasRobert RocaAinda não há avaliações
- Recristalización de Alumbre y Sal de CocinaDocumento7 páginasRecristalización de Alumbre y Sal de CocinaMaryin QuimbayaAinda não há avaliações
- Acido BenzoicoDocumento5 páginasAcido BenzoicoWR SalasAinda não há avaliações
- Sodio y ZincDocumento10 páginasSodio y ZincmartinAinda não há avaliações
- CuestionarioDocumento2 páginasCuestionarioJhonatan QuiñonezAinda não há avaliações
- Crecimiento de Cristales en GelesDocumento6 páginasCrecimiento de Cristales en GelesMadelyn Garrido VillarrealAinda não há avaliações
- Experimento 5Documento3 páginasExperimento 5Matamoros De La Cruz JorgeAinda não há avaliações
- Determinacion e Una FormulaDocumento10 páginasDeterminacion e Una Formulathais4romero4sAinda não há avaliações
- PracticaDocumento3 páginasPracticanadiarh0% (1)
- Practica 3 Oxidación-ReducciónDocumento8 páginasPractica 3 Oxidación-ReducciónEdu SmekeAinda não há avaliações
- Practica #4 Metodo de JobDocumento11 páginasPractica #4 Metodo de JobSERGIO ARMANDO BLANCO MERCADOAinda não há avaliações
- +hno Cu (NO) + No + H ODocumento3 páginas+hno Cu (NO) + No + H OC'Denisse PalominoAinda não há avaliações
- Informe No 6 Grupo 3aDocumento17 páginasInforme No 6 Grupo 3aIvan PilaresAinda não há avaliações
- Informe Oxido ReduccionDocumento8 páginasInforme Oxido ReduccionYeison Caicedo100% (1)
- Lab 4 Complejo de Pentaaminclorocobalto IIIDocumento4 páginasLab 4 Complejo de Pentaaminclorocobalto IIIDaniel Arturo Caballero SanchezAinda não há avaliações
- Reporte Fuerzas Intermoleculares2Documento14 páginasReporte Fuerzas Intermoleculares2Juana CruzAinda não há avaliações
- GravimetriaDocumento6 páginasGravimetriaSalvador Nicosia GironAinda não há avaliações
- PRACTICA #10 BalanceDocumento14 páginasPRACTICA #10 BalanceRosely Savin Atencio VilcaranaAinda não há avaliações
- Preinforme-Practica 6 Volumetria Acido BaseDocumento9 páginasPreinforme-Practica 6 Volumetria Acido Basejairo guerreroAinda não há avaliações
- Laboratorio 4Documento20 páginasLaboratorio 4Lizeth Mamani GutierrezAinda não há avaliações
- Inorganica 2, Practica 4Documento3 páginasInorganica 2, Practica 4samantaAinda não há avaliações
- Grupo 1. Prac. 9 Síntesis de Tris Oxalato de Cromato (III) Potasio OkDocumento5 páginasGrupo 1. Prac. 9 Síntesis de Tris Oxalato de Cromato (III) Potasio OkGerardoAntonioDiazAcuñaAinda não há avaliações
- Reporte Practica 5 Quimica Inorganica FQDocumento1 páginaReporte Practica 5 Quimica Inorganica FQEmiliano Dominguéz100% (1)
- Práctica 2 QO2Documento14 páginasPráctica 2 QO2Enrique DelgadoAinda não há avaliações
- Informe-De-Laboratorio-10 Sal de Mohr - Galarza Jenniffer y Reyes DayanneDocumento6 páginasInforme-De-Laboratorio-10 Sal de Mohr - Galarza Jenniffer y Reyes DayanneJenniffer Melissa GalarzaAinda não há avaliações
- Aislamiento de Un Ingrediente Activo en Una Droga AnalgésicoDocumento8 páginasAislamiento de Un Ingrediente Activo en Una Droga AnalgésicoJorge ContrerasAinda não há avaliações
- Examen Preliminar P - CLOROANILINADocumento4 páginasExamen Preliminar P - CLOROANILINAAlejandra ZeaAinda não há avaliações
- ComplejosCo3 PDFDocumento6 páginasComplejosCo3 PDFNadia WilsonAinda não há avaliações
- Pre Informe Inorganica #5Documento3 páginasPre Informe Inorganica #5Victor AristizabalAinda não há avaliações
- Sales Poco SolublesDocumento23 páginasSales Poco SolublesJoel Paredes0% (1)
- SZXNKJBKBKBDocumento3 páginasSZXNKJBKBKBGiovanny TorresAinda não há avaliações
- Obtención y Propiedades de Hidrogeno y Oxigeno Ino 1Documento2 páginasObtención y Propiedades de Hidrogeno y Oxigeno Ino 1joelAinda não há avaliações
- Práctica 9 Comportamiento de Metales Con AcidosDocumento6 páginasPráctica 9 Comportamiento de Metales Con AcidosNeeder Jhonatan TorrezAinda não há avaliações
- Ácidos CarboxílicosDocumento6 páginasÁcidos CarboxílicosAmadaAinda não há avaliações
- 27 Sintesis FerrofluidoDocumento6 páginas27 Sintesis FerrofluidoJuan David Benitez MonroyAinda não há avaliações
- Laboratorio 2 QuimicaDocumento15 páginasLaboratorio 2 QuimicaCesar CastilloAinda não há avaliações
- Practica #5 Cationes Grupo 2Documento2 páginasPractica #5 Cationes Grupo 2Quimica GonzalezAinda não há avaliações
- Estudio Del Comportamiento Químico de Los Elementos Boro y AluminioDocumento10 páginasEstudio Del Comportamiento Químico de Los Elementos Boro y AluminioJorge RosalesAinda não há avaliações
- Practico 2 - Reacciones Con Carbaniones - 2016Documento2 páginasPractico 2 - Reacciones Con Carbaniones - 2016YulenyAinda não há avaliações
- 2 EjercicioDocumento19 páginas2 EjercicioJosé MiguelAinda não há avaliações
- Formato Informe Síntesis de (Co (NH3) 6) Cl3 G - 12Documento4 páginasFormato Informe Síntesis de (Co (NH3) 6) Cl3 G - 12Danii100% (1)
- Informe 7 InorganicaDocumento13 páginasInforme 7 InorganicaYeniz Yanez Pantoja0% (1)
- Informe 5Documento4 páginasInforme 5LEIDY CORDERO PÉREZAinda não há avaliações
- 2.21 Cálculos EstequiometricosDocumento4 páginas2.21 Cálculos EstequiometricosDaniel QuirozAinda não há avaliações
- Oxidacion y ReduccionDocumento17 páginasOxidacion y ReduccionAngel SanchezAinda não há avaliações
- Definición de UsanovichDocumento3 páginasDefinición de UsanovichJohnGonzalezAinda não há avaliações
- 1414-T Proyecto Estudio Comparativo para Síntesis Del YBa2Cu3O7-xDocumento5 páginas1414-T Proyecto Estudio Comparativo para Síntesis Del YBa2Cu3O7-xJonathan Saviñon de los SantosAinda não há avaliações
- Informe de Laboratorio N6 Gurpo 8Documento3 páginasInforme de Laboratorio N6 Gurpo 8jaime perezAinda não há avaliações
- La Enseñanza Del Principio de Le Chatelier Braun en Química GeneralDocumento4 páginasLa Enseñanza Del Principio de Le Chatelier Braun en Química GeneralAlexaRamirezRodriguezAinda não há avaliações
- Antecedentes Alcoholes PrimariosDocumento5 páginasAntecedentes Alcoholes PrimariosHumberto Flores LealAinda não há avaliações
- Informe de Laboratorio 8Documento7 páginasInforme de Laboratorio 8Steven Chacon vargas100% (1)
- 5.determinacaion Del Porcentaje de Hidratacion de Un CompuestoDocumento4 páginas5.determinacaion Del Porcentaje de Hidratacion de Un CompuestoEdwin ValdesAinda não há avaliações
- Ciclo Del Cobre TerminadoDocumento7 páginasCiclo Del Cobre TerminadoJose Julián LópezAinda não há avaliações
- Actividad Programa de Limpieza y Desinfección en El Laboratorio de Análisis de Alimentos 1Documento2 páginasActividad Programa de Limpieza y Desinfección en El Laboratorio de Análisis de Alimentos 1Dani SantoyoAinda não há avaliações
- Formato Informe Peligros QuimicosDocumento4 páginasFormato Informe Peligros QuimicosDani SantoyoAinda não há avaliações
- Estudio de Caso 4Documento5 páginasEstudio de Caso 4Dani SantoyoAinda não há avaliações
- Uso de Los Microorganismos en La Minería y Biorremediación PDFDocumento29 páginasUso de Los Microorganismos en La Minería y Biorremediación PDFDani SantoyoAinda não há avaliações
- Taller Sobre Soluciones y ColoidesDocumento4 páginasTaller Sobre Soluciones y ColoidesDani SantoyoAinda não há avaliações
- Informe 7 Preparación de 3-CarbetoxicumarinaDocumento11 páginasInforme 7 Preparación de 3-CarbetoxicumarinaDani SantoyoAinda não há avaliações
- Informe 5 Preparacion de 2-FenilindolDocumento11 páginasInforme 5 Preparacion de 2-FenilindolDani SantoyoAinda não há avaliações
- Informe 6 Preparación de Ácido O-AcetilsalicílicoDocumento11 páginasInforme 6 Preparación de Ácido O-AcetilsalicílicoDani SantoyoAinda não há avaliações
- Práctica 4 Extracción de AlcaloidesDocumento8 páginasPráctica 4 Extracción de AlcaloidesDani SantoyoAinda não há avaliações
- Informe 5 Acidimetria 1 Parte PDFDocumento10 páginasInforme 5 Acidimetria 1 Parte PDFDani SantoyoAinda não há avaliações
- Informe 8 y 9 Permanganimetria y DicromatometriaDocumento8 páginasInforme 8 y 9 Permanganimetria y DicromatometriaDani SantoyoAinda não há avaliações
- Informe 6 Volumetria de PrecipitaciónDocumento8 páginasInforme 6 Volumetria de PrecipitaciónDani Santoyo100% (1)
- Informe 5, Propiedades de Los Aldehidos y CetonasDocumento8 páginasInforme 5, Propiedades de Los Aldehidos y CetonasDani SantoyoAinda não há avaliações
- Informe 4 Fotorreducción de BenzofenonaDocumento11 páginasInforme 4 Fotorreducción de BenzofenonaDani SantoyoAinda não há avaliações
- Informe 6, Obtención de BenzoxiquinaDocumento4 páginasInforme 6, Obtención de BenzoxiquinaDani SantoyoAinda não há avaliações
- Sintesis de N-ButiraldehidoDocumento3 páginasSintesis de N-ButiraldehidoDani SantoyoAinda não há avaliações
- Relación Entre Ecosistema y CulturaDocumento3 páginasRelación Entre Ecosistema y CulturaDani Santoyo50% (2)
- Transferencia de Calor Fundamentos MD 1-BDocumento26 páginasTransferencia de Calor Fundamentos MD 1-Banon_981457838Ainda não há avaliações
- LubricantesDocumento8 páginasLubricantesAlex Gustavo Toledo RodríguezAinda não há avaliações
- Untitled 3Documento80 páginasUntitled 3mauricio cánepaAinda não há avaliações
- 6°quimicaDocumento3 páginas6°quimicaOdair PradaAinda não há avaliações
- D. GeneralDocumento38 páginasD. GeneralEnmanuel YépezAinda não há avaliações
- Ficha Tecnica de Barras. 2021Documento7 páginasFicha Tecnica de Barras. 2021jherryAinda não há avaliações
- Notas de Bioquímica - Capitulo VI Enzimas - Prof - Dr. Jorge A Leyva RDocumento25 páginasNotas de Bioquímica - Capitulo VI Enzimas - Prof - Dr. Jorge A Leyva RDavid YepezAinda não há avaliações
- Factores Que Influyen en El Crecimiento yDocumento8 páginasFactores Que Influyen en El Crecimiento yAnthony BaltazarAinda não há avaliações
- Determinacion de Zinc en Una Muestra de Pila SecaDocumento13 páginasDeterminacion de Zinc en Una Muestra de Pila SecaJohann Albert Arroyo RojasAinda não há avaliações
- Trabajo de PbeDocumento8 páginasTrabajo de PbeCRISTIAN SIERRAAinda não há avaliações
- Introduccion Al Metabolismo Tema 12Documento5 páginasIntroduccion Al Metabolismo Tema 12Oriana Lopez100% (1)
- Informe MetalografíaDocumento10 páginasInforme MetalografíaNicolas MontoyaAinda não há avaliações
- Alcohol IsopropílicoDocumento3 páginasAlcohol Isopropílicofreshmarket andinoAinda não há avaliações
- Fórmula Púrpura ReseñaDocumento2 páginasFórmula Púrpura ReseñaMarian AyalaAinda não há avaliações
- Toda Estabilidad - En.esDocumento20 páginasToda Estabilidad - En.esBad Gal Riri BrunoAinda não há avaliações
- AST Instalación Bomba SumergibleDocumento13 páginasAST Instalación Bomba SumergibleAna Milena RojasAinda não há avaliações
- Columna de WinogradskyDocumento6 páginasColumna de WinogradskyNataliaAinda não há avaliações
- 2.5 Principios de Funcionamiento Del ConductímetroDocumento2 páginas2.5 Principios de Funcionamiento Del ConductímetroDiana RidderAinda não há avaliações
- S 4 Q1210 (10-1)Documento9 páginasS 4 Q1210 (10-1)los sabiosAinda não há avaliações
- 56-FDS Limpiador TigreDocumento7 páginas56-FDS Limpiador TigreconsorciomariselasAinda não há avaliações
- Guía de Laboratorio AMCDocumento24 páginasGuía de Laboratorio AMCGeraldine MargaretAinda não há avaliações
- Experimento 2 Quimica (Ebullicion)Documento7 páginasExperimento 2 Quimica (Ebullicion)Yurem Adjamir RojasAinda não há avaliações
- Taller Not BioDocumento7 páginasTaller Not BioLaila DomínguezAinda não há avaliações
- 1 Tecnología Enzimática - GeneralidadesDocumento22 páginas1 Tecnología Enzimática - GeneralidadesEduardo Paredes CheroAinda não há avaliações
- Simulacro Primer Parcial Con Respuestas PDFDocumento7 páginasSimulacro Primer Parcial Con Respuestas PDFBryanCoelloAinda não há avaliações
- Quimica QuânticaDocumento31 páginasQuimica QuânticaPedro RosárioAinda não há avaliações
- ChupeteDocumento5 páginasChupeteJosue Marcelo Sucso ZavalagaAinda não há avaliações
- BASE Curso Elemental de Diseno de Tuberias Industriales Volumen 2Documento294 páginasBASE Curso Elemental de Diseno de Tuberias Industriales Volumen 2Adiel Bernal VelásquezAinda não há avaliações
- Alt Baosr6x0710Documento9 páginasAlt Baosr6x0710AdrianaManouAinda não há avaliações
- Uso de Análisis Multivariado en La Determinación SARA de Crudos Por Espectroscopia NIRDocumento9 páginasUso de Análisis Multivariado en La Determinación SARA de Crudos Por Espectroscopia NIRronneypaulAinda não há avaliações