Escolar Documentos
Profissional Documentos
Cultura Documentos
Laboratorio 2
Enviado por
manu_amigo09Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Laboratorio 2
Enviado por
manu_amigo09Direitos autorais:
Formatos disponíveis
LABORATORIO DE QUMICA
UNMSM
I. RESUMEN
En el desarrollo de la prctica numero 3, determinaremos los tipos de enlaces presentes en las sustancias, que son responsables en gran medida de las propiedades fsicas y qumicas de las mismas. Estos enlaces qumicos son tambin responsables de la atraccin que ejerce una sustancia sobre otra. Los tres principales tipos de enlaces que veremos en la prctica sern: el inico, el covalente y el metlico. Determinaremos cul de estos enlaces, por medio de la conductividad elctrica, posee cada uno de los reactivos. Para poder observar las caractersticas en cada caso, empezaremos llenando agua potable en un vaso de precipitado hasta sus dos terceras partes y lo introduciremos en el equipo de conductividad elctrica. Repetiremos el paso anterior pero esta vez con agua destilada, compararemos estos resultados y si el foco enciende ser enlace metlico o inico, de lo contrario ser covalente. Luego disolveremos NaCl en el vaso de agua destilada y lo llevaremos al equipo de conductividad. Por ltimo introduciremos cada uno de los reactivos al equipo de conductividad elctrica y llevaremos todos los datos obtenidos en la tabla de datos y resultados, donde anotaremos el solvente, solubilidad, conductividad y el tipo de enlace.
Prctica N0 3
Pgina 1
LABORATORIO DE QUMICA
UNMSM
II. INTRODUCCIN
En esta prctica determinaremos los diferentes tipos de enlaces de algunas sustancias, lo cual determinamos por medio de la conductividad elctrica, en el estado en que se encuentre. Tambin determinaremos la relacin entre la solubilidad y polaridad de las sustancias con respecto a un solvente determinado. Estableceremos los diferencias entre los enlaces inicos, covalentes y metlicos, que se podrn apreciar al llevar cada uno de los reactivos al equipo de conductividad elctrica. En esta prctica observaremos que los enlaces covalentes y inicos nos darn un brillo de iluminacin en el foco que en algunos casos de los reactivos ser muy intensa y en otros casos ser muy bajo. Todos los datos obtenidos en con cada reactivo sern anotados en una tabla y con esto organizaremos mejor cada uno de los datos de nuestra practica.
Prctica N0 3
Pgina 2
LABORATORIO DE QUMICA
UNMSM
III. PRINCIPIOS TEORICOS
Estos enlaces qumicos son fuerzas intramoleculares, que mantienen a los tomos unidos en las molculas. En la visin simplista del enlace localizado, el nmero de electrones que participan en un enlace (o estn localizados en un orbital enlazante), es tpicamente un nmero par de dos, cuatro, o seis, respectivamente. Los nmeros pares son comunes porque las molculas suelen tener estados energticos ms bajos si los electrones estn apareados. Teoras de enlace sustancialmente ms avanzadas han mostrado que la fuerza de enlace no es siempre un nmero entero, dependiendo de la distribucin de los electrones a cada tomo involucrado en un enlace. Por ejemplo, los tomos de carbono en el benceno estn conectados a los vecinos inmediatos con una fuerza aproximada de 1.5, y los dos tomos en el xido ntrico, NO, estn conectados con aproximadamente 2.5. El enlace cudruple tambin son bien conocidos. El tipo de enlace fuerte depende de la diferencia en electronegatividad y la distribucin de los orbitales electrnicos disponible
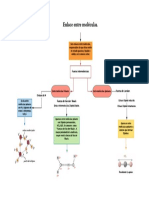
A. ENLACE COVALENTE
Los enlaces covalentes pueden ser simples cuando se comparte un solo par de electrones, dobles al compartir dos pares de electrones, triples cuando comparten tres pares de electrones, o cudruples cuando comparten cuatro pares de electrones. Los enlaces covalentes no polares se forman entre tomos iguales, no hay variacin en el nmero de oxidacin. Los enlaces covalentes polares se forman con tomos distintos con gran diferencia de electronegatividades. La molcula es elctricamente neutra, pero no existe simetra entre las cargas elctricas originando la polaridad, un extremo se caracteriza por ser electropositivo y el otro electronegativo. En otras palabras, el enlace covalente es la unin entre tomos en donde se da un compartimiento de electrones, los tomos que forman este tipo de enlace son de carcter no metlico. Las molculas que se forman con tomos iguales (mononucleares) presentan un enlace covalente pero en donde la diferencia de electronegatividades es nula. Se presenta entre los elementos con poca diferencia de electronegatividad (< 1.9), es decir cercanos en la tabla peridica de los elementos qumicos o bien, entre el mismo elemento para formar moleculas diatomicas.
B. ENLACE INICO O ELECTROVALENTE
El enlace inico es un tipo de interaccin electrosttica entre tomos que tienen una gran diferencia de electronegatividad. No hay un valor preciso que distinga la ionicidad a partir de la diferencia de electronegatividad, pero una diferencia
Prctica N0 3 Pgina 3
LABORATORIO DE QUMICA
UNMSM
sobre 2.0 suele ser inica, y una diferencia menor a 1.5 suele ser covalente. En palabras ms sencillas, un enlace inico es aquel en el que los elementos involucrados aceptan o pierden electrones (se da entre un catin y un anin) o dicho de otra forma, es aquel en el que un elemento ms electronegativo atrae a los electrones de otro menos electronegativo.3 El enlace inico implica la separacin en iones positivos y negativos. Las cargas inicas suelen estar entre -3e a +3e. 1) Se presenta entre los elementos con gran diferencia de electronegatividad (>1.7), es decir alejados de la tabla peridica: entre metales y no metales. 2) Los compuestos que se forman son slidos cristalinos con puntos de fusin elevados. 3) Se da por TRANSFERENCIA de electrones: un tomo PIERDE y el otro 'GANA'. 4) Se forman iones (cationes y aniones).
C. ENLACE METLICO
En un enlace metlico, los electrones de enlace estn deslocalizados en una estructura de tomos. En contraste, en los compuestos inicos, la ubicacin de los electrones enlazantes y sus cargas es esttica. Debido a la deslocalizacin o el libre movimiento de los electrones, se tienen las propiedades metlicas de conductividad, ductilidad y dureza.
D. CONDUCTIVIDAD ELCTRICA
La conductividad elctrica es una medida de la capacidad de un material de dejar pasar la corriente elctrica, su aptitud para dejar circular libremente las cargas elctricas. La conductividad depende de la estructura atmica y molecular del material, los metales son buenos conductores porque tienen una estructura con muchos electrones con vnculos dbiles y esto permite su movimiento. La conductividad tambin depende de otros factores fsicos del propio material y de la temperatura
E. SOLUBILIDAD
La solubilidad es una medida de la capacidad de disolverse una determinada sustancia (soluto) en un determinado medio (solvente); implcitamente se corresponde con la mxima cantidad de soluto disuelto en una dada cantidad de solvente a una temperatura fija y en dicho caso se establece que la solucin est saturada. Su concentracin puede expresarse en moles por litro, en gramos por litro, o tambin en porcentaje de soluto (m(g)/100 mL) . El mtodo preferido para hacer que el soluto se disuelva en esta clase de soluciones es calentar la muestra y enfriar hasta temperatura ambiente (normalmente 25 C). En algunas condiciones la solubilidad se puede sobrepasar de ese mximo y pasan a denominarse como 'soluciones sobresaturadas'
Prctica N0 3
Pgina 4
LABORATORIO DE QUMICA
UNMSM
IV.
DETALLES EXPERIMENTALES
A. MATERIALES
Vaso de 100 ml Equipo de conductividad elctrica Pinzas aislantes Foco de 60 w bagueta
B. REACTIVOS H2O potable H2O destilada NaCl y solucin 0.1 M CuSO4 y solucin 0.1 M NaOH 0.1 M NH3 0.1 M NH4Cl 0.1 M CH3COOH 0.1 M HSO 0.1 M Sacarosa Aceite Cu (lamina) C (grafito)
Prctica N0 3
Pgina 5
LABORATORIO DE QUMICA
UNMSM
C. PROCEDIMIENTOS EXPERIMENTALES
1. Revisamos que todos los materiales estn en ptimas condiciones para desarrollar sin inconvenientes los experimentos. 2. Proceder con la limpieza de los materiales usando la escobilla, detergente y agua destilada 3. Tambin, con agua destilada, limpiar y secar los electrodos del equipo de conductibilidad elctrica luego de cada uso. 4. Verter agua potable hasta los 2/3 partes del vaso de precipitado.
5. Conectar el equipo de conductibilidad elctrica, posteriormente colocaremos el vaso de precipitado en contacto con los electrodos para determinar el tipo de enlace y la conductibilidad elctrica.
6. Repetir la experiencia anterior, pero ahora usando el agua destilada. 7. Luego al agua destilada le agregamos la sacarosa y lo disolvemos con la bagueta, demorndose 1 minuto y 15 segundos en disolverse.
Prctica N0 3
Pgina 6
LABORATORIO DE QUMICA
UNMSM
8. Limpiamos los materiales y volvemos a llenar el vaso de precipitado con agua destilada, pero ahora le agregamos cloruro de potasio (KCl) disolvindose en 21 segundos. 9. A partir de aqu ya no usaremos el vaso de precipitado debido a que los compuestos se encuentran en sus respectivos frascos.
Muestras H2O potable H2O destilada NaCl CuSO4 NaOH NH4Cl CH3COOH(dil) H2SO4(dil) sacarosa aceite Cu(lamina) C(grafito) KCl HCl NH4Cl bencina
Solvente agua x agua agua agua agua agua agua H2O destilada x x x H2O agua agua x
Solubilidad Conductividad Intensidad Tipo de Enlace completa si media ionico x no covalente completa si alta ionico completa si alta ionico completa si alta ionico completa si alta ionico completa si baja ionico completa si alta ionico completa x x x completa completa completa x no no si si si si si no covalente covalente metalico media alta muy baja ionico ionico ionico covalente
Prctica N0 3
Pgina 7
LABORATORIO DE QUMICA
UNMSM
V. ANALISIS Y DISCUSIN DE RESULTADOS
Finalizado el experimento, y luego de haber tomado todo los datos de este, comparamos resultados de los siguientes reactivos. Se observa que, tanto parael agua destilada, sacarosa, aceite, y la bencina no conducen la corriente elctrica. Los enlaces inicos de los reactivos conducen la corriente elctrica.
VI.
CONCLUSIONES
El agua destilada, es tratada para quitar esas impurezas o sales y minerales, haciendo que ya no conduzca la electricidad. La sacarosa, forma entre sus elementos, enlaces covalentes, que no poseen la capacidad de disociarse en agua, es decir, no son electrolitos, y por ende, no conducen la corriente elctrica El aceite es una molcula neutra, es decir que no tiene carga y no se disocia en iones por lo tanto no permite el flujo de electrones, Las molculas formadas con enlaces ionicos, al disolverse en el agua estos enlaces se rompen y se disocian en el agua formando lo que se conoce como iones, siempre uno de carga negativa y otro de carga positiva. Estos iones son los que conducen la electricidad al estar disueltos en el agua, y es simple. La electricidad es un flujo continuo de electrones, estos electrones usan los iones disueltos en el agua como medio de transporte para viajar y as se produce la conduccin elctrica.
Prctica N0 3
Pgina 8
LABORATORIO DE QUMICA
UNMSM
VII.
RECOMENDACIONES
Para obtener buenos resultados, luego de cada prueba debemos lavar y secar bien el equipo de conductividad elctrica. Usar guantes para el manejo de las muestras, debido a cuestiones de seguridad.
VIII.
WEBGRAFIA
Prctica N0 3
Pgina 9
LABORATORIO DE QUMICA
UNMSM
IX.
APENDICE
A. GRAFICOS
1. BAGUETA
2. VASO DE PRECIPITADO
3. FOCO 60W
Prctica N0 3
Pgina 10
LABORATORIO DE QUMICA
UNMSM
4. EQUIPO DE CONDUCTIVIDAD ELECTRICA
5. PINZAS AISLANTES
Prctica N0 3
Pgina 11
LABORATORIO DE QUMICA
UNMSM
B. CUESTIONARIO
1. Cmo puede determinar experimentalmente si una sustancia forma o no una solucin electroltica? 2. Cules de las sustancias con las que ha trabajado en esta prctica, son slidos inicos? 3. Distinga entre electrolitos y no electrolitos 4. Cules de las sustancias usadas en la experiencia de enlace qumico son electrolitos y cuales son no electrolitos? 5. Por qu algunas de las sustancias trabajadas en esta prctica no conducen bien la electricidad? Cules son estas sustancias? 6. Por qu el carbn vegetal no conduce la corriente elctrica? DESARROLLO 1. Para determina experimentalmente la formacin de una solucin electroltica, llevamos la solucin a un equipo de conductividad electrica, si el foco acoplado a este se enciende entonces se comprobara que la solucin es electroltica. 2. NaCl ,
3. Un electrolito o electrlito es cualquier sustancia que contiene iones libres, los que se comportan como un medio conductor elctrico. Debido a que generalmente consisten de iones en solucin, los electrlitos tambin son conocidos como soluciones inicas, pero tambin son posibles electrolitos fundidos y electrolitos slidos. Son sustancias que cuando se disuelven en agua se separan en sus molculas: las molculas tienen movilidad por estar en disolucin acuosa pero son elctricamente neutras (no tienen carga).Estos lquidos y disoluciones tienen partculas con movilidad pero sin carga; por lo tanto, no son conductores de electricidad.
Prctica N0 3
Pgina 12
LABORATORIO DE QUMICA
UNMSM
4. Electrolitos H2O potable NaCl CuSO4 NaOH NH4Cl CH3COOH H2SO4 Cu (lamina) C (grafito) KCl HCl NH4Cl
No Electrolitos -H2O destilado -aceite -sacarosa -bencina
5. Como ya explicamos anteriormente, aquellas sustancias no electrolticas no conducen la corriente, debido que no contienen iones libres. Las sustancias que son no electrolticas ya las presentamos en la pregunta anterior. 6. El grafito conduce la corriente elctrica ya que en sus enlaces interatmicos existen cargas libres en desplazamiento que son los electrones, ya que tienen enlaces de orbitales tipo sp2 donde queda un electrn desapareado. Sin embargo en el carbono C4 que es la sustancia simple, todos los electrones estn ocupando enlaces por lo que no hay cargas libres en movimiento y por eso ante la accin de un campo elctrico no se conduce la corriente elctrica. Que est formado por carbono no significa que tenga que conducir la corriente elctrica. El nico criterio para ello es que existan cargas libres en movimiento, que nicamente pueden ser electrones o iones.
Prctica N0 3
Pgina 13
Você também pode gostar
- Practica n4 Fisico QuimicaDocumento10 páginasPractica n4 Fisico Quimicayepsy jaimesAinda não há avaliações
- Mapa Conceptual, Enlace Intermolecular PDFDocumento1 páginaMapa Conceptual, Enlace Intermolecular PDFJoel SánchezAinda não há avaliações
- Ejercicio 2 Práctica de Laboratorio Segunda Ley de Newton Material Del Curso FISG1001 Virtual ESPOLDocumento1 páginaEjercicio 2 Práctica de Laboratorio Segunda Ley de Newton Material Del Curso FISG1001 Virtual ESPOLJenniffer AstudilloAinda não há avaliações
- Reconocimiento de La Formación de Compuestos Con Enlaces Covalente CoordinadoDocumento3 páginasReconocimiento de La Formación de Compuestos Con Enlaces Covalente CoordinadoCamilo ArenasAinda não há avaliações
- Pre Informe Lab 3Documento7 páginasPre Informe Lab 3Andres RubioAinda não há avaliações
- Movimiento Armonico SimpleDocumento13 páginasMovimiento Armonico SimpleYimi Wilfredo Gutierrez MamaniAinda não há avaliações
- Informe 6 Destilacion SimpleDocumento5 páginasInforme 6 Destilacion SimpleAngie Celeny GarzonAinda não há avaliações
- Taller Grupo 13Documento1 páginaTaller Grupo 13crysaniaAinda não há avaliações
- Preinforme OrganicaDocumento5 páginasPreinforme OrganicaWILLIAM ANDRES OVALLE VILLARRAGAAinda não há avaliações
- Reacciones químicas laboratorioDocumento9 páginasReacciones químicas laboratorioDIANA LEYVA HERNANDEZAinda não há avaliações
- B HidrocarburosDocumento19 páginasB Hidrocarburossaulcarvajal23Ainda não há avaliações
- Prueba de Caracterizacion de Compuestos OrganicosDocumento8 páginasPrueba de Caracterizacion de Compuestos Organicosalicia erazoAinda não há avaliações
- Práctica de Laboratorio 7 - Equlibrio Químico FinalDocumento18 páginasPráctica de Laboratorio 7 - Equlibrio Químico FinalSebastián José Tantalean SarmientoAinda não há avaliações
- COMPARACIONDocumento1 páginaCOMPARACIONDiego Fidelli LopezAinda não há avaliações
- Práctica 2. Fuerzas Intermoleculares - Formación Reversible de Un Gel de PVA-boraxDocumento7 páginasPráctica 2. Fuerzas Intermoleculares - Formación Reversible de Un Gel de PVA-boraxanon_756227509Ainda não há avaliações
- EnviarDocumento16 páginasEnviaresneider linares romeroAinda não há avaliações
- El Modelo VSEPRDocumento15 páginasEl Modelo VSEPRandreaAinda não há avaliações
- Laboratorio Pendulo BalisticoDocumento4 páginasLaboratorio Pendulo BalisticoValen Paredes100% (1)
- Grupo 6 - Práctica de Laboratorio 3Documento17 páginasGrupo 6 - Práctica de Laboratorio 3Adriana Vasquez Utani100% (1)
- Informe 2Documento16 páginasInforme 2xiomi mazaAinda não há avaliações
- Informe 8Documento8 páginasInforme 8RojasJosuesAinda não há avaliações
- Laboratorio Leyes Combinacion de GasesDocumento3 páginasLaboratorio Leyes Combinacion de GasesMaicol FlorezAinda não há avaliações
- 03 Números Reales DiapositivasDocumento52 páginas03 Números Reales DiapositivasRicardo EmilioAinda não há avaliações
- Criterio asintótico y raíz para convergencia de seriesDocumento2 páginasCriterio asintótico y raíz para convergencia de seriesLuis CampuzanoAinda não há avaliações
- Lab Quimica 5 Enlace QuímicojijoDocumento7 páginasLab Quimica 5 Enlace QuímicojijoEmmanuel SernaAinda não há avaliações
- Problemas Termodinamica 26 de Mayo-2-6Documento5 páginasProblemas Termodinamica 26 de Mayo-2-6Luciana BernalAinda não há avaliações
- Laboratorio #8 - Fisicoquímica IiDocumento13 páginasLaboratorio #8 - Fisicoquímica IiGUIDO YEREMY BELIZARIO COILAAinda não há avaliações
- Laboratorio 5 Separacion de MezclaDocumento15 páginasLaboratorio 5 Separacion de MezclaMarioValdes100% (1)
- Actividad ÓpticaDocumento3 páginasActividad ÓpticaArky Glez100% (1)
- PREPARACIÓN DE HCL 0.1 N Y DE NaOH 0.1 NDocumento7 páginasPREPARACIÓN DE HCL 0.1 N Y DE NaOH 0.1 NGuadalupe FloresAinda não há avaliações
- Electroestática básicaDocumento10 páginasElectroestática básicaAnime Viral KawaiAinda não há avaliações
- Informe EstereoquímicaDocumento5 páginasInforme EstereoquímicaValentina Rodriguez SuarezAinda não há avaliações
- Experiencia 4 Superficies EquipotencialesDocumento10 páginasExperiencia 4 Superficies EquipotencialesJesus MendozaAinda não há avaliações
- MruaDocumento2 páginasMruaYeco CasarrubiaAinda não há avaliações
- PRACTICA 3 - Caida Libre PDFDocumento19 páginasPRACTICA 3 - Caida Libre PDFvanesaAinda não há avaliações
- Guias Laboratorio Diana JaimesDocumento16 páginasGuias Laboratorio Diana JaimesMaritza Urrea GonzalezAinda não há avaliações
- Practica Campo ElectricoDocumento13 páginasPractica Campo Electricojuan manuelAinda não há avaliações
- Informe DinamicaDocumento12 páginasInforme DinamicaCristian Giovanny Gomez ReyesAinda não há avaliações
- Laboratorio No 1. Mediciones Directas e IndirectasDocumento16 páginasLaboratorio No 1. Mediciones Directas e IndirectasAura JaramilloAinda não há avaliações
- Unidad 5. Termodinámica, Fuerzas Intermoleculares, Gases y Estados de Agregación de La MateriaDocumento24 páginasUnidad 5. Termodinámica, Fuerzas Intermoleculares, Gases y Estados de Agregación de La MateriaMARIA NATHALIA CAMPO BUENOAinda não há avaliações
- Informe 5Documento5 páginasInforme 5TATIANA ROJAS CAROAinda não há avaliações
- VECTORES Guia LAB de Fisica MecanicaDocumento7 páginasVECTORES Guia LAB de Fisica MecanicaJuan FelipeAinda não há avaliações
- MemoriaDocumento13 páginasMemorialucia de lucasAinda não há avaliações
- Química Inorgánica Examen 2 corte G2 - 26 de abril de 2021Documento1 páginaQuímica Inorgánica Examen 2 corte G2 - 26 de abril de 2021Valentina Suarez RodriguezAinda não há avaliações
- Practica 5Documento3 páginasPractica 5Anderson100% (1)
- TAREA #01 (FC) Fisica CEDocumento1 páginaTAREA #01 (FC) Fisica CELuis BarnettAinda não há avaliações
- TALLER #3 B Reactivo Limite y Reactivo en ExcesoDocumento6 páginasTALLER #3 B Reactivo Limite y Reactivo en ExcesoAlejandra ArandiaAinda não há avaliações
- Relacion Grafica Entre VariablesDocumento7 páginasRelacion Grafica Entre VariablesEwin Edwin AsipAinda não há avaliações
- Informe Lab 2 PreDocumento4 páginasInforme Lab 2 Prejean romeroAinda não há avaliações
- Análisis Gráfico de DatosDocumento11 páginasAnálisis Gráfico de DatosNelcy MiramagAinda não há avaliações
- Padilla Azaña QuimicaDocumento8 páginasPadilla Azaña QuimicaYosman Padilla azaña100% (1)
- Laboratorio de Calor Específico-1Documento6 páginasLaboratorio de Calor Específico-1cristian leonardo porrasAinda não há avaliações
- Actividades Con Simuladores 2019Documento4 páginasActividades Con Simuladores 2019Diego Cruz D100% (1)
- Propiedades y reacciones de los alquinosDocumento28 páginasPropiedades y reacciones de los alquinosirvelandiaro33% (3)
- Informe Laboratorio 2Documento7 páginasInforme Laboratorio 2Dömë IñiguezAinda não há avaliações
- Movimiento Descrito en Coordenadas PolaresDocumento12 páginasMovimiento Descrito en Coordenadas PolaresAyni Cordova HuaytaraAinda não há avaliações
- Practica Laboratorio EnlacesDocumento15 páginasPractica Laboratorio EnlacesNancy GonzalesAinda não há avaliações
- Conductividad ElecDocumento14 páginasConductividad ElecMilagros Acuña FarfanAinda não há avaliações
- Informe 5 de Quimica - Enlace QuimicoDocumento13 páginasInforme 5 de Quimica - Enlace Quimicojudith churaAinda não há avaliações
- Concreto Armado 1Documento38 páginasConcreto Armado 1Pamela YupanqAinda não há avaliações
- Diagnostico de Cables de Alta TensionDocumento6 páginasDiagnostico de Cables de Alta TensionHenry Segundo Ramos ArévaloAinda não há avaliações
- Sistemas EstructuralesDocumento9 páginasSistemas EstructuralesDaniel MartinezAinda não há avaliações
- Ensayo de CementoDocumento16 páginasEnsayo de CementoVeronica CabreraAinda não há avaliações
- ADPT Universidad control calidadDocumento5 páginasADPT Universidad control calidadDavid AguirreAinda não há avaliações
- Transduccion VisualDocumento14 páginasTransduccion VisualErika Llanos Mora50% (2)
- Grupo Electrogeno de 170 KWDocumento2 páginasGrupo Electrogeno de 170 KWWilian CastroAinda não há avaliações
- Catalogo DanfossDocumento14 páginasCatalogo DanfossHeller AriasAinda não há avaliações
- Secadora Girbau ED460Documento5 páginasSecadora Girbau ED460Byron SuntaxiAinda não há avaliações
- Materiales y EquiposDocumento4 páginasMateriales y EquiposSabely DíazAinda não há avaliações
- MECANICA Mec Fluidos Unidad 1 - 3 Medicion de La PresionDocumento23 páginasMECANICA Mec Fluidos Unidad 1 - 3 Medicion de La PresionHugo González0% (1)
- Clase 6 MeteorologiaDocumento36 páginasClase 6 MeteorologiaDíder Sanchez VillanuevaAinda não há avaliações
- GENERADORES CC - Ing. Efrain de La Cruz PDFDocumento77 páginasGENERADORES CC - Ing. Efrain de La Cruz PDFErnesto DoteroAinda não há avaliações
- Bobinado MotoresDocumento9 páginasBobinado MotoresEdwin MarianoAinda não há avaliações
- Termodinámica - Programa AnalíticoDocumento4 páginasTermodinámica - Programa AnalíticoValeska La GloriosaAinda não há avaliações
- Protocolo de Uso Tpms Doran 21.06.2018vg0 Fcv.2 FinalDocumento6 páginasProtocolo de Uso Tpms Doran 21.06.2018vg0 Fcv.2 FinalIngenieriaAinda não há avaliações
- Superficies de RiemannDocumento9 páginasSuperficies de RiemanndianaAinda não há avaliações
- 8 Hidrostatica1Documento4 páginas8 Hidrostatica1Estefany GomezAinda não há avaliações
- Informe 8 La Determinación de La Densidad Del Suelo en El TerrenoDocumento8 páginasInforme 8 La Determinación de La Densidad Del Suelo en El TerrenoJaviOrellanaBarroso100% (1)
- Ajuste DuplexoresDocumento11 páginasAjuste DuplexoresLuis RangelAinda não há avaliações
- 08 Medrano 2013 Diagnostico Sistema Geodesico NicaraguaDocumento12 páginas08 Medrano 2013 Diagnostico Sistema Geodesico NicaraguaJavier ContrerasAinda não há avaliações
- Metodo de Elementos Finitos-TrDocumento33 páginasMetodo de Elementos Finitos-TrRoberto DavisAinda não há avaliações
- Concentración o Procesamiento MetalúrgicoDocumento1 páginaConcentración o Procesamiento MetalúrgicoJulianArticaAinda não há avaliações
- Métodos de medición de temperatura optimizados paraDocumento31 páginasMétodos de medición de temperatura optimizados paraTomas Garcia MirandaAinda não há avaliações
- Introducción Concepto de FuncionDocumento20 páginasIntroducción Concepto de Funcionkristes92Ainda não há avaliações
- Ciclo de La UreaDocumento5 páginasCiclo de La UreaMartinezHuertaMaryAinda não há avaliações
- Fundamentos de Ingenieria GeotecnicaDocumento601 páginasFundamentos de Ingenieria Geotecnicajosebf4Ainda não há avaliações
- Problemas PropuestosDocumento3 páginasProblemas PropuestosLuigie Hiuguay0% (1)
- Perforacion en Mineria SubterraneaDocumento85 páginasPerforacion en Mineria SubterraneaNestor Tarazona57% (7)