Escolar Documentos
Profissional Documentos
Cultura Documentos
Relatorio de Fisica
Enviado por
Carla S. PaulaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Relatorio de Fisica
Enviado por
Carla S. PaulaDireitos autorais:
Formatos disponíveis
UNIVERSIDADE FEDERAL DO OESTE DO PAR-UFOPA INSTITUTO DE ENGENHARIA E GEOCINCIAS-IEG B.I.
CINCIA E TECNOLOGIA PROFESSOR: RUI OTONI MAGNO Alunos: Carla Paula; Thiago Almada Josiane Jolene Rodrigues Letcia Costa
AULA DE LABORATRIO IV: MEDIDAS DE CALORES DE REAO
Trabalho elaborado no mbito da disciplina de Qumica, para o trabalho laboratorial sobre Medidas de Calores de Reao, sob a orientao do Professor Rui Otoni Magno.
Santarm-P 201
INTRODUO Lei de Hess A Lei de Hess, alm de precursora da termoqumica, um dos seus principais fundamentos, pois dela partiu o Princpio da Conservao da Energia. Por meio dessa descoberta emprica (feita por meio da observao prtica) de Hess, podemos relacionar as equaes qumicas como se fossem equaes algbricas. O que Hess descobriu em suas medies que a troca de entalpia de determinados reagentes passando por uma fase intermediria X e formando produtos a mesma que numa outra reao com os mesmos reagentes passando por uma fase intermediria Y e dando produtos. por isso que as equaes termoqumicas podem ser somadas como as equaes matemticas. Essa descoberta permite-nos determinar a H de reaes que dificilmente podem ter sua troca de calor medida na prtica (por serem muito lentas, incompletas ou explosivas) atravs da H conhecida de outras reaes. A presso constante, a variao de calor associada a uma transformao qumica conhecida como entalpia de reao ( HR) e que por definio, dada como a diferena entre a quantidade de calor do sistema aps a transformao ( HF) e a quantidade de calor inicial ( HI). HR = HI- HF (1)
HI e HF so, s vezes, referenciados como entalpia dos produtos e dos reagentes respectivamente. Uma transformao espontnea ocorra necessariamente e sempre com liberao de energia, que pode se manifestar sob as mais variadas formas. Quando esta transformao absorve energia ela chamada de transformao endotrmica ( HR>0); quando ela libera energia, ela chamada transformao exotrmica ( HR<0). Determinao do calor de reao Na determinao do calor de reao, usaremos um frasco erlenmeyer de 250 mL para servir como um calormetro simples. Consideraremos que o calor de reao ser usado apenas para modificar a temperatura da soluo aquosa e do frasco, desprezando pequenas perdas de calor para o ambiente. A partir das variaes de temperatura e das massas dos reagentes, podemos calcular o nmero de calorias desprendidas ou absorvidas com a seguinte relao: Q=m.c. t (2)
Q = quantidade de calor desprendido ou absorvido; m = massa do corpo; c = calor especfico e t = variao de temperatura. OBJETIVO DO EXPERIMENTO: Conceituar energia e calor de reao; Compreender a relao entre quimica e energia; Familiarizar com as unidades de energia e suas converses; Calcular a quantidade de calor envolvida em uma dissoluo e em uma reao de neutralizao. MATERIAIS UTILIZADOS: 2 erlemeyer de 250 ml cada; Termmetro; Balana analitica; Pipeta graduada de 10ml; Esptula; Vidro de relgio; Cpsula de porcelana; Basto de vidro; Capela; Gominha; Conta gotas; gua destilada; H2SO4 concentrado; KMnO4 slido; PROCEDIMENTOS: 1. VERIFICAO DO PODER ENERGTICO DE UMA REAO Na capela, coloque numa cpsula de porcelana um pouco de permanganato de potssio slido e acrescente algumas gotas de cido sulfrico concentrado (CUIDADO). Com um basto de vidro contendo um chumao de algodo enrolado em sua ponta, toque na mistura da cpsula de porcelana (CUIDADO). O que voc observa? Escreva a equao que representa a reao qumica observada. 2. CALOR DE DISSOLUO DO NaOH slido Em um erlenmeyer de 250mL coloque 100 mL de gua destilada e com o termmetro mea a temperatura e anote. Pese rapidamente 4,0 g de hidrxido de sdio em um vidro de relgio e adicione-o gua no erlenmeyer e agite, cuidadosamente, at dissoluo completa. Mea a temperatura mxima atingida neste processo. A dissoluo endotrmica ou exotrmica? Escreva a equao qumica da dissoluo do NaOH. Calcule a quantidade
de calor envolvida. 3. CALOR DE DISSOLUO DO H2SO4 concentrado Em um erlenmeyer de 250 mL coloque 100 mL de gua destilada e com o termmetro mea a temperatura e anote. Calcule a quantidade de cido sulfrico necessrio para neutralizar 4,0 g de hidrxido de sdio e adicione-o gua no erlenmeyer, cuidadosamente, e mea a temperatura mxima atingida neste processo. A dissoluo endotrmica ou exotrmica? Escreva a equao qumica da dissoluo do H 2SO4. Calcule a quantidade de calor envolvida. 4. CALOR DE NEUTRALIZAO Deixe as solues preparadas no 2o e no 3o passos atingirem a temperatura ambiente. Confira esta temperatura com o termmetro e anote. Deixe o termmetro dentro da soluo de hidrxido de sdio e misture rapidamente a soluo de cido sulfrico com a de hidrxido, medindo a temperatura mxima atingida nesta neutralizao. A reao de neutralizao endotrmica ou exotrmica? Escreva a equao qumica desta neutralizao. Calcule a quantidade de calor envolvida. Dados: d (H2SO4) = 1,840g/cm 3 e pureza = 98% c (H2SO4) = 0,34 cal/g.oC c (NaOH) = 0,94 cal/g.oC PRTICA DOS PROCEDIMENTOS Pegamos o erlemeyer de 250ml, colocar 100ml de gua (calor de dissoluo do hidrxido de sdio) Com o termomtro, inicialmente a 25oC fazemos a leitura da temperatura da gua;temperatura da gua: 24oC Adicionou e 4g de NaOH ( hidrxido de sdio); temperatura 33oC Qual a quantidade de H2SO4 para neutralizar 4g de soluo? soluo 100ml de gua + 4g de NaOH2SO4 (H2SO4)=1,84g/cm3 Adicionar 100ml de gua e 2,6 ml de H2SO4 =45oC Tf. QUESTIONRIO 1. O que energia? 2. Transforme os valores dos calores encontrados em calorias, para Joule. 3. Desenhe um diagrama de energia para a reao de neutralizao. 4. Quando a glicose se combina com O2 , a seguinte reao ocorre:
Calcule quantos gramas de glicose deveriam ser queimados para aquecer 1,00kg de gua de 25,00C para 30,00C (calor especfico = 4,18 J/g.C)? RESOLUO: 1. Apesar de sua enorme presena na vida de todos e de sua importncia como conceito cientfico nas explicaes dos fenmenos naturais, muito difcil expressar por meio de uma definio o que energia. Em fsica existe uma definio: energia a capacidade de realizar trabalho. Mas essa definio no agrada nem mesmo aos fsicos, pelas limitaes que ela tem. Quando vemos uma lmpada iluminando uma sala dizemos que ela est emitindo energia luminosa. difcil imaginar como essa energia luminosa, emitida pela lmpada e que se espalha pela sala, pode ser vista como uma "capacidade de realizar trabalho". Assim, a compreenso do conceito de energia no vem do conhecimento de sua definio, mas sim da percepo de sua presena em todos os processos de transformao que ocorrem em nosso organismo, no ambiente terrestre ou no espao sideral. No mundo macroscpico, das galxias, estrelas e dos sistemas planetrios, ou no microscpico, das clulas, molculas, dos tomos ou das partculas subatmicas. 3.
4. C6H12O6 + 6 O2 --> 6 H2O + 6 CO2 H = -2800 kJ/mol para calcular o calor de formao precisamos de fazer a seguinte conta: H reao = H formao de produtos H formao de reagentes
H reao = (6 X H(H2O) + 6 X H(CO2)) - (1 X H(C6H12O6) + 6 X H(O2))
temos todos os valores menos a entalpia de formao da glicose: H reao = -2800 kJ/ mol de glicose H(H2O) = -268 kJ/mol H(CO2) = -393,5 kJ/mol H(C6H12O6) = ???? ( o que quero saber) H(O2) = zero (entalpia de substncia simples na sua forma alotrpica mais estvel e no estado fsico mais comum) -2800 = (6 X (-268) + 6 X (-393,5)) - (H(C6H12O6) + 6 X 0) H(C6H12O6) = (6 X (-268) + 6 X (-393,5)) + 2800 H(C6H12O6) = ((-1608) + (-2361)) + 2800 H(C6H12O6) = -1169 kJ / mol de glicose Calor (entalpia) de formao da glicose = -1169 kJ / mol
Q=mxcx Q = 1000 x 4,18 x 5 Q = 20900 J ou 20,9 KJ 180g de glicose (1 mol) est para -2820 assim como x gramas de glicose est para 20900 180---- -2820 kJ x --------- -20,9 KJ x= 1,33 g aproximadamente
BIBLIOGRAFIA BRADY, J. & HUMISTON, G. E. Qumica Geral vol 1, Rio de Janeiro, Livros Tcnicos e Cientficos Editora S.A., 1986 BACCAN, N. ANDRADE, J.C., GODINHO, O.E.S. & BARONE, J.S., Qumica Analtica Quantitativa Elementar, Cap.III e VIII, Campinas, Editora Edgard Bicher Uda., 1985, 29 edio, 259p VOGEL, A. Qumica Orgnica. Vol. 1, pag. 136-147, Ao Livro Tcnico SA, Rio de Janeiro
Você também pode gostar
- Batista - Fotoetnografia Como Discurso, Alteridad y ComunicaciónDocumento15 páginasBatista - Fotoetnografia Como Discurso, Alteridad y ComunicaciónAna CandilAinda não há avaliações
- Roland - Barthes - A Camara Clara PDFDocumento42 páginasRoland - Barthes - A Camara Clara PDFLarissa Costa da Mata100% (10)
- Roland - Barthes - A Camara Clara PDFDocumento42 páginasRoland - Barthes - A Camara Clara PDFLarissa Costa da Mata100% (10)
- Disser Ta Cao 06Documento54 páginasDisser Ta Cao 06Carla S. PaulaAinda não há avaliações
- Roteiro Basico para Projeto de PesquisaDocumento10 páginasRoteiro Basico para Projeto de PesquisaflavilioAinda não há avaliações
- 2017 RS 4Documento7 páginas2017 RS 4Carla S. PaulaAinda não há avaliações
- Introdução à EpistemologiaDocumento120 páginasIntrodução à EpistemologiaAndressa NunesAinda não há avaliações
- Livro - Fundamentos de Bioquimica Ricardo VieiraDocumento159 páginasLivro - Fundamentos de Bioquimica Ricardo VieiraPatrícia Fraga97% (35)
- Trabalhos AprovadosDocumento16 páginasTrabalhos AprovadosCarla S. PaulaAinda não há avaliações
- 208 Panorama Da Aquicultura Qualidade de Gua Parte 1Documento7 páginas208 Panorama Da Aquicultura Qualidade de Gua Parte 1Nazur GomesAinda não há avaliações
- Livro - Fundamentos de Bioquimica Ricardo VieiraDocumento159 páginasLivro - Fundamentos de Bioquimica Ricardo VieiraPatrícia Fraga97% (35)
- 208 Panorama Da Aquicultura Qualidade de Gua Parte 1Documento7 páginas208 Panorama Da Aquicultura Qualidade de Gua Parte 1Nazur GomesAinda não há avaliações
- Invertebrados como Bioindicadores AquáticosDocumento12 páginasInvertebrados como Bioindicadores AquáticosFlávio BrandãoAinda não há avaliações
- Check List RV AE 2211Documento5 páginasCheck List RV AE 2211Carla S. PaulaAinda não há avaliações
- Estimativa da emissão de amônia na produção de frangos de corteDocumento56 páginasEstimativa da emissão de amônia na produção de frangos de corteCarla S. PaulaAinda não há avaliações
- Coleta de ResiduosDocumento20 páginasColeta de ResiduosCarla S. PaulaAinda não há avaliações
- NBR 11174 NB 1264 - To de Residuos Classes II - Nao Inertes e III - InertesDocumento7 páginasNBR 11174 NB 1264 - To de Residuos Classes II - Nao Inertes e III - InertesRibeiro Almeida100% (1)
- Artigo - Desenvolvimento Sustentávele ABordagem SistêmicaDocumento36 páginasArtigo - Desenvolvimento Sustentávele ABordagem SistêmicaCarla S. PaulaAinda não há avaliações
- 500 Questões Comentadas de Raciocínio LógicoDocumento14 páginas500 Questões Comentadas de Raciocínio LógicoVagner Cortes80% (10)
- Óleos e GraxasDocumento18 páginasÓleos e GraxasCarla S. PaulaAinda não há avaliações
- 2016 - 1 - Atmosfera e A Poluição Do ArDocumento43 páginas2016 - 1 - Atmosfera e A Poluição Do ArCarla S. PaulaAinda não há avaliações
- Calculo1 Aula01Documento10 páginasCalculo1 Aula01Carla S. PaulaAinda não há avaliações
- Bioindicadores 19.10.2010Documento90 páginasBioindicadores 19.10.2010Carla S. PaulaAinda não há avaliações
- Cálculo Numérico, Aspectos Teóricos e Computacionais - 2 Edição - Márcia A. Gomes Ruggiero e Vera Lúcia Da Rocha LopesDocumento408 páginasCálculo Numérico, Aspectos Teóricos e Computacionais - 2 Edição - Márcia A. Gomes Ruggiero e Vera Lúcia Da Rocha LopesRaposo IreneAinda não há avaliações
- Coletaresiduossolidos PDFDocumento21 páginasColetaresiduossolidos PDFCarla S. PaulaAinda não há avaliações
- Grade de Eng. Automação e Controle Faculdade de Ciencia e Tecnologia de Montes ClarosDocumento3 páginasGrade de Eng. Automação e Controle Faculdade de Ciencia e Tecnologia de Montes ClarosCarla S. PaulaAinda não há avaliações
- A Evolucao Do Conceito de Familia Noronha Maressa Maelly Soares Parron Stenio FerreiraDocumento21 páginasA Evolucao Do Conceito de Familia Noronha Maressa Maelly Soares Parron Stenio FerreiraKaroline Coelho A. Souza100% (2)
- 2 - Conceitos e Tipos de Constituição PDFDocumento6 páginas2 - Conceitos e Tipos de Constituição PDFleoAinda não há avaliações
- 6 - Tecnologias No EnsinoDocumento34 páginas6 - Tecnologias No EnsinoLeonardo SouzaAinda não há avaliações
- Atividade - Que Gênero Sou EuDocumento6 páginasAtividade - Que Gênero Sou EuMakena BorgesAinda não há avaliações
- DIREITO DO CONSUMIDOR E SEUS PRINCÍPIOSDocumento12 páginasDIREITO DO CONSUMIDOR E SEUS PRINCÍPIOSMichell Lopes BarbosaAinda não há avaliações
- Correção - VitinhoDocumento4 páginasCorreção - VitinhoPeter BoweryAinda não há avaliações
- Segunda Voz e TomDocumento5 páginasSegunda Voz e TomSamuel PereiraAinda não há avaliações
- Funções quadráticasDocumento3 páginasFunções quadráticasalmeida.agostinho8406Ainda não há avaliações
- O Senhor Do Seu Nariz - Ficha de LeituraDocumento4 páginasO Senhor Do Seu Nariz - Ficha de LeituraLuísa Ribeiro0% (1)
- Jogo Do TextoDocumento4 páginasJogo Do TextoFellipe Duarte75% (4)
- Revisão2 1ºanoDocumento1 páginaRevisão2 1ºanoJoão LemosAinda não há avaliações
- Modificação Do ComportamentoDocumento6 páginasModificação Do ComportamentoNágila ThaináAinda não há avaliações
- O Sucesso é Ser FelizDocumento2 páginasO Sucesso é Ser FeliznayaradauerAinda não há avaliações
- Gervão-Roxo - Stachytarpheta Jamaicensis (L.) Vahl. - Ervas Medicinais - Ficha Completa IlustradaDocumento9 páginasGervão-Roxo - Stachytarpheta Jamaicensis (L.) Vahl. - Ervas Medicinais - Ficha Completa IlustradaViam prudentiaeAinda não há avaliações
- Analise de Falha Redutor MecanicoDocumento97 páginasAnalise de Falha Redutor MecanicoRamon Borba100% (1)
- TCC - WevertonSouzaCastanho Feedbackversaofinal-14agoDocumento66 páginasTCC - WevertonSouzaCastanho Feedbackversaofinal-14agoWeverton De Souza CastanhoAinda não há avaliações
- Cálculo de limites usando propriedadesDocumento7 páginasCálculo de limites usando propriedadesAbgail PinheiroAinda não há avaliações
- Estratégia OrganizacionalDocumento27 páginasEstratégia OrganizacionalEduardoAinda não há avaliações
- SH Microbiologia e ParasitologiapdfDocumento33 páginasSH Microbiologia e Parasitologiapdfweslley.liimah23Ainda não há avaliações
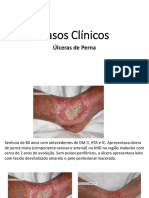
- AULA 15 - Casos Clínicos Úlceras de PernaDocumento24 páginasAULA 15 - Casos Clínicos Úlceras de PernaManuel E NeuzaAinda não há avaliações
- Suporte Básico de VidaDocumento7 páginasSuporte Básico de VidaSusana FigueiredoAinda não há avaliações
- História da Arte e TecnologiaDocumento36 páginasHistória da Arte e TecnologiaLuiz FernandoAinda não há avaliações
- Designer de Sobrancelhas - o Guia DefinitivoDocumento30 páginasDesigner de Sobrancelhas - o Guia DefinitivoJamileMoura100% (1)
- Tabelas de frequência para análise de dadosDocumento4 páginasTabelas de frequência para análise de dadospaulacpgouveiaAinda não há avaliações
- Aula Sergius Gandolfi IBT-Sucessao Ecologica 20151Documento67 páginasAula Sergius Gandolfi IBT-Sucessao Ecologica 20151Caio RenaAinda não há avaliações
- Lógica proposicional exercíciosDocumento126 páginasLógica proposicional exercíciosFrancine SoaresAinda não há avaliações
- Primeiros socorros: avaliação inicialDocumento2 páginasPrimeiros socorros: avaliação inicialMarcos Chinaider100% (1)
- Uma Princesa sem Voz Conquista seu ReinoDocumento714 páginasUma Princesa sem Voz Conquista seu ReinoAline QueirozAinda não há avaliações
- Resumo Cartilha AprendizDocumento17 páginasResumo Cartilha AprendizCarlos Henrique PappenAinda não há avaliações
- Conhecendo Pelo Dia NascimentoDocumento22 páginasConhecendo Pelo Dia NascimentoJoelbsom Martins BarbosaAinda não há avaliações