Escolar Documentos
Profissional Documentos
Cultura Documentos
11 Electrolyse
Enviado por
lilisor_68Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
11 Electrolyse
Enviado por
lilisor_68Direitos autorais:
Formatos disponíveis
TS - Chimie - Chapitre n
Eric DAINI Lyce Paul Czanne Aix en Provence - http://labotp.org
LECTROLYSE D'UNE SOLUTION DE SULFATE DE CUIVRE
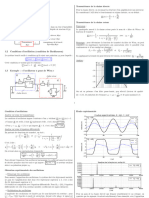
Objectifs: Raliser une lectrolyse et comprendre son fonctionnement. E + I. EXPERIENCE
Dcaper entirement deux lames de cuivre avec du papier verre. Mesurer les masses initiales m1i et m2i des deux lames et relever les
Cu: lame1 Cu: lame 2 valeurs des masses au centime de gramme. Placer les lames dans un bcher de 100 mL comme l'indique le schma ci-contre, et le tout sur un agitateur magntique. Allumer le gnrateur de tension, le rgler 10 V vide, puis l'teindre. Raliser le circuit lectrique ci-contre. 75 mL de solution Ajouter 75 mL d'une solution de sulfate de cuivre 1,0 mol.L-l . de Cu2+ + SO42 1 mol.L-l Mettre en route une agitation modre. Faire vrifier votre montage. Dclencher le chronomtre et allumer le gnrateur. Rgler (avec le bouton de tension) l'intensit I = 1,0 A et maintenir cette valeur pendant t = 15 minutes exactement.
II. TUDE DE L'ELECTROLYSE 1) Quelles sont les espces chimiques prsentes dans le systme chimique lors de l'lectrolyse ? 2) Quels sont les porteurs de charge dans la solution et dans les parties mtalliques ? 3) Indiquer, sur le schma, leur sens de dplacement au cours de l'lectrolyse. 4) A quelle lame correspond l'anode et la cathode ? Indiquer-les sur le schma. 5) Sachant que seul le couple (Cu2+ / Cu ) intervient dans les ractions aux lectrodes, crire les quations de raction l'anode et la cathode, puis l'quation de la raction dlectrolyse. 6) Quelle est la valeur de la constante d'quilibre de la raction ? 7) Que peut-on dire de la concentration en ion Cu2+ au cours de l'lectrolyse ? 8) Comment varie la masse des lectrodes l'anode et la cathode ? 9) Montrer que l'augmentation de masse la cathode est donne par la relation: m(Cu) = I.t.M(Cu) / 2.F. 10) On donne: M(Cu) = 63,5 g.mol-1 et F = 96500 C.mol-1 , calculer m(Cu).
Au bout de 15 min exactement, teindre le gnrateur, retirer les lames, les scher dlicatement et observer. Mesurer la masse des deux lames. Soient m1f et m2f les nouvelles masses.
11) Calculer les variations de masses m1 et m2. Comparer m1 et m2. 12) Comparer m1 avec l'augmentation de masse de la cathode. 13) L'lectrolyse prcdente est appele lectrolyse "anode soluble": justifier cette affirmation. Application industrielle : Ce type d'lectrolyse est utilise dans lindustrie pour purifier du cuivre impur. Dans ce cas, le mtal impur forme les anodes; les cathodes sont des feuilles de cuivre pur alternant avec les anodes; l'lectrolyte est une solution de cuivre II. Les impurets (mtaux : Zn, Co, Ni, Pb ) sont plus oxydables que le cuivre Cu : leurs ions passent en solution. Par contre les mtaux prcieux (Ag, Au Pt, .) ne sont pas oxyds lorsque le cuivre lest : ils restent sur l'anode ou tombent au fond de la cuve lectrolytique (o ils sont rcuprs).. Une raffinerie de cuivre qui produit 600 t de cuivre par jour utilise 1492 cuves lectrolytiques contenant chacune 46 anodes Question bonus: pouvez-vous estimer lpaisseur e de la couche de mtal cuivre forme la cathode ? (On donne : (Cu) = 8,87 g.cm-3).
Você também pode gostar
- Transformations Forcees Electrolyse Exercices Non Corriges 3Documento2 páginasTransformations Forcees Electrolyse Exercices Non Corriges 3Mønsf BøämïrãAinda não há avaliações
- CH 4.2 Affinage Du CuivreDocumento2 páginasCH 4.2 Affinage Du CuivreYoussef CheAinda não há avaliações
- Série Dexercices Corrigés Sur Lélectrolyse 1Documento11 páginasSérie Dexercices Corrigés Sur Lélectrolyse 1chada100% (1)
- Chimie Série 4 FBDocumento10 páginasChimie Série 4 FBZayd Taibi0% (1)
- Serie Electrolyse Transformations ForcéesDocumento6 páginasSerie Electrolyse Transformations ForcéesDaghsni Said100% (4)
- Ex PilesDocumento3 páginasEx PilesHassanEssoufiAinda não há avaliações
- Notion de Couple OxydantDocumento4 páginasNotion de Couple OxydantRoosvelt feujioAinda não há avaliações
- Recueil BODA ELECTRO. PG 2016Documento12 páginasRecueil BODA ELECTRO. PG 2016mycorpbAinda não há avaliações
- Ex12 ElectrolysesDocumento3 páginasEx12 ElectrolysesOuu SsaamaAinda não há avaliações
- Electrolyse NaClDocumento9 páginasElectrolyse NaClImane ARAinda não há avaliações
- TP Chimie PhysiqueDocumento9 páginasTP Chimie PhysiquekhaledrevialAinda não há avaliações
- Exercices 7 Les Piles Et Récupération D'énergieDocumento1 páginaExercices 7 Les Piles Et Récupération D'énergieBouchra 2021Ainda não há avaliações
- Chapitre 7, Transformations Spontanées Dans Les Piles Et Récupération de L'énergie, Activités, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDDocumento3 páginasChapitre 7, Transformations Spontanées Dans Les Piles Et Récupération de L'énergie, Activités, Exercices D'application, 2BAC BIOF, PR JENKAL RACHIDaristide mabialaAinda não há avaliações
- 07 Cinétique de L'oxydo-RéductionDocumento26 páginas07 Cinétique de L'oxydo-RéductionMatis FellahAinda não há avaliações
- Roman Arthur RimbaudDocumento3 páginasRoman Arthur Rimbaudjasmine.rkm13Ainda não há avaliações
- TD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUDocumento5 páginasTD Électrochimie de Chimie Analytique 2eme Année Pharmacie DR DJAOUmoh moh100% (1)
- EXO Notion de Couple OxydantDocumento2 páginasEXO Notion de Couple OxydantPFE100% (1)
- Série Électrolyse PDFDocumento3 páginasSérie Électrolyse PDFBarhoumi Mourad33% (3)
- RapportDocumento7 páginasRapportMed Outaghjijte0% (1)
- Travaux Diriges de La Serie HittorfDocumento1 páginaTravaux Diriges de La Serie HittorfHAMZA ELATIQYAinda não há avaliações
- Série de TD Electrochimie Appliquée M1 Chimie Analytique 2020-2021Documento3 páginasSérie de TD Electrochimie Appliquée M1 Chimie Analytique 2020-2021Samar ZedamAinda não há avaliações
- Solutions TD PDFDocumento24 páginasSolutions TD PDFKIAS DjahidAinda não há avaliações
- Fin ECC - 2021-2022Documento24 páginasFin ECC - 2021-2022ridhaAinda não há avaliações
- Série Les PilesDocumento4 páginasSérie Les Pilesookayokay15Ainda não há avaliações
- Série Transformation Forcée CorrectionDocumento8 páginasSérie Transformation Forcée CorrectionAmine AlaoUii AlaouiAinda não há avaliações
- Exercice 1Documento8 páginasExercice 1Mouhieddine KhailiAinda não há avaliações
- Oxydoréduction PBDocumento12 páginasOxydoréduction PBRajaa BousmaraAinda não há avaliações
- Série Électrolyse EeeeeeeeDocumento3 páginasSérie Électrolyse EeeeeeeeBOURASSAinda não há avaliações
- Pile DaniellDocumento16 páginasPile DaniellYassir IbralAinda não há avaliações
- Série de TD 4 Electrochimie L3 2019 - 2020Documento5 páginasSérie de TD 4 Electrochimie L3 2019 - 2020نور ٱلقمرAinda não há avaliações
- PilesDocumento17 páginasPilesOthmane HassounAinda não há avaliações
- Cours 1 Les Piles Et Récupération D'énergieDocumento6 páginasCours 1 Les Piles Et Récupération D'énergieBOURASSAinda não há avaliações
- PilesDocumento6 páginasPilesJojo BoubAinda não há avaliações
- TD N 2 CHIMIE 1ère CDTIDocumento2 páginasTD N 2 CHIMIE 1ère CDTIANDRE ELOCKAinda não há avaliações
- Chapitre-8-Transformation Forcée L'électrolyseDocumento5 páginasChapitre-8-Transformation Forcée L'électrolysea houssAinda não há avaliações
- Chimie C Chap11 ElectrolyseDocumento5 páginasChimie C Chap11 Electrolysemghaete100% (1)
- Exercices 10 Les Piles Et Récupération D'énergieDocumento1 páginaExercices 10 Les Piles Et Récupération D'énergiemadaniAinda não há avaliações
- Chapitre-7 - Transformations Spontanés Dans Les PilesDocumento7 páginasChapitre-7 - Transformations Spontanés Dans Les Pilesa houssAinda não há avaliações
- Electrolyse Td-ÉnoncéDocumento6 páginasElectrolyse Td-ÉnoncéLandryAinda não há avaliações
- PC 1ère CD-C14 ElectrolyseDocumento7 páginasPC 1ère CD-C14 ElectrolyseAssi MardochéeAinda não há avaliações
- Condensateur Et Oxydo-ReductionDocumento2 páginasCondensateur Et Oxydo-Reductionphilippebernard1205Ainda não há avaliações
- I. Principes de Piles Galvaniques: Demi-PileDocumento15 páginasI. Principes de Piles Galvaniques: Demi-PileMOHAMMED ZOUINIAinda não há avaliações
- Compte Rendu Chimie Des SolutionDocumento12 páginasCompte Rendu Chimie Des Solutionmeriem.bouaouda7102Ainda não há avaliações
- SeÌ Rie 1 - Transformation Spontaneì Es Dans Le Piles (WWW - AdrarPhysic.Fr) 3Documento2 páginasSeÌ Rie 1 - Transformation Spontaneì Es Dans Le Piles (WWW - AdrarPhysic.Fr) 3b01554837Ainda não há avaliações
- Chapitre 2 CorrosionDocumento16 páginasChapitre 2 CorrosionhajjiAinda não há avaliações
- TPN-1 Réalisation Dun Pile Éléctrochimie GPDocumento3 páginasTPN-1 Réalisation Dun Pile Éléctrochimie GPعبدالسلام ارفيس75% (4)
- Cours 5 UE3 - Potentiel Electrochimique 2020Documento21 páginasCours 5 UE3 - Potentiel Electrochimique 2020MDKAinda não há avaliações
- Partie B Accumulateurs Au PlombDocumento11 páginasPartie B Accumulateurs Au PlombNedjm EldinneAinda não há avaliações
- 7 - Transformations Forcées - ÉlectrolyseDocumento3 páginas7 - Transformations Forcées - ÉlectrolysesdoulajAinda não há avaliações
- Réactions Électrochimiques Et Courbes Intensité - Potentiel: I) Definitions Generales I-1 ElectrodeDocumento47 páginasRéactions Électrochimiques Et Courbes Intensité - Potentiel: I) Definitions Generales I-1 ElectrodemugiAinda não há avaliações
- Electro Lys eDocumento4 páginasElectro Lys eالغزيزال الحسن EL GHZIZAL HassaneAinda não há avaliações
- C5 TDDocumento2 páginasC5 TDKld Mnt50% (2)
- 10 ElectrolyseDocumento3 páginas10 ElectrolyseChartier JulienAinda não há avaliações
- ElectrochimieDocumento15 páginasElectrochimieMoustapha SallAinda não há avaliações
- Fiche Sur LélectrolyseDocumento4 páginasFiche Sur LélectrolysechadaAinda não há avaliações
- 2-EXERCICES COTES ELECTROCHIMIE 261107 CompressedDocumento1 página2-EXERCICES COTES ELECTROCHIMIE 261107 CompressedNikiemaAinda não há avaliações
- Etude Générale À La Corrosion TP 3Documento10 páginasEtude Générale À La Corrosion TP 3Chikhaoui67% (3)
- Serie 8 Et 9 Pile Et Dosage RedoxDocumento4 páginasSerie 8 Et 9 Pile Et Dosage RedoxMaguette SeckAinda não há avaliações
- Transformations Spontanees Dans Les Piles Et Production D Energie Activites 1Documento1 páginaTransformations Spontanees Dans Les Piles Et Production D Energie Activites 1tedjuniormomboAinda não há avaliações
- 1TXH000221C0301 Batiments Et InfrastructuresDocumento36 páginas1TXH000221C0301 Batiments Et InfrastructuresMokhtar BeghielAinda não há avaliações
- Choix de TransistorDocumento3 páginasChoix de Transistorahmed hamzaouiAinda não há avaliações
- Calcul CCDocumento2 páginasCalcul CCOus SàmàAinda não há avaliações
- Régulateurs: Installation Et MaintenanceDocumento12 páginasRégulateurs: Installation Et MaintenanceAli Hama Nouroi100% (1)
- G Sur T (Facteur de Mérite)Documento6 páginasG Sur T (Facteur de Mérite)doudzoAinda não há avaliações
- TD TransformaDocumento4 páginasTD TransformaTarhôùni HosnïAinda não há avaliações
- FiltreDocumento9 páginasFiltreKhaola EssihiAinda não há avaliações
- Partie 1 Chapitre 1Documento4 páginasPartie 1 Chapitre 1OUSSAMA BOUSHAKIAinda não há avaliações
- ZELIO - Control Rm4T: TG TUDocumento8 páginasZELIO - Control Rm4T: TG TUJosé Denilson Herrera SalasAinda não há avaliações
- Chap 5 ElectroniqueDocumento25 páginasChap 5 Electroniqueelfarissi jaouadAinda não há avaliações
- Abaque de Smith 3A-InG-MECA (Mode de Compatibilité)Documento17 páginasAbaque de Smith 3A-InG-MECA (Mode de Compatibilité)Firas BedouiAinda não há avaliações
- TDmagnetVF2 PDFDocumento37 páginasTDmagnetVF2 PDFd'ALMEIDAAinda não há avaliações
- Ge24ea022 B FRDocumento12 páginasGe24ea022 B FRStanley ClermontAinda não há avaliações
- Rapport de Stage - OnEP (Information Général 1)Documento42 páginasRapport de Stage - OnEP (Information Général 1)chawki100% (1)
- Ifs110 PDFDocumento8 páginasIfs110 PDFi ccAinda não há avaliações
- Estimation Des Parametres Et Des Etats DDocumento131 páginasEstimation Des Parametres Et Des Etats DGhofrane GhofraneAinda não há avaliações
- Machine À Excitation IndépendantDocumento18 páginasMachine À Excitation IndépendantMhadheb Med AmineAinda não há avaliações
- Sections Documents-Pdagogiques Chapitre-8-Mesure Downloadfile File Les Capteurs - PDF Nocache 1289041293Documento47 páginasSections Documents-Pdagogiques Chapitre-8-Mesure Downloadfile File Les Capteurs - PDF Nocache 1289041293EL Alaoui YoussefAinda não há avaliações
- A) (14 Points) : Exercices (Tirés de L'examen Partiel H00) Problème No. 1 (20 Points)Documento4 páginasA) (14 Points) : Exercices (Tirés de L'examen Partiel H00) Problème No. 1 (20 Points)belilimane180Ainda não há avaliações
- Chapitre 4 - GradateurDocumento30 páginasChapitre 4 - GradateurAbderrahmane Wardi100% (1)
- Devoir de Synthèse N°2 - Sciences Physiques - Bac Informatique (2009-2010) MR Daghsni SahbiDocumento4 páginasDevoir de Synthèse N°2 - Sciences Physiques - Bac Informatique (2009-2010) MR Daghsni SahbiMahmoud Essahbi Sahbi DaghsniAinda não há avaliações
- Cours de Physique 2ndesDocumento23 páginasCours de Physique 2ndestoto TOTOROTOAinda não há avaliações
- TH7972 PDFDocumento168 páginasTH7972 PDFNour AssmaAinda não há avaliações
- Répuplique Algérienne Démocratique PopulaireDocumento4 páginasRépuplique Algérienne Démocratique PopulairesaraAinda não há avaliações
- TP 5 PHOTODIOD CompDocumento10 páginasTP 5 PHOTODIOD CompToukaa Dz0% (2)
- TP11 12 - 2008 2009Documento7 páginasTP11 12 - 2008 2009Edidjo DarwinAinda não há avaliações
- INP Mag TDDocumento25 páginasINP Mag TDHamza NadirAinda não há avaliações
- Presentation Etat D'art Des LimiteursDocumento12 páginasPresentation Etat D'art Des LimiteursechakhaouiAinda não há avaliações
- OscillateursDocumento4 páginasOscillateursSMTIIll100% (1)
- Oscillateurs CoursDocumento4 páginasOscillateurs CoursHaylen SalehAinda não há avaliações