Escolar Documentos
Profissional Documentos
Cultura Documentos
Enlace Químico
Enviado por
Gen OrtegaDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Enlace Químico
Enviado por
Gen OrtegaDireitos autorais:
Formatos disponíveis
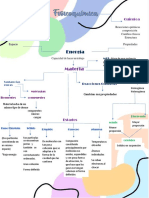
Enlace Qumico Es la fuerza de atraccin que mantiene unido entre s a los tomos o iones para formar molculas o cristales.
Los tipos de enlaces presentes en una sustancia, son responsables en gran medida de sus propiedades fsicas y qumicas. Los enlaces son responsables adems, de la atraccin que ejerce una sustancia sobre otra.
Tipos de Enlaces: Enlace inico (electrovalente): Se establece en tomos con diferencias marcadas en sus electronegatividades y se debe a la interaccin electrosttica entre los iones que pueden formarse por la transferencia de uno o ms electrones de un tomo o grupo atmico a otro. Formando iones positivos y negativos que se atraen entre s por las fuerzas electrostticas, antes mencionadas.
El enlace covalente: Se establece cuando en los tomos no existen diferencias marcadas de electronegatividad. En este caso se comparten uno o ms electrones entre dos tomos.
Los compuestos que tienen enlace predominantemente inico se conocen como compuestos inicos y los que tienen enlaces predominantemente covalentes se conocen como compuestos covalentes, y sus propiedades se rigen por el comportamiento de estos enlaces.
Comparacin entre los compuestos inicos y compuestos covalentes: Compuestos inicos Son slidos con puntos de fusin altos (> 400 C ). Muchos son solubles en disolventes polares como el agua. La mayora son insolubles en disolventes no polares. Los compuestos fundidos conducen bien la Compuestos covalentes Son gases, lquidos o slidos, con puntos de fusin bajos, por lo general < 300 C . Muchos de ellos son insolubles en disolventes polares. La mayora es soluble en disolventes no polares. Los compuestos lquidos o fundidos no
electricidad porque contienen partculas conducen la electricidad. mviles con carga (iones). Las soluciones acuosas conducen bien la Las soluciones acuosas suelen ser malas
electricidad porque contienen partculas conductoras de la electricidad porque no mviles con carga (iones). contienen partculas con carga.
Electronegatividad y polaridad de los enlaces: La electronegatividad es la capacidad que tiene un tomo de dicho elemento para atraer as los electrones (e-), cuando forma parte de un compuesto. Si un tomo tiene una gran tendencia a atraer e- se dice que es muy electronegativo (como los prximos al Flor) y si su tendencia es a perder esos e- se dice que es muy electropositivo (como los alcalinos). Dependiendo de la electronegatividad de los tomos que conforman la unin se presentar una gama de enlaces que va desde los no polares o covalentes puros hasta los muy polares o inicos.
Es as como basados en la electronegatividad de los tomos que se unen se puede determinar el tipo de enlace: El enlace Covalente Puro o No Polar (ECNP): Es un enlace en donde los e- se comparten de manera equitativa. Se presenta en elementos de igual electronegatividad. En este caso los electrones estn igualmente compartidos por los dos tomos. Como ejemplo se encuentran: H2, Cl2, O2, N2, F2 y otras molculas diatmicas. Estas molculas son de carcter no polar; no hay formacin de dipolos.
Enlace Covalente Polar (ECP): Se presenta entre tomos de diferente electronegatividad, el enlace resultante es polar, debido a que los e- pasan ms tiempo en la vecindad de un tomo que del otro. Por ejemplo, el carbono y el oxgeno presentan diferente electronegatividad la cual no es marcada, puesto que ambos son no metales, esto permite que se forme un enlace covalente polar.
Enlace inico: Si la diferencia de electronegatividad es alta el enlace es de tipo inico, donde la transferencia de electrones es casi completa. Como ejemplo se puede mencionar el
enlace entre el carbono y el oxgeno para formar el monxido de carbono. El cloro y el sodio cuando forman cloruro de sodio (NaCl) presentan una diferencia de electronegatividad alta, debido a que uno es un metal (Na) y el otro un no metal (Cl), el enlace que se forma es inico.
Como regla general se plantea que cuando la diferencia de electronegatividad entre los dos tomos es de 2 o ms, el enlace presente tendr un carcter inico (EI). Si la diferencia de electronegatividad entre 2 tomos enlazados es igual a cero (0), ser un enlace covalente puro, apolar o no polar (ECNP), y si la diferencia de electronegatividad es mayor a cero (0) pero menor a dos (2), se considera que ese enlace es un covalente polar (ECP).
La tabla de electronegatividad de Pauling es un auxiliar importante para analizar el tipo de enlace presente en un compuesto. En esta tabla se indica desde el valor de electronegatividad ms alto al ms bajo:
Electrone gatividad 2.1 1.0 0.9 0.8 0.8 0.7 0.7 1.5 1.2 Electrone gatividad 1.5 1.6 1.6 15 1.8 1.9 1.9 1.9 1.6 Electrone gatividad 2.5 1.5 1.6 1.8 3.0 2.1 1.9 3.5 2.5
Elemento Hidrgeno Litio Sodio Potasio Rubidio Cesio Francio Berilio Magnesio
Smbolo H Li Na K Rb Cs Fr Be Mg
Elemento Titanio Vanadio Cromo
Manganeso
Smbolo Ti V Cr Mn Fe Co Ni Cu Zn
Elemento Carbono Aluminio Galio Silicio
Nitrgeno
Smbolo C Al Ga Si N P Pb O S
Hierro Cobalto Nquel Cobre Zinc
Fsforo Plomo Oxgeno Azufre
Elemento Calcio Estroncio Bario Radio Escandio
Smbolo Ca Sr Ba Ra Sc
Electrone gatividad 1.0 1.0 0.9 0.9 1.3
Elemento Plata Oro Cadmio Mercurio Boro
Smbolo Ag Au Cd Hg B
Electrone gatividad 1.9 2.4 1.7 1.9 2.0
Elemento Bismuto Flor Cloro Bromo Yodo
Smbolo Bi F Cl Br I
Electrone gatividad 1.9 4.0 3.0 2.8 2.5
La regla del octeto y la formacin de enlaces: En 1916 W. Kassel y G. Lewis una regla para explicar la formacin de enlaces entre los diferentes tomos. Esta regla es denominada la regla de octeto: cuando se forma un enlace qumico, los tomos adquieren, ceden o comparten electrones, de tal manera que la capa ms externa o de valencia de cada tomo contenga ocho (8) electrones.
Esta regla se fundamenta en el hecho de que todos los gases nobles, excepto el helio (He), tienen en su estructura electrnica 8 electrones en la ltima capa o nivel de energa, lo que les confiere estabilidad qumica (inertes). La tendencia a obtener estructuras
electrnicas semejantes a los gases nobles (8e- en el ltimo nivel) explica en parte el enlace qumico en la mayora de los compuestos.
Estructura de Lewis: Para representar un enlace qumico y las reacciones entre los tomos, G. Lewis estableci la utilizacin de puntos, crculos, el signo x o el signo +, alrededor del elemento, para representar sus electrones de valencia. De esta manera los electrones de la ltima capa o electrones de valencia representados alrededor del smbolo de los elementos se denominan smbolos electrnicos de Lewis.
El cloruro de sodio se representa mediante la estructura de Lewis de la siguiente manera:
Existe una relacin sencilla entre el nmero de electrones de la capa de valencia y la valencia del elemento. La valencia normal del tomo de un elemento tpico es igual al nmero de grupo (Tabla peridica). El par de electrones compartido suele representarse con un guin (-): H-Cl.
Enlace covalente normal: se refiere a aquellos enlaces ya sea simples, dobles o triples donde cada uno de los tomos enlazados aportan un electrn para formar el enlace covalente. Y se representa mediante guiones (-).
Enlace covalente coordinado o dativo: es un enlace covalente donde un solo tomo es el que aporta el par de electrones necesarios para formar el enlace. Suele representarse con una flecha.
Enlace metlico: es el enlace que se forma en los cristales metlicos. En un modelo de un slido metlico se puede visualizar una formacin tridimensional en la cual los iones positivos permanecen fijos en una red cristalina, mientras que los electrones de valencia, dbilmente sujetos, se mueven con libertad por todo el cristal. Este movimiento hace que los cristales sean buenos conductores de calor y electricidad.
Você também pode gostar
- 03 Xat Monoconductor Eat MonoconductorDocumento6 páginas03 Xat Monoconductor Eat MonoconductorPablo AcuñaAinda não há avaliações
- Sylabus Electricidad y Electrónica Industrial 2018-IIDocumento3 páginasSylabus Electricidad y Electrónica Industrial 2018-IIJorge Arias AcevedoAinda não há avaliações
- 1 Monografia SEP 2017 - I Neyra Jara Roberto AlejandroDocumento24 páginas1 Monografia SEP 2017 - I Neyra Jara Roberto AlejandroRoberto Alejandro Neyra JaraAinda não há avaliações
- Conveccion Libre y ForzadaDocumento12 páginasConveccion Libre y ForzadarocioAinda não há avaliações
- Lab N1 de Sis. Circuitos II-Yury Frank Quispe BandaDocumento11 páginasLab N1 de Sis. Circuitos II-Yury Frank Quispe BandaOsarm CHAinda não há avaliações
- FisicoquimicaDocumento3 páginasFisicoquimicaChristian MartinezAinda não há avaliações
- Determinación de coeficientes de fricción en tuberías usando diagrama de MoodyDocumento2 páginasDeterminación de coeficientes de fricción en tuberías usando diagrama de MoodyLuis Axel Zevallos VigoAinda não há avaliações
- Fuerzas Estatica-3Documento67 páginasFuerzas Estatica-3Frëdmäń RämösAinda não há avaliações
- C 09 Cortocircuito PDFDocumento28 páginasC 09 Cortocircuito PDFaugusto paredes taipeAinda não há avaliações
- PRINCIPIOSDocumento11 páginasPRINCIPIOSJESUS BASILIO LEONARDO CCORAHUAAinda não há avaliações
- LA ENERGÍA Ficha de Comprensión LectoraDocumento3 páginasLA ENERGÍA Ficha de Comprensión LectoraJhonnyIpacor0% (1)
- Rueda MaxwellDocumento2 páginasRueda MaxwellEsteban VargasAinda não há avaliações
- Cinetica StevenDocumento3 páginasCinetica StevenClaudia GarciaAinda não há avaliações
- Ley de Gay Lusacc Informe IIDocumento37 páginasLey de Gay Lusacc Informe IIlabrigaana40% (5)
- Manual Operacion Mantto KrebsDocumento99 páginasManual Operacion Mantto KrebsmisaelAinda não há avaliações
- Acetato de SodioDocumento5 páginasAcetato de Sodiowisowor 12Ainda não há avaliações
- Cinemática y dinámica de partículas: Velocidad y aceleraciónDocumento66 páginasCinemática y dinámica de partículas: Velocidad y aceleraciónDAVID ISAIAS ZITLE ARROYOAinda não há avaliações
- Aplicación de Diagonalización de Matrices Simétricas A Física (Silvina Boggi - Facultad de Ingenieria Universidad de Buenos Aires)Documento3 páginasAplicación de Diagonalización de Matrices Simétricas A Física (Silvina Boggi - Facultad de Ingenieria Universidad de Buenos Aires)Daniel CifuentesAinda não há avaliações
- Guia Docente para Laboratorio de Maquinas Ac PDFDocumento27 páginasGuia Docente para Laboratorio de Maquinas Ac PDFricardoAinda não há avaliações
- Veleta Monografia FinalDocumento23 páginasVeleta Monografia FinalFreddy Sucasaire CondoriAinda não há avaliações
- Estado gaseosoDocumento6 páginasEstado gaseosojosetecoAinda não há avaliações
- Diferencias Entre Calor y TemperaturaDocumento4 páginasDiferencias Entre Calor y TemperaturaAndrea campolongoAinda não há avaliações
- Deformaciones en VigasDocumento4 páginasDeformaciones en VigasMaRicruz CornejoAinda não há avaliações
- Mecánica Cuántica-Espectroscopías de Resonancia Magnética IIDocumento26 páginasMecánica Cuántica-Espectroscopías de Resonancia Magnética IIAraujo ThiagoAinda não há avaliações
- Informe de Superficies EquipotencialesDocumento11 páginasInforme de Superficies EquipotencialesAaronCervantesVoorheesBullAinda não há avaliações
- Flujo de fluidos compresibles: Número de Mach y ecuaciones de escurrimiento adiabáticoDocumento5 páginasFlujo de fluidos compresibles: Número de Mach y ecuaciones de escurrimiento adiabáticoGabriela Teresa Góngora ZepitaAinda não há avaliações
- 08 Sensor TPSDocumento13 páginas08 Sensor TPSNatan PzAinda não há avaliações
- Solucion Examen de Entrada2019BDocumento8 páginasSolucion Examen de Entrada2019BPedro LeonelAinda não há avaliações
- Soto Lopez Gitzel M19S2AI4Documento8 páginasSoto Lopez Gitzel M19S2AI4Gitzel Soto0% (1)
- Funcionamiento del motor BediniDocumento74 páginasFuncionamiento del motor BediniLuciano MorenoAinda não há avaliações