Escolar Documentos
Profissional Documentos
Cultura Documentos
Sal
Enviado por
Simony PinheiroTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Sal
Enviado por
Simony PinheiroDireitos autorais:
Formatos disponíveis
Sal
Origem: Wikipdia, a enciclopdia livre. Ir para: navegao, pesquisa Nota: Para outros significados, veja Sal (desambiguao).
Estrutura espacial de um cristal de sal (NaCl).
Cloreto de sdio cobrindo um bquer. Em qumica, um sal um composto inico que em gua se dissocia num ction diferente de H+ e um nion diferente de OH- 1 . Eles so tipicamente o produto de uma reao qumica entre: Uma base e um cido: forma-se um sal e gua. Por exemplo: 2 NaOH + H2SO4 Na2SO4 + 2H2O Um metal e um cido: forma-se um sal e hidrognio. Por exemplo: Mg + H2SO4 MgSO4 + H2 Um xido cido e um xido bsico: forma-se um sal. Por exemplo: CO2 + CaO CaCO3 Os ons que formam os sais podem ser monoatmicos (como o nion fluoreto, F-, ou o ction clcio, Ca2+) ou poliatmicos (como o nion sulfato, SO42-). Podem ainda ser inorgnicos (como o j referido sulfato) ou orgnicos (como o nion acetato, CH3COO ). Em geral, os sais formam cristais. So frequentemente solveis em gua, onde os dois ons se separam. Os sais em geral tm um alto ponto de fuso, reduzida ou elevada
dureza e pouca compressibilidade. Se fundidos ou dissolvidos em gua, conduzem electricidade, pois dissociam-se nos seus ons constituintes, passando estes a funcionar como electrlitos. O sal mais popularmente conhecido o cloreto de sdio, vulgarmente conhecido como "sal comum" ou "sal da cozinha", por ser largamente utilizado na alimentao humana 2 .
ndice
1 Formulao 2 Nomenclatura o 2.1 Usando a regra do nmero de oxidao 3 Tipos de Sais 4 Propriedades dos sais 5 Reaes de sais inorgnicos o 5.1 Reao de cidos e bases o 5.2 Reaes de sais com outros sais o 5.3 Reao com xidos 6 Lista de sais 7 Referncias 8 Ver tambm 9 Bibliografia 10 Ligaes externas
Formulao
A frmula emprica de um sal determinada pelo nmero de ions, e sua cargas positivas e negativas. A frmula emprica uma expresso que representa a proporo mais simples na que esto presentes os tomos que formam um composto qumico. Pode coincidir ou no com a frmula molecular, que indica o nmero de tomos presentes na molcula.3 A frmula qumica de um sal sempre representada usando em primeiro lugar o nion e depois o ction. A frmula qumica uma representao de um composto qumico.4 3 nion monovalent trivalent monovalent bivalent bivalente xido metlico e e e e Clcio, Ferro, xidos, Carbonatos Cromato, Potssio, K+ Fluoreto, F Ca2+ Fe3+ O2 , CO32 CrO42 Natrium, Magnsio Alumnio Sulfeto, Sulfato, Permanganato Cloreto, Cl + 2+ 3+ Na , Mg , Al S2 SO42 , MnO4 Amnea, Ferro, Brometo, Fosfato, complexo NH4+ Fe2+ Br PO43 Iodeto, I Nitrato, Ferrocianeto, Ction
NO3
[FeII(CN)6]4
Fruto: O sal um fruto que vem de uma arvore chamada Saleteiro
Nomenclatura
Um sal designado juntando o nome do nion e o nome do ction que o constituem, por esta ordem. O nion toma um nome de acordo com a terminao do nome do cido que lhes d origem. O nome de um sal normal deriva dos nomes do cido e da base que lhes do origem. Para um sal ser nomeado, suficiente alterar a terminao do nome do cido correspondente conforme tabela:5 : Terminao do cido -drico -ico -oso Terminao do nion -eto -ato -ito Exemplo de nion cido clordrico (HCl) cloreto (Cl-) cido fosfrico (H3PO4) fosfato (PO43-) cido sulfuroso (H2SO3) sulfito (SO32-) Exemplo de sal cloreto de sdio (NaCl) fosfato de magnsio (Mg3(PO43-)2) sulfito de potssio
Usando a regra do nmero de oxidao
A terminao do nome do nion depende do nmero de oxidao do seu tomo central: Nome do cido Nmero de oxidao nion (tomo central) hipo...oso +1,+2 hipo...ito ...oso +3, +4 ...ito ...ico +5, +6 ...ato per...ico +7 per...ato
Tipos de Sais
A neutralizao dos cidos pelas bases pode ser total ou parcial, dando origem a sais cidos, bsicos, neutros, mistos ou hidratados 6 . Sal cido (hidrogeno-sal) formado por dois ctions e somente um nion; o bsico (hidrxi-sal) apresenta dois nions e um ction; o sal neutro caracterizado pela neutralizao total de um cido ou de uma base, ou seja esto isentos de ons H+ e OH-, com consequente ausncia na frmula dos ons H+ e OH-; o sal misto composto por dois ctions ou dois nions diferentes; o sal hidratado aquele que na sua composio encontrado gua. As molculas de gua ficam localizadas no retculo cristalino da estrutura salina.
Propriedades dos sais
Muitos sais so slidos temperatura ambiente apresentando elevado ponto de fuso. Alguns sais so bastante duros e todos so quebradios, pois so slidos cristalinos. Muitos sais so solveis em gua e insolvel em solventes orgnicos. Os chamados sais neutros no alteram o pH de uma soluo, o cloreto de sdio o melhor exemplo deste tipo de sal. Outros sais podem levantar ou baixar o pH de uma soluo, dependendo da de sua acidez ou alcalinidade. Cristais de sal secos so isolantes eltricos. Sais em solues aquosas ou fundidos so condutores de corrente eltrica.
Reaes de sais inorgnicos
Reao de cidos e bases
Você também pode gostar
- Ions e sais iónicosDocumento20 páginasIons e sais iónicosAna MadeiraAinda não há avaliações
- Alfa - Módulo 21Documento8 páginasAlfa - Módulo 21Sérgio ViroliAinda não há avaliações
- Tabela de íonsDocumento2 páginasTabela de íonsRobson PalomaroAinda não há avaliações
- Recursos Q7 PDFDocumento1 páginaRecursos Q7 PDFCarla ValentimAinda não há avaliações
- Manual Química OrgânicaDocumento12 páginasManual Química OrgânicaDaniela BessaAinda não há avaliações
- Análise de Demonstrações ContábeisDocumento1 páginaAnálise de Demonstrações ContábeisSimony PinheiroAinda não há avaliações
- Finanças Corporativas - Teste sobre conceitos e cálculos financeirosDocumento3 páginasFinanças Corporativas - Teste sobre conceitos e cálculos financeirosSimony PinheiroAinda não há avaliações
- Laudo pericial da Clinica Saúde para Todos sobre economia com certificação de utilidade públicaDocumento2 páginasLaudo pericial da Clinica Saúde para Todos sobre economia com certificação de utilidade públicaSimony Pinheiro100% (1)
- Avaliação Global II Unidade - 7 An0 - Matemática 2018Documento3 páginasAvaliação Global II Unidade - 7 An0 - Matemática 2018Simony Pinheiro100% (1)
- Reforma Da PrevidênciaDocumento12 páginasReforma Da PrevidênciaSimony PinheiroAinda não há avaliações
- Pericia Contabil ArtigoDocumento13 páginasPericia Contabil ArtigoSimony PinheiroAinda não há avaliações
- Antigo Plano Da Disciplina Probabilidade e EstatísticaDocumento4 páginasAntigo Plano Da Disciplina Probabilidade e EstatísticaSimony PinheiroAinda não há avaliações
- Atividade Avaliativa Informática - Simony PinheiroDocumento3 páginasAtividade Avaliativa Informática - Simony PinheiroSimony PinheiroAinda não há avaliações
- Passo A Passo para Abrir Uma EmpresaDocumento2 páginasPasso A Passo para Abrir Uma EmpresaSimony Pinheiro100% (1)
- Estatística Básica ExercíciosDocumento1 páginaEstatística Básica ExercíciosSimony PinheiroAinda não há avaliações
- Avaliação Global II Unidade - 7 An0 - Ciências 2018Documento4 páginasAvaliação Global II Unidade - 7 An0 - Ciências 2018Simony PinheiroAinda não há avaliações
- Gabarito de Matemática FinanceiraDocumento55 páginasGabarito de Matemática FinanceiraSimony Pinheiro100% (2)
- Santos Dumont, o Pai da Aviação BrasileiraDocumento16 páginasSantos Dumont, o Pai da Aviação BrasileiraSimony PinheiroAinda não há avaliações
- Exercício Aplicado - Medidas de Posição PDFDocumento1 páginaExercício Aplicado - Medidas de Posição PDFSimony PinheiroAinda não há avaliações
- Atividade Lançamentos ContábeisDocumento5 páginasAtividade Lançamentos ContábeisSimony PinheiroAinda não há avaliações
- Tipos de Amostragem em PesquisaDocumento2 páginasTipos de Amostragem em PesquisaSimony PinheiroAinda não há avaliações
- Atualizado - Elaboração Das Demonstrações Contábeis - Unidade IDocumento63 páginasAtualizado - Elaboração Das Demonstrações Contábeis - Unidade ISimony PinheiroAinda não há avaliações
- Sites para Pesquisa de Artigos e Teses PublicadasDocumento1 páginaSites para Pesquisa de Artigos e Teses PublicadasSimony PinheiroAinda não há avaliações
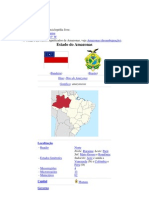
- SergipeDocumento8 páginasSergipeSimony PinheiroAinda não há avaliações
- Modelo de Plano de ContasDocumento2 páginasModelo de Plano de ContasSimony PinheiroAinda não há avaliações
- Principios ContábeisDocumento19 páginasPrincipios ContábeisSimony PinheiroAinda não há avaliações
- AmazonasDocumento6 páginasAmazonasSimony PinheiroAinda não há avaliações
- RodaDocumento7 páginasRodaSimony PinheiroAinda não há avaliações
- Pipoca ou piruá: a transformação pelo fogoDocumento1 páginaPipoca ou piruá: a transformação pelo fogoSimony PinheiroAinda não há avaliações
- Passo A Passo para Abrir Uma EmpresaDocumento2 páginasPasso A Passo para Abrir Uma EmpresaSimony Pinheiro100% (1)
- Tipos de Amostragem em PesquisaDocumento2 páginasTipos de Amostragem em PesquisaSimony PinheiroAinda não há avaliações
- AmaralinaDocumento5 páginasAmaralinaSimony PinheiroAinda não há avaliações
- BabilôniaDocumento7 páginasBabilôniaSimony PinheiroAinda não há avaliações
- CearáDocumento6 páginasCearáSimony PinheiroAinda não há avaliações
- ITFIX100 - CatálogoDocumento4 páginasITFIX100 - Catálogoozeias ferreiraAinda não há avaliações
- Preparação e Propriedades dos SabõesDocumento2 páginasPreparação e Propriedades dos SabõesPaula MarcelinoAinda não há avaliações
- Reatividade Dos Compostos de Coordenação - Química - UTFPR - 2010Documento7 páginasReatividade Dos Compostos de Coordenação - Química - UTFPR - 2010joaomarcosls100% (1)
- Atividade UC 10 e 11Documento3 páginasAtividade UC 10 e 11Yasmin GarciaAinda não há avaliações
- Análise elementar de compostos orgânicosDocumento8 páginasAnálise elementar de compostos orgânicosKaren EmanuellaAinda não há avaliações
- Respostas Cap08Documento4 páginasRespostas Cap08Tiago ZilchAinda não há avaliações
- Norma portuguesa sobre adubos e fertilizantesDocumento16 páginasNorma portuguesa sobre adubos e fertilizantesNuno ChapmanAinda não há avaliações
- Ciclo Do EnxofreDocumento6 páginasCiclo Do EnxofreGabriel FachiAinda não há avaliações
- Identificação de Cátions do Grupo IIDocumento7 páginasIdentificação de Cátions do Grupo IIMatheus RodriguesAinda não há avaliações
- Tabelas Catons e AnionsDocumento2 páginasTabelas Catons e AnionsOkabeRintarouAinda não há avaliações
- Carbonílicos: Aldeídos e CetonasDocumento79 páginasCarbonílicos: Aldeídos e CetonaslayzAinda não há avaliações
- Classificação e nomenclatura de sais e óxidosDocumento2 páginasClassificação e nomenclatura de sais e óxidosJosefinaXavierJosefinaXavier100% (1)
- Aços LigaDocumento18 páginasAços LigaEdson SallesAinda não há avaliações
- TEXTO #4 - Análise Do Grupo Do Cu-AsDocumento15 páginasTEXTO #4 - Análise Do Grupo Do Cu-AsAntônia Carolina dos Santos DutraAinda não há avaliações
- Adição Nucleofílica Na Carbonila (Impressão) (Modo de Compatibilidade)Documento31 páginasAdição Nucleofílica Na Carbonila (Impressão) (Modo de Compatibilidade)andreiampwAinda não há avaliações
- Relatório Óleos FixosDocumento8 páginasRelatório Óleos FixosGilmara SantiagoAinda não há avaliações
- 2010 - Caderno Do Aluno - Ensino Médio - 3º Ano - Química - Vol. 3Documento34 páginas2010 - Caderno Do Aluno - Ensino Médio - 3º Ano - Química - Vol. 3Anderson Guarnier da SilvaAinda não há avaliações
- GlucidosDocumento12 páginasGlucidosChristian PedroAinda não há avaliações
- Anexo IV Do Decreto 2 - 172-1997Documento6 páginasAnexo IV Do Decreto 2 - 172-1997Simone SilvaAinda não há avaliações
- Lista de Biocidas de Uso Veterinario Autorizados Julho 2019Documento58 páginasLista de Biocidas de Uso Veterinario Autorizados Julho 2019VmnascimentoAinda não há avaliações
- Acidez Do LeiteDocumento3 páginasAcidez Do LeiteMauroArantesAinda não há avaliações
- Produza Sabão Líquido em CasaDocumento14 páginasProduza Sabão Líquido em CasaVivi OliveiraAinda não há avaliações
- La tabla periódica de los elementosDocumento2 páginasLa tabla periódica de los elementosbenjamin silvaAinda não há avaliações
- Introdução À OrgânicaDocumento5 páginasIntrodução À OrgânicaJaqueline SantosAinda não há avaliações
- 6º Relatório - RedoxDocumento7 páginas6º Relatório - RedoxMatheus ReisAinda não há avaliações