Escolar Documentos
Profissional Documentos
Cultura Documentos
Diagramas de Equilibrio
Enviado por
Norma MaestreDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Diagramas de Equilibrio
Enviado por
Norma MaestreDireitos autorais:
Formatos disponíveis
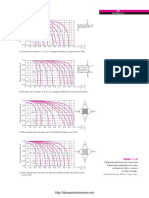
Diagramas de equilibrio
Los diagramas de equilibrio son grficas que representan las fases y estado en que pueden estar diferentes concentraciones de materiales que forma una aleacin a distintas temperaturas. Dichas temperaturas van desde la temperatura por encima de la cual un material est en fase liquida hasta la temperatura ambiente y en que generalmente los materiales estn en estado slido.Existen diferentes diagramas de equilibrio segn los materiales sean totalmente solubles en estado slido y liquido o sean miscibles a que sean insolubles. Tambin pueden darse casos particulares. Uno de los diagramas de equilibrio ms clsico es el de los aceros que tiene particularidades y donde afecta claramente la concentracin y las diferentes cristalizaciones que puede darse en el hierro estando en estado slido y a diferentes temperaturas. Dos metales (A, B) a temperaturas superiores a sus respectivos puntos de fusin (TA, TB) se encuentran en estado lquido pudindose disolver y conformar as una fase nica lquida. Esto quiere decir que no podemos establecer diferencias de comportamiento u observacin entre las distintas partes del lquido y que los metales en las proporciones mezcladas tienen la propiedad de miscibilidad. Si la mezcla lquida, XA?XB, la sometemos a un proceso de solidificacin, mediante enfriamiento, llegamos a obtener el producto que se denomina aleacin de los metales A y B. Es conocido que las aleaciones mejoran las caractersticas de los metales puros. Realmente debera decirse que introducen variables que diferencian el comportamiento de los metales puros que las componen, porque en algunas circunstancias pueden perjudicar sus propiedades. Obviamente, conformar una aleacin es uno de los medios ms primitivos que la ingeniera ha dispuesto para actuar sobre las propiedades de los metales puros, incluso histricamente la aleacin es predecesora como lo justifica el bronce, Edad del bronce.
Los diagramas de fases son representaciones grficas a varias temperaturas, presiones y composiciones- de las fases que estn presentes en un sistema de materiales. Los diagramas de fases se realizan mediante condiciones de equilibrio (enfriamiento lento) y son utilizados para entender y predecir muchos aspectos del comportamiento de los materiales. Parte de la informacin que se puede obtener a partir de ellos es la siguiente:
Fases presentes a diferentes composiciones y temperaturas. Solubilidad de un elemento o compuesto en otro.
Temperatura a la cual una aleacin que se deja enfriar empieza a solidificar as como el rango de temperaturas en el que tiene lugar la solidificacin. Temperatura a la que se funden o empiezan a fundirse las distintas fases.
La figura 2.1 muestra el diagrama de fases presintemperatura del agua. Una sustancia pura como el agua puede existir en fase slida, lquida o gaseosa en funcin de las condiciones de presin y temperatura. En el diagrama se observa un punto triple a baja presin (4579 torr) y baja temperatura (0,0098C) en el que coexisten las fases slida, lquida y gaseosa del agua. Las fases lquida y gaseosa existen a lo largo de la lnea de vaporizacin; las fases lquida y slida existen a lo largo de la lnea de solidificacin. Estas lneas son lneas de equilibrio entre las dos fases.
A presin constante y a medida que aumenta la temperatura el agua pasa de la fase slida a la fase lquida. La temperatura en la que tiene lugar este cambio de fase es la temperatura de fusin. Si continua aumentando la temperatura habr un segundo cambio de fase en el que el agua pasa de lquido a vapor, es la temperatura de vaporizacin. La temperatura de fusin y vaporizacin coincide para varias presiones con la lnea de solidificacin y vaporizacin respectivamente.
Figura 2.1
Diagrama de equilibrio de fases para el agua pura
La figura 2.2 muestra el diagrama de fases presintemperatura del hierro puro. El hierro tiene a diferencia del agua tres fases slidas separadas y distintas: hierro alfa, hierro gamma y hierro delta. En el diagrama se observan tres puntos triples en los que coexisten tres fases diferentes: (1) lquido, vapor y Fe ; (2) vapor, Fe y Fe ; y (3) vapor, Fe y Fe . Para una presin constante de 1 atm, el hierro pasa de la fase lquida a la fase de Fe a la temperatura de fusin de 1.539C. Si continua el enfriamiento de la muestra y a 1.394C un segundo cambio de fase producir la transformacin de la forma cristalina del Fe a Fe . A 910C se produce el cambio de fase a Fe que se mantendr hasta llegar a temperatura ambiente.
Figura 2.2
Diagrama de equilibrio de fases para el hierro puro.
Você também pode gostar
- Cinética de una partícula: Trabajo y energíaDocumento103 páginasCinética de una partícula: Trabajo y energíaLuis Jhonathan Lazo Abril73% (15)
- Revista# 61aDocumento84 páginasRevista# 61awal10100% (2)
- Metodo SaraDocumento43 páginasMetodo SaraLuis José Mavarez100% (1)
- Astro Racional 2 (2016 - 08 - 17 13 - 55 - 07 UTC)Documento217 páginasAstro Racional 2 (2016 - 08 - 17 13 - 55 - 07 UTC)isaac52Ainda não há avaliações
- Resumen Del Libro El Origen de La VidaDocumento4 páginasResumen Del Libro El Origen de La VidaSneider SuarezAinda não há avaliações
- Principio Impulso Cantidad de Movimiento 2016Documento73 páginasPrincipio Impulso Cantidad de Movimiento 2016Alexander VicenteAinda não há avaliações
- Karen Roa ProyectoDocumento28 páginasKaren Roa ProyectoKristian Aram Perez RuedaAinda não há avaliações
- Catalogo de Iluminacion LED 2017-2018Documento104 páginasCatalogo de Iluminacion LED 2017-2018miguelmejiacaasAinda não há avaliações
- Tablas Termicas Intercambiadores de CalorDocumento4 páginasTablas Termicas Intercambiadores de CalorXavi Places100% (1)
- Equipo de Perforación RotatoriaDocumento8 páginasEquipo de Perforación RotatoriaEinar F Carvallo A100% (1)
- Cemento Portland Resistencia A Los SulfatosDocumento15 páginasCemento Portland Resistencia A Los SulfatosMarcelo CrucesAinda não há avaliações
- Parametros de CalidadDocumento17 páginasParametros de CalidadMarta DubaAinda não há avaliações
- Problema de Curva de PersecucionDocumento18 páginasProblema de Curva de PersecucionAlex HuanchiAinda não há avaliações
- Biprisma de FresnelDocumento5 páginasBiprisma de FresnelsaikandreaAinda não há avaliações
- Investigacion DinamicaDocumento16 páginasInvestigacion Dinamicajose Gerardo RamirezAinda não há avaliações
- Movimiento Parabolico ExposicionDocumento12 páginasMovimiento Parabolico ExposicionJavier Morales50% (4)
- Laboratorio de TransistoresDocumento10 páginasLaboratorio de TransistoresJefferson O Cobos SuarezAinda não há avaliações
- Minerales No SilicatadosDocumento11 páginasMinerales No SilicatadosDe Javu De JavuAinda não há avaliações
- Referente Precipitaciones Promedio GachancipaDocumento143 páginasReferente Precipitaciones Promedio GachancipaDaniel GuerreroAinda não há avaliações
- Materiales AeronauticosDocumento17 páginasMateriales Aeronauticosveroni-k-andreaAinda não há avaliações
- Resumen de Proyecto de TesisDocumento128 páginasResumen de Proyecto de TesisKevin Arnold Vasquez BarretoAinda não há avaliações
- Ejercicio Colaborativo Quimica AnaliticaDocumento3 páginasEjercicio Colaborativo Quimica AnaliticaCamiloAinda não há avaliações
- Maquinas Termicas Syllabus UnfvDocumento7 páginasMaquinas Termicas Syllabus UnfvNiloAinda não há avaliações
- 4to Semestre Administración de EmpresasDocumento2 páginas4to Semestre Administración de EmpresasLN NLAinda não há avaliações
- Unidad 4 TermodinámicaDocumento9 páginasUnidad 4 TermodinámicaRey Agama100% (1)
- Gan Van Der GraaffDocumento3 páginasGan Van Der Graaffbrianj01Ainda não há avaliações
- PISA. Ejemplos de Items de Conocimiento CientíficoDocumento59 páginasPISA. Ejemplos de Items de Conocimiento CientíficoEquipo de Orientación Liceo CastillaAinda não há avaliações
- Instalación y mantenimiento de bombas centrífugas ETNDocumento17 páginasInstalación y mantenimiento de bombas centrífugas ETNErnesto Suarez MorenoAinda não há avaliações
- Manual Analisis IndustrialDocumento58 páginasManual Analisis IndustrialYanira EchegoyenAinda não há avaliações
- Nieves ValentinDocumento22 páginasNieves ValentinAlfredo N. Huamaní GarcíaAinda não há avaliações