Escolar Documentos
Profissional Documentos
Cultura Documentos
Superficies Termodinamicas
Enviado por
Max Jhon Arias BaspineiroTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Superficies Termodinamicas
Enviado por
Max Jhon Arias BaspineiroDireitos autorais:
Formatos disponíveis
Superficies Termodinámicas
8-Sep-06 Alicia Ma. Esponda Cascajares 1
Ley de Boyle-Mariotte
En 1662 Robert Boyle formuló la generalización que
relación el volumen de una masa de gas con la
presión ejercida sobre el.
Estos resultados fueron confirmados por Louis
Mariotte.
Determinó que V α 1/P, cuando la temperatura y la
masa permanecen constantes.
Si la presión ejercida sobre una masa de gas
aumenta, el volumen disminuye por lo que el numero
de moléculas por unidad de volumen aumenta junto
con el numero de impactos moleculares sobre las
paredes del recipiente, aunque la fuerza de cada
impacto permanece constante.
8-Sep-06 Alicia Ma. Esponda Cascajares 2
Ley de Boyle-Mariotte
1
V =K⋅ o P ⋅ V = constante
P
Un mismo gas que
cambie de estado: P1 ⋅ V1 = P2 ⋅ V2
8-Sep-06 Alicia Ma. Esponda Cascajares 3
Ley de Charles
En 1801 Jacques Charles estableció la relación entre
la variación del volumen con la temperatura.
Determinó que V α T, cuando la presión y la masa
permanecen constantes.
A medida que el gas se calienta, la velocidad media
de las moléculas aumenta produciéndose mas
impactos por unidad de tiempo sobre las paredes del
recipiente y a una mayor fuerza por impacto. Como
la presión permanece constante, el volumen debe
aumentar para compensar este incremento en el
efecto de presión.
8-Sep-06 Alicia Ma. Esponda Cascajares 4
Ley de Charles
o V
V = K ⋅T = constante
T
Un mismo gas que
V1 V2
cambie de estado: =
T1 T2
8-Sep-06 Alicia Ma. Esponda Cascajares 5
Ley de Gay-Lussac
Joseph Gay-Lussac encontró la relación existente
entre la variación de presión y la temperatura.
Determinó que P α T, cuando el volumen y la masa
permanecen constantes.
Si se aumenta la temperatura de una masa de gas
manteniendo el volumen constante, las moléculas
aumentan de velocidad, resultando en un mayor
numero de impactos por unidad de tiempo sobre las
paredes del recipiente generando un aumento de la
presión.
8-Sep-06 Alicia Ma. Esponda Cascajares 6
Ley de Gay-Lussac
o P
P = K ⋅T = constante
T
Un mismo gas que
P1 P2
cambie de estado: =
T1 T2
8-Sep-06 Alicia Ma. Esponda Cascajares 7
Ley General de los Gases
Con cualesquiera dos de
estas tres leyes, se
puede establecer la Ley
General de los Gases P1 ⋅ V1 P2 ⋅ V2
=
que establece el T1 T2
comportamiento de los
gases de bajas
densidades.
8-Sep-06 Alicia Ma. Esponda Cascajares 8
Ley de Avogadro
Amadeo Avogadro enuncio su ley como
explicación a la ley de Gay-Lussac.
“Volúmenes iguales de gases, en las mismas
condiciones de temperatura y presión,
contienen el mismo número de moléculas”.
A partir de sus experimentos determino el
numero de Avogadro NA, que representa el
numero de átomos que hay en un átomo-
gramo de cualquier elemento.
NA=6.023x1023[mol-1]
8-Sep-06 Alicia Ma. Esponda Cascajares 9
Ecuaciones de Estado
Es cualquier ecuación que exprese la
relación entre la temperatura, la presión
y el volumen de una masa determinada
de una substancia.
Las leyes vistas anteriormente son
ecuaciones de estado.
8-Sep-06 Alicia Ma. Esponda Cascajares 10
Ecuaciones de Estado
De las leyes vistas sabemos que
PVαT
Se puede asignar una igualdad utilizando
una constante de proporcionalidad.
PV=CT
La constante de proporcionalidad es igual a
una constante k por el numero de
moléculas del gas.
C=kN
8-Sep-06 Alicia Ma. Esponda Cascajares 11
Ecuaciones de Estado
La constante k es la constante de
Boltzmann
k=1.381x10-23[J/K]
Es una constante de los gases por molécula.
Sustituyendo lo anterior en la ecuación de
estado tenemos:
PV=kNT
El numero de moléculas de un gas se
relaciona con el numero de Avogadro como:
N=n NA
8-Sep-06 Alicia Ma. Esponda Cascajares 12
Ecuaciones de Estado
Siendo n los moles de substancia.
Sustituyendo queda:
P V = n NA k T
8-Sep-06 Alicia Ma. Esponda Cascajares 13
Constante Universal de los Gases
Se encuentra que para todos los gases
a bajas presiones y altas temperaturas
que hay una constante que se define
como:
Ru = NA k
Y ese valor resulta ser:
Ru=8.3143 [J/molK]
8-Sep-06 Alicia Ma. Esponda Cascajares 14
Ecuaciones de Estado
Substituyendo la constante de los gases en
las ecuaciones de estado tenemos:
P V = n Ru T
Para poder expresar las ecuaciones en
términos de la masa, se hace a través de la
relación de n con la masa, es decir mediante
la masa molar M.
m =n M
8-Sep-06 Alicia Ma. Esponda Cascajares 15
Ecuaciones de Estado
Substituyendo el despeje se m
P ⋅V = Ru ⋅ T
tiene que: M
Se define a R, como la Ru
constante de un gas particular R=
M
como:
De manera que sustituyendo P ⋅V = m ⋅ R ⋅ T
nos queda:
R es diferente para cada gas,
pero su valor se obtiene de
tablas.
8-Sep-06 Alicia Ma. Esponda Cascajares 16
8-Sep-06 Alicia Ma. Esponda Cascajares 17
Ecuación de van der Waals
Es una fórmula mas exacta para
expresar el comportamiento de los
gases.
Fue presentada en 1873 como un ⎛ a ⎞
P + 2 ⎟ ⋅ (V − b ) = R ⋅ T
intento de mejorar los resultados ⎜⎝ V ⎠
obtenidos.
La cantidad (a/V2) representa la
corrección por las fuerzas atractivas
intermoleculares y b la corrección
del volumen por el espacio ocupado
por las moléculas.
8-Sep-06 Alicia Ma. Esponda Cascajares 18
Ecuación Benedict-Webb-Rubin
Es la fórmula utilizada para generar las tablas
termodinámicas.
Fue desarrollada en 1940.
Cuenta con 8 constantes empíricas
incluyendo a las constantes a y b de la
ecuación de van der Waals.
C0
R ⋅ T ⋅ B0 − A0 −
P=
R ⋅T
+ T 2 + R ⋅ T ⋅ b − a + a ⋅ α + c ⎛⎜1 + γ ⎞⎟e −γ v2
v v2 v3 v6 v3 ⋅T 2 ⎝ v2 ⎠
8-Sep-06 Alicia Ma. Esponda Cascajares 19
Propiedades del líquido y vapor saturado del
agua (Tabla de Presión)
Presión Tempera Volumen Energía Interna Entalpía Entropía
[MPa] tura Específico [kJ/kg] [kJ/kg] [kJ/kgK]
[°C] [m3/kg]
P T vf vg uf ufg ug hf hfg hg sf sfg sg
0.2 120.23 0.0010 0.88 504.4 2025 2529 504. 2202 2706. 1.530 5.59 7.12
61 57 7 .0 .5 68 .0 6 0 70 71
0.4 143.63 0.0010 0.46 604.2 1949 2553 604. 2133 2738. 1.776 5.11 6.89
84 25 9 .3 .6 73 .8 5 6 93 58
0.6 158.85 0.0011 0.31 669.8 1897 2567 670. 2086 2756. 1.931 4.82 6.76
01 57 8 .5 .4 54 .3 8 1 89 00
0.8 170.43 0.0011 0.24 720.2 1856 2576 721. 2048 2769. 2.046 4.61 6.66
15 04 0 .6 .8 10 .0 1 1 66 27
8-Sep-06 Alicia Ma. Esponda Cascajares 20
Ecuación Lee-Kesler
Es una derivación de la ecuación BWR
desarrollada en 1975, utilizada ahora en las
tablas termodinámicas computarizadas.
Tiene 12 constantes empíricas.
⎛ γ ⎞
⎜− ⎟
⎛ ⎞ ⎜ v' 2 ⎟
⎜β + γ 2
Pr ⋅ v' r B C D c4 ⎝ ⎠
⎟
r
= 1+ + 2 + 5 + 3 ⎜ ⎟
Tr ⋅ v' r
2
Tr v' r v' r v' r ⎝ v' r ⎠
8-Sep-06 Alicia Ma. Esponda Cascajares 21
Ecuación Lee-Kesler
Donde:
b b b
B = b 1 − 2
− 3
2
− 4
3
T r T r T r
c c
C = c 1 − 2
− 3
3
T r T r
d
D = d 1 − 2
T r
v
v 'r =
R ⋅ T c
P c
8-Sep-06 Alicia Ma. Esponda Cascajares 22
8-Sep-06 Alicia Ma. Esponda Cascajares 23
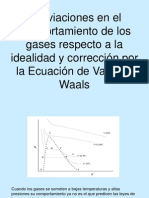
Temperatura y Presión Críticas
Las bajas temperaturas y altas presiones
favorecen la conversión de los gases en
líquidos y de los líquidos en sólidos ya que se
tiende a incrementar la atracción molecular y
se disminuye la energía cinética de las
moléculas.
Si la temperatura no se reduce, por medio de
la presión no siempre se convierte un gas en
un liquido.
8-Sep-06 Alicia Ma. Esponda Cascajares 24
Temperatura y Presión Criticas
Temperatura Crítica es la temperatura por
encima de la cual la substancia no puede
licuarse por la sola aplicación de presión.
Presión Crítica es la presión necesaria para
licuar un gas a su temperatura critica.
Cada substancia tiene una temperatura y
presión critica especifica.
Por encima de ese punto (critico) no hay
distinción entre las fases de las substancias.
8-Sep-06 Alicia Ma. Esponda Cascajares 25
Temperatura y Presión Criticas
Cuanto mayor es la temperatura critica,
menor es la presión necesaria para
licuar un gas a temperatura ambiente.
8-Sep-06 Alicia Ma. Esponda Cascajares 26
8-Sep-06 Alicia Ma. Esponda Cascajares 27
8-Sep-06 Alicia Ma. Esponda Cascajares 28
8-Sep-06 Alicia Ma. Esponda Cascajares 29
8-Sep-06 Alicia Ma. Esponda Cascajares 30
8-Sep-06 Alicia Ma. Esponda Cascajares 31
8-Sep-06 Alicia Ma. Esponda Cascajares 32
8-Sep-06 Alicia Ma. Esponda Cascajares 33
8-Sep-06 Alicia Ma. Esponda Cascajares 34
Gas Ideal
Es todo gas que P ⋅V = m ⋅ R ⋅ T
cumple con las
ecuaciones de P ⋅ V = n ⋅ Ru ⋅ T
estado:
Estas ecuaciones
funcionan a bajas
densidades y en un
cierto rango de
temperatura y
presión.
8-Sep-06 Alicia Ma. Esponda Cascajares 35
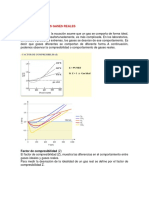
Factor de Compresibilidad
Es un factor que se introduce
para definir en que rango de Pv
densidad y de presión- Z≡
temperatura funcionan las RT
ecuaciones de estado.
Z es igual a 1 para un gas
ideal.
Si Z<1 la densidad es mucho
mayor que la que predicen
las ecuaciones de estado.
8-Sep-06 Alicia Ma. Esponda Cascajares 36
8-Sep-06 Alicia Ma. Esponda Cascajares 37
Principio de los Estados
Correspondientes
El factor de
compresibilidad para P
todos los gases es PR ≡
aproximadamente el Pc
mismo cuando estos
tienen la misma
T
presión y
temperatura
TR ≡
reducida. Tc
8-Sep-06 Alicia Ma. Esponda Cascajares 38
8-Sep-06 Alicia Ma. Esponda Cascajares 39
Calidad
mvapor mg
Calidad = x = =
mtotal mg + m f
El subíndice g indica el estado de vapor
saturado
El subíndice f se refiere al estado de
líquido saturado.
8-Sep-06 Alicia Ma. Esponda Cascajares 40
Calidad (prop. Intensivas)
y total − y f y total − y f
Calidad = x = =
y fg yg − y f
Donde y es la propiedad intensiva de
que se trate.
8-Sep-06 Alicia Ma. Esponda Cascajares 41
Ejercicio
Una vasija cuyo volumen es 0.4 [m3]
contiene 2 [kg] de agua en mezcla de
líquido y vapor en equilibrio a una
presión de 600 [kPa]. Calcular:
La calidad de la mezcla
La masa de líquido
La masa de vapor
El volumen de líquido y vapor.
8-Sep-06 Alicia Ma. Esponda Cascajares 42
Propiedades del líquido y vapor saturado del
agua (Tabla de Presión)
Presión Temperatura Volumen Específico Energía Interna Entalpía
[MPa] [°C] [m3/kg] [kJ/kg] [kJ/kg]
P T vf vg uf ufg ug hf hfg hg sf
0.2 120.23 0.001061 0.8857 504.47 2025.0 2529.5 504.68 2202.0 2706.6 1.530
0.4 143.63 0.001084 0.4625 604.29 1949.3 2553.6 604.73 2133.8 2738.5 1.776
0.6 158.85 0.001101 0.3157 669.88 1897.5 2567.4 670.54 2086.3 2756.8 1.931
0.8 170.43 0.001115 0.2404 720.20 1856.6 2576.8 721.10 2048.0 2769.1 2.046
8-Sep-06 Alicia Ma. Esponda Cascajares 43
Ejercicio
La calidad de la
mezcla
Se calcula el volumen V 0.4
v= = = 0.20 ⎡ m 3
⎤
específico: m 2. 0 ⎢⎣ kg ⎥⎦
v fg = v g − v f
De las tablas se
obtiene vfg v fg = 0.3157 − 0.001101
v fg = 0.3146
8-Sep-06 Alicia Ma. Esponda Cascajares 44
Ejercicio
La calidad de la mezcla
v −vf 0.2 − 0.001101
x= = = 0.6322
v fg 0.3146
Es decir 63.22%
8-Sep-06 Alicia Ma. Esponda Cascajares 45
Ejercicio
La masa de líquido
m f = m(1 − x ) = (2.0 )(1 − 0.6322) = 0.7356[kg ]
La masa de vapor
m g = m( x ) = (2.0 )(0.6322) = 1.2644[kg ]
8-Sep-06 Alicia Ma. Esponda Cascajares 46
Ejercicio
El volumen de líquido
[ ]
V f = v f m f = (0.001101)(0.7356) = 0.0008 m 3
El volumen de vapor
[ ]
V g = v g m g = (0.3157 )(1.2644) = 0.3992 m 3
8-Sep-06 Alicia Ma. Esponda Cascajares 47
Você também pode gostar
- Gases 2020-1Documento10 páginasGases 2020-1Edward GilAinda não há avaliações
- Calor y GasesDocumento16 páginasCalor y GasesANTOINE HAFID CHUCHON DE LA CRUZAinda não há avaliações
- TEMA VIII Estado GaseosoDocumento32 páginasTEMA VIII Estado GaseosoGREDY JOSEPH SULCA MARTINEZAinda não há avaliações
- Quimica 2Documento12 páginasQuimica 2Maria Isabel Ángeles Quevedo100% (1)
- Practica 2Documento8 páginasPractica 2AyrtonAinda não há avaliações
- Practica 1 Quimica AplicadaDocumento10 páginasPractica 1 Quimica AplicadaAlfredoAinda não há avaliações
- Ecuación de Estado para Gases RealesDocumento13 páginasEcuación de Estado para Gases RealesCristian Ccaso MamaniAinda não há avaliações
- Cartilla Problema FQ2016Documento100 páginasCartilla Problema FQ2016Francesca Toledo100% (1)
- PracticaDocumento34 páginasPracticaDaniel ChávezAinda não há avaliações
- Estado Gaseoso Quimica GeneralDocumento70 páginasEstado Gaseoso Quimica GeneralRiverDavid Rodriguez0% (1)
- V. Teoria Cinetica de Los GasesDocumento28 páginasV. Teoria Cinetica de Los Gasesanon_580798559Ainda não há avaliações
- Fisico Qumica 1Documento17 páginasFisico Qumica 1yhuillcamAinda não há avaliações
- Informe de Gases IdealesDocumento8 páginasInforme de Gases IdealesJulio Cesar CancioAinda não há avaliações
- Clase 2 Gases RealesDocumento74 páginasClase 2 Gases RealesPETER ANDRES JACOBO ABURTOAinda não há avaliações
- Capitulo 2Documento9 páginasCapitulo 2Gastón SarapuraAinda não há avaliações
- Estudio de Los GasesDocumento24 páginasEstudio de Los GasesRaysa LlacsahuangaAinda não há avaliações
- GasesDocumento9 páginasGasesAndres CasanovaAinda não há avaliações
- Clase+2 TD 2022Documento34 páginasClase+2 TD 2022patriarca28Ainda não há avaliações
- Taller de Gases IdealesDocumento10 páginasTaller de Gases IdealesMARIA JOSE QUIROGAS CUELLOAinda não há avaliações
- Sem 8 SenatiDocumento17 páginasSem 8 SenatiAngie EspinozaAinda não há avaliações
- Ley de CharlesDocumento4 páginasLey de Charlesjoaquin arredondoAinda não há avaliações
- GAS IDEAL NrasDocumento19 páginasGAS IDEAL NrasAngelo Bazán LadinesAinda não há avaliações
- Clase 2 GasesDocumento52 páginasClase 2 GasesPaula MoralesAinda não há avaliações
- Laboratorio #4 TermoDocumento11 páginasLaboratorio #4 TermoRaelee IsabelAinda não há avaliações
- Estado GaseosoDocumento12 páginasEstado GaseosoandreaAinda não há avaliações
- Apend CDocumento16 páginasApend CJunior PachecoAinda não há avaliações
- Practica 1 QuimicaDocumento17 páginasPractica 1 QuimicaLuis Miguel Juarez MunguiaAinda não há avaliações
- Semana 2 FQ Gases RealesDocumento24 páginasSemana 2 FQ Gases RealesJacqueline Machón CamposAinda não há avaliações
- Gases RealesDocumento35 páginasGases RealesMarco Cisneros,Yheferson Maza,Diego Díaz,Jairo Giohayro,David Samamé,Gino Cuadros,Ricardo Trinidad100% (1)
- Laboratorio Fisico Quimica AmbientalDocumento32 páginasLaboratorio Fisico Quimica AmbientalmariaAinda não há avaliações
- UNIDAD II - TermodinamicaDocumento10 páginasUNIDAD II - TermodinamicaIlse AhujaAinda não há avaliações
- Unidad 2 Gas IdealDocumento35 páginasUnidad 2 Gas IdealIndiraAinda não há avaliações
- Gases Ideales y RealesDocumento13 páginasGases Ideales y RealesLee HansonAinda não há avaliações
- Gases-Primer PrincipioDocumento33 páginasGases-Primer PrincipioFer SalamancaAinda não há avaliações
- Sem 9 Ley de GasesDocumento28 páginasSem 9 Ley de GasesHady Quispe LeónAinda não há avaliações
- El Estado GaseosoDocumento18 páginasEl Estado GaseosoMaurian SolisAinda não há avaliações
- Clase - 1Documento50 páginasClase - 1Leonela Ghissel Terrones RochaAinda não há avaliações
- TermodinámicaDocumento4 páginasTermodinámicaElaisaVarasAinda não há avaliações
- GASESDocumento16 páginasGASEScandereyna99Ainda não há avaliações
- Sustancia PurasDocumento51 páginasSustancia PurasALEX DE LA CRUZ CCARHUAYPIÑAAinda não há avaliações
- Laboratorio #4 TermoDocumento11 páginasLaboratorio #4 TermoRaelee Isabel0% (1)
- Termo 3Documento36 páginasTermo 3José Emilio GuardiaAinda não há avaliações
- Introduccion Al Estado GaseosoDocumento4 páginasIntroduccion Al Estado GaseosoRDAinda não há avaliações
- Termodinamica Parte 2Documento11 páginasTermodinamica Parte 2Verónica Elina RubelAinda não há avaliações
- Primera Ley de TermodinamicaDocumento70 páginasPrimera Ley de TermodinamicaMANUEL ANGEL ROMERO HERNANDEZAinda não há avaliações
- Cuestionario Gases, Termoquímica y ElectroquímicaDocumento24 páginasCuestionario Gases, Termoquímica y ElectroquímicaEmily GonzalesAinda não há avaliações
- Propiedades Empíricas de Los Gase1Documento8 páginasPropiedades Empíricas de Los Gase1juan alberto gareca guerreroAinda não há avaliações
- Sesiòn Nº14 Teorìa Cinètica de Los GasesDocumento38 páginasSesiòn Nº14 Teorìa Cinètica de Los GasesArturo MartinezAinda não há avaliações
- Unidad 07-GasesDocumento19 páginasUnidad 07-Gaseslucas baeAinda não há avaliações
- Problemario - Unidad - 5 Quimica AplicadaDocumento16 páginasProblemario - Unidad - 5 Quimica AplicadauzieAinda não há avaliações
- Estado GaseosoDocumento13 páginasEstado Gaseosocarlos torresAinda não há avaliações
- Teoria de GasesDocumento6 páginasTeoria de GasesClaudia Mabel FloresAinda não há avaliações
- Seminario N°1 Gases Ideales y RealesDocumento6 páginasSeminario N°1 Gases Ideales y Realesnikolle loayzaAinda não há avaliações
- Gases IdealesDocumento15 páginasGases IdealesleslieAinda não há avaliações
- Estado gaseoso-RESUMIDODocumento9 páginasEstado gaseoso-RESUMIDOESplay YTAinda não há avaliações
- Instituto Tecnológico Nacional de México Campus Villahermosa Alumno: Catedratica: Asignatura: Carrera: Semestre: FechaDocumento23 páginasInstituto Tecnológico Nacional de México Campus Villahermosa Alumno: Catedratica: Asignatura: Carrera: Semestre: FechaEduardo NiñoAinda não há avaliações
- Tema 12Documento25 páginasTema 12Mortal ResiduoAinda não há avaliações
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesNo EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAinda não há avaliações
- Ingeniería química. Soluciones a los problemas del tomo INo EverandIngeniería química. Soluciones a los problemas del tomo IAinda não há avaliações
- Tema N 1 Sistema Solar Ciencias NaturalesDocumento5 páginasTema N 1 Sistema Solar Ciencias NaturalesMax Jhon Arias BaspineiroAinda não há avaliações
- Buenas Practicas de AlmacenamientoDocumento20 páginasBuenas Practicas de AlmacenamientoLiliana Fernandez RodriguezAinda não há avaliações
- Id30 ESPDocumento23 páginasId30 ESPMax Jhon Arias BaspineiroAinda não há avaliações
- Implementacion de Norma Iso 30301 en La UdecDocumento187 páginasImplementacion de Norma Iso 30301 en La UdecAndres MohoAinda não há avaliações
- Buenas Practicas de AlmacenamientoDocumento20 páginasBuenas Practicas de AlmacenamientoLiliana Fernandez RodriguezAinda não há avaliações
- UMSS - WebSISS Sistema de Información San SimónDocumento3 páginasUMSS - WebSISS Sistema de Información San SimónMax Jhon Arias Baspineiro100% (1)
- Implementacion de Norma Iso 30301 en La UdecDocumento187 páginasImplementacion de Norma Iso 30301 en La UdecAndres MohoAinda não há avaliações
- Electrolisis Leyes FaradayDocumento10 páginasElectrolisis Leyes FaradayzarceloAinda não há avaliações
- Fund EmpresaDocumento26 páginasFund EmpresaJuan Pablo Salas HurtadoAinda não há avaliações
- Libro PDFDocumento226 páginasLibro PDFVladimir Morales C100% (4)
- Nutrición AnimalDocumento12 páginasNutrición AnimalMax Jhon Arias BaspineiroAinda não há avaliações
- CiudadDocumento2 páginasCiudadMax Jhon Arias BaspineiroAinda não há avaliações
- 06 Capitulo1Documento16 páginas06 Capitulo1Max Jhon Arias BaspineiroAinda não há avaliações
- Trabajo DiseñoDocumento60 páginasTrabajo DiseñoMax Jhon Arias BaspineiroAinda não há avaliações
- Capitulo IDocumento9 páginasCapitulo IMax Jhon Arias BaspineiroAinda não há avaliações
- Carga y Descarga Del CondensadorDocumento10 páginasCarga y Descarga Del CondensadorMax Jhon Arias BaspineiroAinda não há avaliações
- Ejercicios ElectroDocumento45 páginasEjercicios ElectroKevin Roberto Damas AguilarAinda não há avaliações
- 6ta Practica ElectrotecniaDocumento2 páginas6ta Practica ElectrotecniaMax Jhon Arias BaspineiroAinda não há avaliações
- Trans From AdoresDocumento4 páginasTrans From AdoresMax Jhon Arias BaspineiroAinda não há avaliações
- Var Resistencia TemperaturaDocumento5 páginasVar Resistencia TemperaturaJavier Fuentes HuertasAinda não há avaliações
- Tablas de Cobre Tipo MDocumento11 páginasTablas de Cobre Tipo MPablo Ramos GarciaAinda não há avaliações
- Nomenclatura de Aceros RDocumento6 páginasNomenclatura de Aceros Rkristianvinicio100% (1)
- 43 Consejos de Las Mujeres para Los Hombres PDFDocumento72 páginas43 Consejos de Las Mujeres para Los Hombres PDFAntoni Juan67% (3)
- VELCORINDocumento13 páginasVELCORINMax Jhon Arias BaspineiroAinda não há avaliações
- Ensamblaje 2Documento1 páginaEnsamblaje 2Max Jhon Arias BaspineiroAinda não há avaliações
- Calderas Tesis Universidad SN Carlos GuatemalaDocumento193 páginasCalderas Tesis Universidad SN Carlos GuatemalaRoberto Barboza100% (1)
- Chikung PDFDocumento8 páginasChikung PDFBonilla ChristianAinda não há avaliações
- Acuicultura en BoliviaDocumento54 páginasAcuicultura en Boliviafofaflor50% (2)
- Nom 020 Stps 2011 Recipientes Sujetos A Presin Recipientes Criognicos y Generadores de Vapor o Calderas Funcionamiento Condiciones de SeguridadDocumento55 páginasNom 020 Stps 2011 Recipientes Sujetos A Presin Recipientes Criognicos y Generadores de Vapor o Calderas Funcionamiento Condiciones de SeguridadEverardo Valdez GonzalezAinda não há avaliações
- MICROBIOLOGIADocumento26 páginasMICROBIOLOGIAJuan Alberto Espinoza AlconAinda não há avaliações
- Tarea 3 - Propiedades Quimicas Del Suelo - Luceni MarinDocumento7 páginasTarea 3 - Propiedades Quimicas Del Suelo - Luceni Marintulia carabaliAinda não há avaliações
- Clase #8 Atención Integral Del Recien NacidoDocumento24 páginasClase #8 Atención Integral Del Recien NacidoRenzo Tacuri Segovia100% (1)
- Investigacion Operativa I - Practica #1 - ADMDocumento1 páginaInvestigacion Operativa I - Practica #1 - ADMisraelAinda não há avaliações
- Análisis de La Cultura Organizacional GLORIADocumento3 páginasAnálisis de La Cultura Organizacional GLORIAPérou AppleAinda não há avaliações
- TB-M01 Manual de TecnovigilanciaDocumento38 páginasTB-M01 Manual de TecnovigilanciaJavi Armando SalamancaAinda não há avaliações
- Origen Homo SapiensDocumento13 páginasOrigen Homo Sapiensapi-255562403Ainda não há avaliações
- Para Enamorar A RuthDocumento13 páginasPara Enamorar A RuthAndenes CHILLITUPAAinda não há avaliações
- Drenaje de Suelos y Estructuras Con El Filtro PAVITEX Ver1Documento57 páginasDrenaje de Suelos y Estructuras Con El Filtro PAVITEX Ver1ginna_76Ainda não há avaliações
- Criterios para Definir El Diámetro de Acometida y MedidorDocumento10 páginasCriterios para Definir El Diámetro de Acometida y MedidorDavid NeiraAinda não há avaliações
- Ficha Técnica Instalacion Pasto en RolloDocumento7 páginasFicha Técnica Instalacion Pasto en RolloMicky Hernandez VelizAinda não há avaliações
- Principios de DiseñoDocumento30 páginasPrincipios de DiseñoMilu SalazarAinda não há avaliações
- La Industria de La MaderaDocumento16 páginasLa Industria de La MaderaMarjorie Pame Solano BuenoAinda não há avaliações
- 6.paquimetría CornealDocumento32 páginas6.paquimetría CornealFrancisca Valentina Morales80% (5)
- Catasetum PileatumDocumento3 páginasCatasetum PileatumNess IbarraAinda não há avaliações
- Taller de FQ-Amb-GasesDocumento4 páginasTaller de FQ-Amb-GasesmaiAinda não há avaliações
- Luminotecnia 133 Julio-Agosto 2016Documento69 páginasLuminotecnia 133 Julio-Agosto 2016etolockaAinda não há avaliações
- Ejercicios Genética Mendeliana IDocumento2 páginasEjercicios Genética Mendeliana IGilda Oyuela IzaguirreAinda não há avaliações
- Puente de TacomaDocumento3 páginasPuente de TacomaRicardo Armando Arenales MínchezAinda não há avaliações
- Sistemas de EcuacionesDocumento5 páginasSistemas de EcuacionesAndrès SolizAinda não há avaliações
- Perls Hefferline y Goodman - Excitacion y Crecimiento de La Personalidad Humana - CompletoDocumento586 páginasPerls Hefferline y Goodman - Excitacion y Crecimiento de La Personalidad Humana - CompletoVelse Maria Leon100% (8)
- TEMA No.5 BALANZA DE PAGOSDocumento4 páginasTEMA No.5 BALANZA DE PAGOSJosmir GarciaAinda não há avaliações
- MatemáticaDocumento13 páginasMatemáticaCarolina SerranoAinda não há avaliações
- Infografía. Linea de Tiempo. Juan Fernandez.Documento10 páginasInfografía. Linea de Tiempo. Juan Fernandez.juanAinda não há avaliações
- Ejercicio de Costos2010-1Documento4 páginasEjercicio de Costos2010-1Jose Luis ChicllaAinda não há avaliações
- Certificaciones MinisplitDocumento3 páginasCertificaciones MinisplitAna Karen Escalante PalaciosAinda não há avaliações
- Canals VidalDocumento7 páginasCanals VidalDavid AgustínAinda não há avaliações
- "Entremuros, - Las Prisiones en La Transacción Democrática-" de Xavier Cañadas GascónDocumento156 páginas"Entremuros, - Las Prisiones en La Transacción Democrática-" de Xavier Cañadas GascónLibertaria Práxedis GuerreroAinda não há avaliações
- Metodo de Las DovelasDocumento6 páginasMetodo de Las DovelasMonica Stephanie67% (3)
- Tratados Suscritos Por HondurasDocumento8 páginasTratados Suscritos Por HondurasFranklin Nuñez100% (3)