Escolar Documentos
Profissional Documentos
Cultura Documentos
Evaluación y Ejercicios
Enviado por
edgaranibalDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Evaluación y Ejercicios
Enviado por
edgaranibalDireitos autorais:
Formatos disponíveis
EVALUACIN Y EJERCICIOS CAPITULO 4 Y5
Presentado por:
VILMA ROMERO VEGA
CODIGO: 1.006.405.033
Tutor:
Ing. HERNAN RAUL CASTRO
UNIVERSIDAD NACIONAL ABIERTA Y A DISTANCIA UNAD
INGENIERIA INDUSTRIAL
QUIMICA GENERAL
YOPAL
2013
EVALUACION GENERAL DE SOLUCIONES
1) teniendo en cuenta las principales leyes de las soluciones, el soluto, por lo general es
una sustancia que:
a) se encuentra en mayor cantidad
b) Se encuentra en menor cantidad
c) Se encuentra en igual cantidad en la mezcla.
d) Presenta una excelente solubilidad
2) Teniendo en cuenta el siguiente cuadro:
Sustancia 20
o
C 40
o
C 60
o
C
A 5 10 25
B 5 2 10
C 10 5 2
Siguiendo las leyes de las soluciones, con respecto al grado de solubilidad de los
solutos. Se puede establecer que:
a) El soluto A es slido
b) El soluto B es Slido
c) El soluto C es slido
d) Todos los solutos son slidos
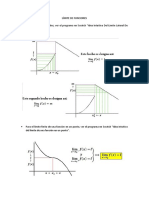
3) En la siguiente grfica de solubilidad de soluciones:
A temperatura de 20
o
C, la sustancia de mayor solubilidad es:
a) Clorato de sodio
b) Nitrato de potasio
c) Sulfato de cobre
d) Cloruro de sodio
5) Segn el cuadro anterior, la temperatura en la cual se disuelve la misma cantidad de
ms de dos solutos al mismo tiempo es:
a) 57 y 27
b) 37 y 47
c) 20 y 30
d) 40 y 50
6) teniendo en cuenta el grafico, si se mezclan 30 gramos de todos los solutos a una
temperatura de 30
o
C, lo ms seguro es al final:
a) Precipite clorato de sodio y nitrato de potasio
b) Precipite cloruro de sodio y clorato de sodio.
c) Precipite sulfato de potasio y sulfato de cobre
d) No precipite ninguno de los solutos
7) Al agregar 20 gramos de sulfato de potasio en 100 gramos de agua y calentar hasta
20
o
C, se puede determinar que:
a) Se pueden separar por filtrados 20 gramos de soluto
b) Se pueden separar por filtrado 10 gramos de soluto
c) Se pueden separar por filtrados 5 gramos de soluto
d) No se puede separar por filtrado nada de soluto.
8) En un recipiente de 500 mlts hay una solucin 2M de cloruro de sodio, si un
estudiante de la UNISANGIL, toma una muestra de 100 mlts, y lo lleva a un baln
aforado de 250 mlts y completa con agua hasta el aforo. La nueva solucin tendr una
concentracin de:
a) 0,6M
b) 0,8M
c) 0,5M
d) 0,3M
9) De la solucin inicial anterior, se sacaron 50 cm
3
y se llevaron a una capsula de
porcelana donde se evaporaron 40 cm
3
y posteriormente se llevaron a un baln aforado
de 200 ml donde se completo con agua hasta el aforo. La nueva concentracin ser:
a) 0,6M
b) 0,7M
c) 0,4M
d) 0,5M
10) En 300 mls de una solucin de alcohol etlico con una concentracin al 20% en
volumen se agregan 5 mls mas de alcohol puro, la nueva concentracin en % volumen
a volumen ser:
a) 25%
b) 15%
c) 21%
d) 23%
11) Si se quieren preparar 250 mls de una solucin 3M de acido actico, es necesario
agregar al baln aforado de 250:
a) 2 mol de cido
b) 1,5 moles de cido
c) 0,75 moles de cido
d) 0,2 moles de cido
12) Una solucin al 20% en peso de cloruro de sodio en agua, tiene un valor en fraccin
molar de soluto de:
a) 0,06
b) 0,03
c) 0,05
d) 0,07
13) La mezcla de arena en agua es un ejemplo claro de:
a) Solucin homognea
b) Solucin heterognea
c) Solucin saturada
d) Solucin sobresaturada.
14) La cantidad de cierto soluto de glucosa C
6
H
12
O
6
qu se debe agregar a 600
gramos de agua para subir su temperatura de ebullicin a 105
o
C es
a) 345 grs
b) 958 grs
c) 1038grs
d) 756 grs
15) La concentracin de la solucin de Al(NO
3
)
3
Producida al reaccionar 450 cm
3
de
HNO
3
2M con 350 cm
3
Al(OH)
3
1,5 M si el contenido se lleva a un recipiente de 1500
cm
3
y se completa con agua es:
a) 0,3M
b) 0,2M
c) 0,5M
d) 0,6M
16) se tiene una solucin al 20% peso a peso, de cido actico (CH
3
-COOH) la fraccin
molar de dicha solucin es:
a) 0,03
b) 0,3
c) 0,32
d) 0,070
17) Si la densidad de la solucin anterior es de 1,23 gr/cm
3
, la molaridad de la solucin
anterior es de:
a) 2,05M
b) 6,02M
c) 3,02M
d) 4,07M
18) teniendo en cuenta lo anterior la molalidad de la solucin sera de
a) 1,8m
b) 3,45m
c) 3,75m
d) 2,34m
EJERCICIOS CAPITULO CUATRO
1. Cul de los siguientes trminos no cambia cuando se diluye una solucin.
a. Molaridad
b. Molalidad
c. % de masa del soluto
d. Nmero total de moles del soluto
e. Nmero total de moles del soluto y el solvente
2. Cul es el porcentaje en masa de cada una de las siguientes soluciones?:
a. 25 g de NaBr + 100 g de H2O
25 g + 100 g = 125 g
%PP = masa del soluto *100
Masa de solucin
%PP = 25 g *100 = 20%
125 g
b. 1,20 g de CaCO3 + 100 g de H2O
1,20 g + 100 g = 101,2 g
%PP = 1,20 g * 100 = 1.19%
101,2 g
3. Cuntos gramos de una solucin de AgNO3 al 12,5% en masa contiene 15 g de
AgNO3?
Despejamos de la frmula principal, Masa de solucin, desarrollando el ejercicio de la
siguiente manera:
m(solucin) = 15 g * 100% = 120 g
12.5%
4. Cul es el porcentaje en volumen de una solucin preparada con 10 ml de metanol
disuelto en agua hasta un volumen de 40 ml?
%V V= volumen soluto *100
volumen solucin
% V V = 10 ml *100 = 25 %
40 ml
5. Se prepara una solucin que contiene 6 g de soluto en 500 cm3 de solucin. Expresar su
concentracin en: % m/V
%PV= masa soluto *100
Volumen solucin
%PV = 6 g *100 = 1.2 %
500 cm3
6. Una muestra de agua de mar contiene 15 g de NaCl en 300 g de Agua. Expresar su
concentracin en:
a. % m/m 15g + 300g = 315g
%PP = 15 g *100 = 4.7%
315 g
b. ppm 15g = 15000 ml 315g = 0.315 Kg
ppm= ml(sto) ppm = 15000 = 47 619 ppm
Kg(solucion) 0.315
7. Cuntos gramos de Na2SO4 se necesitan para preparar 250 ml de una solucin 2M?
M = moles de soluto moles de soluto = M
V(solucin) V(solucin)
De la ecuacin despejamos moles de soluto que es lo que vamos a hallar:
Moles de soluto = 2moles/Litro = 8 moles* 142 g = 1136 g
0.25 Litro 1 mol de Na2SO4
8. Cuntos gramos de NaOH debern utilizarse para obtener 1 litro de solucin 0,25 M?
Realizamos el mismo procedimiento del punto anterior.
Moles de soluto = 0.25 moles/litro = 0.25 moles * 40 g = 10 g
1 litro 1 mol de NaOH
EJERCICIOS CAPITULO CINCO
Seleccin mltiple de mltiple respuesta.
Dos respuestas
1. Una micela es:
a. Una partcula de las dispersiones
b. Una partcula cargada elctricamente
c. agregado de molculas hasta un tamao coloidal
d. una forma de separar los coloides.
2. Los coloides se caracterizan por:
a. Ser mezclas heterogneas
b. Ser mezclas homogneas
c. Sus partculas tiene un tamao mayor que el de las soluciones
d. Sus partculas tienen un tamao menor que el de las soluciones
3. El movimiento browniano.
a. Es un movimiento desordenado de las partculas
b. Permite la estabilidad el coloide
c. Permite que las partculas coloidales se precipiten
d. No deja que las soluciones verdaderas sean retenidas por filtros ordinarios
nica respuesta
4. una propiedad importante para la estabilidad del coloide porque impide que las
partculas coloidales se precipiten, es:
a. Dilisis
b. Sinresisc.
c. Movimiento Brownianod.
d. Efecto Tyndall
Você também pode gostar
- Tutor y CompañerosDocumento3 páginasTutor y CompañerosedgaranibalAinda não há avaliações
- Objetivo GeneralDocumento1 páginaObjetivo GeneraledgaranibalAinda não há avaliações
- Estado Del ArteDocumento2 páginasEstado Del ArteedgaranibalAinda não há avaliações
- Ingredient EsDocumento1 páginaIngredient EsedgaranibalAinda não há avaliações
- Mentefacto GemDocumento1 páginaMentefacto GemedgaranibalAinda não há avaliações
- 28 TC1Documento14 páginas28 TC1edgaranibalAinda não há avaliações
- Aplicación de La Metodología para La Gestión de Proyectos Desarrollada Por Project Management Institute PMIDocumento15 páginasAplicación de La Metodología para La Gestión de Proyectos Desarrollada Por Project Management Institute PMIedgaranibalAinda não há avaliações
- Ejercicio 5Documento1 páginaEjercicio 5edgaranibalAinda não há avaliações
- Act 4Documento4 páginasAct 4edgaranibalAinda não há avaliações
- Actividad Inicial IEDocumento2 páginasActividad Inicial IEedgaranibalAinda não há avaliações
- Guia Calculo UnadDocumento4 páginasGuia Calculo UnadmontoyaduvanAinda não há avaliações
- Mentefacto GemDocumento1 páginaMentefacto GemedgaranibalAinda não há avaliações
- Mapa Conceptual I.IDocumento3 páginasMapa Conceptual I.IedgaranibalAinda não há avaliações
- Aporte T. C - 2 Programación LínealDocumento5 páginasAporte T. C - 2 Programación LínealedgaranibalAinda não há avaliações
- Notas ProbabilidadDocumento2 páginasNotas ProbabilidadedgaranibalAinda não há avaliações
- Act 11 ErgoDocumento19 páginasAct 11 ErgoedgaranibalAinda não há avaliações
- Final Costos y PresupuestoDocumento32 páginasFinal Costos y PresupuestoedgaranibalAinda não há avaliações
- Analisis de ResultadosDocumento1 páginaAnalisis de ResultadosedgaranibalAinda não há avaliações
- Tuer CasDocumento1 páginaTuer CasedgaranibalAinda não há avaliações
- Diagrama Del Proceso Productivo Del Cemento PortlandDocumento1 páginaDiagrama Del Proceso Productivo Del Cemento Portlandedgaranibal100% (3)
- Mentefacto GemDocumento1 páginaMentefacto GemedgaranibalAinda não há avaliações
- Proceso de Fabricación de CementoDocumento2 páginasProceso de Fabricación de CementoedgaranibalAinda não há avaliações
- Edgar Anibal Angel Rojas 332571 62Documento25 páginasEdgar Anibal Angel Rojas 332571 62edgaranibalAinda não há avaliações
- Unidad IV - Costosi.fondo Editor 2008 IDocumento34 páginasUnidad IV - Costosi.fondo Editor 2008 IedgaranibalAinda não há avaliações
- Evaluacion General de SolucionesDocumento2 páginasEvaluacion General de SolucionesedgaranibalAinda não há avaliações
- Trabaj - Colaborativo N°3Documento29 páginasTrabaj - Colaborativo N°3edgaranibalAinda não há avaliações
- Act. 6 Trabajo Colaborativo No.1 2013 InterDocumento4 páginasAct. 6 Trabajo Colaborativo No.1 2013 InteroscarcopeteAinda não há avaliações
- Act 10 Trabajo Colaborativo 2 Guia de Actividades 2Documento5 páginasAct 10 Trabajo Colaborativo 2 Guia de Actividades 2Alex GarzonAinda não há avaliações
- Edgar Anibal Angel Actividad DosDocumento8 páginasEdgar Anibal Angel Actividad DosedgaranibalAinda não há avaliações
- Ejercicios Teoría ElectromagneticaDocumento17 páginasEjercicios Teoría ElectromagneticaJose Manuel Caldera100% (1)
- Transistor Emisor ComúnDocumento11 páginasTransistor Emisor ComúnMario RojasAinda não há avaliações
- 2 Da CONVxssf OCATORIAAUXILIARESDEINVESTIGACION2017Documento2 páginas2 Da CONVxssf OCATORIAAUXILIARESDEINVESTIGACION2017Gary Edson Flores CoroAinda não há avaliações
- El TeodolitoDocumento9 páginasEl TeodolitoGamaliel Sagûì DelgadoAinda não há avaliações
- Trabajo Mecánico en FrioDocumento5 páginasTrabajo Mecánico en FrioMauricio ArguelloAinda não há avaliações
- Refrigerante Power PointDocumento6 páginasRefrigerante Power PointwilsonAinda não há avaliações
- Informe 1 EdafoDocumento15 páginasInforme 1 EdafoMartha Zevallos75% (12)
- Estado Plano de DeformacionesDocumento3 páginasEstado Plano de DeformacionesJuan Carlos Tacay ClaudioAinda não há avaliações
- Análisis I. Propuesta de LaboratorioDocumento4 páginasAnálisis I. Propuesta de LaboratorioAngie100% (1)
- Parcial Estadistica IDocumento4 páginasParcial Estadistica ISantiagoAinda não há avaliações
- Teorema Fundamental de La ProporcionalidadDocumento6 páginasTeorema Fundamental de La ProporcionalidadNicole Schliebener TobarAinda não há avaliações
- Reporte Matrícula BD NormalizadaDocumento8 páginasReporte Matrícula BD Normalizadaabiuroldan25% (4)
- Metabolismo BacterianoDocumento8 páginasMetabolismo BacterianoronconcocacolaAinda não há avaliações
- Producción de Ondas Electromagnéticas Por UnaantenaDocumento2 páginasProducción de Ondas Electromagnéticas Por UnaantenaMiguel Eduardo Luna PalafoxAinda não há avaliações
- Norma INEN 0 60 - 1975Documento9 páginasNorma INEN 0 60 - 1975sisapakariAinda não há avaliações
- BE B13 IsoprenoidesDocumento35 páginasBE B13 IsoprenoidesMar Carrasco CarrascoAinda não há avaliações
- Manual Instalacion MHCDocumento7 páginasManual Instalacion MHCjemeaiAinda não há avaliações
- Límite de Funciones (Alumnos)Documento7 páginasLímite de Funciones (Alumnos)beatriz galindoAinda não há avaliações
- Aplicaciones termodinámica ingenieríaDocumento4 páginasAplicaciones termodinámica ingenieríamariAinda não há avaliações
- CromoDocumento11 páginasCromoDaniel Cabrera GarciaAinda não há avaliações
- Documento FinalDocumento17 páginasDocumento FinalRDario Dario RosemaryAinda não há avaliações
- Yacimientos Residuales y de Origen SupergenicoDocumento20 páginasYacimientos Residuales y de Origen SupergenicoFranz Diaz BuenoAinda não há avaliações
- Obtención de aceite esencial de lavandaDocumento1 páginaObtención de aceite esencial de lavandaYanet RosarioAinda não há avaliações
- NCh2588 2 2001 PDFDocumento11 páginasNCh2588 2 2001 PDFRodrigo Córdova100% (1)
- Trabajo Electrotecnia I-2016 Nuevo Tema 1Documento17 páginasTrabajo Electrotecnia I-2016 Nuevo Tema 1Jefferson Leonel Cesar JuarezAinda não há avaliações
- Guía de Color RGB y CMYK para ImprentaDocumento10 páginasGuía de Color RGB y CMYK para Imprentacapitan barreraAinda não há avaliações
- AUSCULTACIÓN DINÁMICA CON EL CONO TIPO PECK (ACPDocumento6 páginasAUSCULTACIÓN DINÁMICA CON EL CONO TIPO PECK (ACPMhario Yhomona ShilvaAinda não há avaliações
- Formacion para El Transporte de Mercancias PeligrosasDocumento49 páginasFormacion para El Transporte de Mercancias PeligrosasJavier GonzAinda não há avaliações
- Estudi ArDocumento24 páginasEstudi ArCliber Gim Sq ShAinda não há avaliações
- Practica 5Documento11 páginasPractica 5Nerlii JocelynAinda não há avaliações