Escolar Documentos
Profissional Documentos
Cultura Documentos
Enzimas PDF
Enviado por
Scribd_is_GreatTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Enzimas PDF
Enviado por
Scribd_is_GreatDireitos autorais:
Formatos disponíveis
ACTIVIDADE ENZIMTICA
Colgio Paulo VI
Ana Clara n1
Ana Filipa n2
10A
Gondomar, Maio de 2002
Tcnicas Laboratoriais de Biologia I
2
3
NDI CE
1. INTRODUO 5
2. FUNDAMENTO TERICO 6
2.1. Como actuam as enzimas? 6
2.2. Actividade dentro e fora das clulas 7
2.3. Eficcia elevada 8
2.4. Modelos de actuao das enzimas 8
2.4.1. Modelo de Fischer ou da Chave Fechadura 8
2.4.2. Modelo de Koshland ou do Encaixe Induzido 8
2.5. Co-factores 9
2.6. Inibio enzimtica 10
2.6.1. Inibio competitiva 10
2.6.2. Inibio no competitiva ou alostrica 10
2.7. Factores que afectam a actividade enzimtica 11
2.7.1. Temperatura 11
2.7.2. pH 11
2.7.3. Concentrao da enzima 11
2.7.4. Concentrao do substrato 12
2.7.5. Efectores 12
2.7.6. Co-factores 12
2.8. Classificao das enzimas 12
3. PROCEDIMENTO EXPERIMENTAL 14
3.1. Experincia 1 Biocatalisadores (enzimas) 14
3.2. Experincia 2 Influncia da concentrao do substrato
na actividade enzimtica 14
3.3. Experincia 3 Influncia da temperatura na actividade enzimtica 15
3.4. Experincia 4 Influncia do pH na actividade enzimtica 15
4. RESULTADOS 17
4.1. Experincia 1 Biocatalisadores (enzimas) 17
4.2. Experincia 2 Influncia da concentrao do substrato
na actividade enzimtica 18
4.3. Experincia 3 Influncia da temperatura na actividade enzimtica 19
4.4. Experincia 4 Influncia do pH na actividade enzimtica 20
Pgina
4
5. CONCLUSO 21
5.1. Experincia 1 Biocatalisadores (enzimas) 21
5.2. Experincia 2 Influncia da concentrao do substrato
na actividade enzimtica 21
5.3. Experincia 3 Influncia da temperatura na actividade enzimtica 21
5.4. Experincia 4 Influncia do pH na actividade enzimtica 22
6. BIBLIOGRAFIA 23
5
1. INTRODUO
Nos seres vivos ocorrem continuamente sries de reaces qumicas, idnticas s que se
realizam em laboratrios. Quando estas reaces se realizam em laboratrios, s ocorrem a
altas temperaturas, sob a aco de descargas elctricas ou outras formas de energia a que os
seres vivos no podem resistir. Por isso, as reaces que ocorrem nos organismos no podem
ser violentas, o que se consegue devido existncia de biocatalisadores, ou catalisadores
biolgicos, entre os quais ocupam lugar destacado as enzimas.
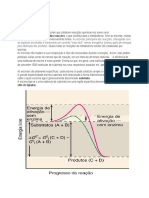
Uma enzima um catalisador que aumenta a taxa de uma reaco qumica. Facilita a
formao de determinadas ligaes, para quebrar outras, e a enzima reduz sempre a
quantidade de energia necessria para iniciar a reaco, isto , baixa a energia de activao.
Muitas enzimas so altamente especficas e promovem s um tipo de reaco.
Nas reaces qumicas que ocorrem, por exemplo, no corpo humano so necessrias
mais de 2000 espcies de enzimas. As enzimas no so alteradas pela reaco e podem ser
sucessivamente usadas para iniciar a mesma reaco.
As reaces bioqumicas, em virtude de se processarem a temperaturas relativamente
baixas no organismo, necessitam da presena de enzimas. Uma molcula de uma enzima pode
facilitar a realizao de mais de 100 000 reaces idnticas por segundo. Reaces que, no
exterior do organismo, em condies naturais, podem demorar anos a completar-se podem
ocorrer em alguns segundos quando catalisadas por enzimas.
Uma enzima uma protena globular (exceptuam-se certas molculas de ARN que
actuam como enzimas). Muitas no so activas se no estiverem ligadas a um cofactor, que ou
um io (por exemplo, cobre, ferro, magnsio ou outros "minerais" da dieta alimentar) ou uma
molcula orgnica (muitas vezes uma vitamina).
Neste trabalho vamos estudar a actividade enzimtica, dando especial importncia aos
factores que a afectam, tais como a temperatura, o pH, a concentrao de substrato e a
concentrao de enzima.
6
2. FUNDAMENTO TERICO
A vida celular est dependente de uma complexa rede de reaces de natureza
bioqumica, que em cada instante ocorrem nas clulas. Ao conjunto de todas estas reaces, de
anabolismo (reaces que envolvem snteses) e de catabolismo (reaces de anlise),
endergnicas e exergnicas, que decorrem ordenadamente damos o nome de metabolismo.
A maioria dos compostos qumicos presentes nas clulas normalmente estvel quando
em soluo aquosa e nas condies de presso, temperatura e pH existentes nas clulas; assim
sendo, as reaces biolgicas seriam pouco espontneas e lentas, o que tornaria impossvel a
existncia da vida com as caractersticas que hoje lhe conhecemos.
De que modo conseguem ento as clulas activar os milhares de reaces indispensveis
ao seu funcionamento?
Esse poder misterioso reside no facto de as clulas conterem protenas de estrutura
globular, as enzimas, que actuam como catalisadores biolgicos (biocatalisadores) e se
caracterizam pela sua especialidade relativamente a cada reaco ou tipo de reaco.
2.1. COMO ACTUAM AS ENZIMAS?
Apesar de o perxido de hidrognio, em condies normais de presso e temperatura,
no se decompor ou ento decompor-se muito lentamente, verifica-se que a sua decomposio
decorre em poucos segundos quando submetido aco do dixido de mangans
(catalisador inorgnico) ou da catalase presente nas clulas.
A catalase, tal como todas as enzimas, actua como um catalisador. As enzimas so, pois,
catalisadores orgnicos ou biocatalisadores.
Na sua qualidade de catalisadores, as enzimas apenas catalisam reaces que sejam
possveis mesmo na sua ausncia, no podendo de algum modo desencadear reaces que no
sejam j termodinamicamente viveis.
Note-se que a presena de enzimas no altera o valor da energia livre dos reagentes
nem doa produtos da reaco; elas limitam-se a aumentar a velocidade das reaces, pois
diminuem a energia livre de activao, facilitando assim a reaco.
Contrariamente aos catalisadores inorgnicos, que so universais, as enzimas so
especficas relativamente ao substrato (substncia sobre a qual a enzima actua).
O grau de especificidade das enzimas varivel.
H enzimas com especificidade absoluta, pois actuam simplesmente sobre uma
substncia, e outras com especificidade relativa, visto actuarem sobre um grupo de
substncias. So exemplos das primeiras a urease, que actuam sobre a ureia, ou a amlase,
que actua sobre o amido, e das segundas as lipases, que actuam sobre diversos lpidos, ou as
proteases, que actuam sobre as protenas.
7
Para que uma enzima actue
necessrio que se ligue
temporariamente ao substrato,
formando o complexo activo
enzima-substrato; posteriormente
libertam-se os produtos da catlise
enzimtica, mantendo-se a enzima
inalterada.
As enzimas so protenas
globulares de grandes dimenses, relativamente s molculas do substrato. Este facto levou
os cientistas a admitir que apenas uma pequena zona da enzima estaria envolvida no processo
cataltico.
Efectivamente, est hoje estabelecido que s um pequeno
nmero de aminocidos da protena enzimtica tem relao directa
com a sua actividade; este conjunto de aminocidos directamente
envolvido no processo de catlise designa-se por centro activo,
stio activo ou local activo da enzima.
A estrutura do centro activo da enzima, que
tridimensional, resulta, pois, da sequncia dos aminocidos que
o constituem e determina a especificidade da enzima.
O centro activo da enzima tem duas zonas que lhe
permitem exercer a sua funo, isto :
- Reconhecer e estabelecer ligao com o substrato
- Catalisar as reaces
O nmero de centros activos de uma enzima varivel, mas muitas enzimas tm apenas
um stio activo.
Da ligao da enzima ao substrato resultam foras intermoleculares que provocam a
ruptura de ligaes qumicas ao nvel do substrato, facilitando, assim, a reaco.
2.2. ACTI VI DADE DENTRO E FORA DAS CLULAS
As enzimas normalmente actuam nos seres vivos dentro ou fora das clulas que as
produzem.
Mas mantm-se activas fora dos seres vivos, desde que mantidas em condies
ambientais idnticas.
Tal propriedade permite o estudo isolado de reaces qumicas que se provocam no
laboratrio em tubos de ensaio, desde que neles se introduzam os substratos e as respectivas
enzimas.
Fig. 1 Modelo de actuao de uma enzima
Fig. 2 Comparao entre a
dimenso da enzima e do
substrato
8
2.3. EFI CCI A ELEVADA
Verifica-se que todas as enzimas so altamente eficazes, isto , em concentraes muito
fracas, transformam grandes quantidades de substratos.
H geralmente uma desproporo muito grande entre a quantidade da enzima e a
quantidade de substrato transformada.
A eficcia das enzimas, quando obtidas no estado puro, geralmente expressa em taxa
absoluta de catlise: nmero de molculas de substrato transformadas por molcula de
enzima, num segundo. Para a maioria das reaces enzimticas, a ordem de grandeza de 10 a
1000 molculas de substrato transformadas por segundo e por molcula de enzima.
Algumas tm taxas absolutas de catlise ainda mais elevadas.
Assim, por exemplo, para a peroxdase catlase a taxa absoluta de 10
6
/s, ou seja, cada
molcula de peroxdase transforma 10
6
molculas de perxido de hidrognio (gua oxigenada)
em cada segundo:
Peroxdase
2H
2
O
2
2H
2
O + O
2
2.4. MODELOS DE ACTUAO DAS ENZI MAS
Com a finalidade de compreender a aco enzimtica, os cientistas tm-se servido de
modelos para explicar o mecanismo que permite a ligao de uma enzima ao respectivo
substrato.
2.4.1. Modelo de Fischer ou da Chave Fechadura
O primeiro modelo foi proposto pelo qumico alemo Emil Fischer, em 1890, e
normalmente conhecido por modelo chave-fechadura, pois pressupe que a enzima possui
uma estrutura rgida e permanente, a qual se ajusta o substrato, do mesmo modo que uma
chave se ajusta na respectiva fechadura.
O centro activo e o substrato tero formas complementares, havendo portanto um
encaixe perfeito.
A teoria de Fischer foi aceite durante mais de meio sculo, pois permitia explicar a
maioria dos fenmenos enzimticos, nomeadamente no que respeita especificidade das
enzimas. Porm, veio a mostrar-se incapaz de explicar um nmero considervel de anomalias
do funcionamento das enzimas.
2.4.2. Modelo de Koshland ou do Encaixe Induzido
Em 1958, Daniel Koshland props um novo modelo explicativo para a actuao
enzimtica, designado por modelo do encaixe induzido; segundo este modelo, a forma do
Fig.3 Modelo da chave-fechadura
9
centro activo da enzima no seria rgida mas sim induzida pelo substrato medida que este se
liga enzima, do mesmo modo que, como referia Koshland, a mo ao penetrar na luva induz
esta a alterar a sua forma.
A teoria de Koshland est hoje testada experimentalmente, tendo sido comprovada a
flexibilidade das molculas enzimticas e a induo da forma do stio activo, originada pelo
prprio substrato, que desempenha um papel fundamental na determinao da forma final da
enzima.
Segundo este modelo as enzimas surgem, pois, como entidades naturalmente providas
de maleabilidade; embora no seja conhecido para cada enzima o seu grau de alterao
conformacional, admite-se a existncia de enzimas desprovidas de flexibilidade.
Uma das consequncias importantes deste conceito de enzima introduzido por Koshland
foi a ideia de que molculas no directamente implicadas na reaco enzimtica podiam induzir
alteraes na enzima, o que conduziu ao conceito de co-factor.
2.5. CO-FACTORES
As enzimas so protenas globulares constitudas por uma ou mais cadeias polipeptdicas.
Porm, muitas enzimas s tm funo cataltica na presena de componentes no
proteicos chamados co-factores.
O complexo enzima-cofactor designado por holoenzima; enzima separada do
respectivo co-factor chama-se apoenzima. Portanto:
Holoenzimas Apoenzima + Co-factor
H 3 tipos de co-factores:
- Grupos prostticos so compostos orgnicos no proteicos que se caracterizam por
estarem permanentemente ligados apoenzima. Exemplo: FAD flavina adenina
dinucletido.
- Co-enzima so igualmente compostos orgnicos, mas que no tm uma ligao
permanente apoenzima; a ligao s ocorre durante a catlise enzimtica. As co-
enzimas actuam frequentemente como transportadores de tomos ou electres. Muitas
vitaminas, o NAD
+
e o NADP
+
funcionam como co-enzimas.
- Ies metlicos exemplo: o Ca
2+
, o Mn
2+
ou o Cu
2+
actuam ao nvel do centro activo,
contribuindo para um melhor ajustamento do substrato enzima.
Nota: O FAD
+
, o NAD
+
e NADP
+
so importantes transportadores de electres que
intervm na respirao e fotossntese.
Fig.4 Modelo do encaixe induzido
10
2.6. INIBI O ENZI MTICA
Alguns mecanismos de controlo dos sistemas biolgicos actuam atravs da inibio da
actividade enzimtica por determinados metabolitos. Tambm muitas drogas e substncias
txicas provocam igualmente inibio enzimtica.
A inibio pode ser de dois tipos: competitiva e no competitiva.
2.6.1. Inibio competitiva
Neste tipo de inibio, uma
molcula estruturalmente semelhante
do substrato vai competir com este
para se ligar ao centro activo,
impedindo, portanto, a ligao da
enzima ao verdadeiro substrato.
Forma-se o complexo enzima-
inibidor, em vez do complexo enzima-
substrato.
Pensa-se que as sulfamidas,
medicamento utilizado para combater
certas infeces bacterianas, funcionam como inibidores competitivos relativamente a um
substrato (cido paraminobenzico), indispensvel ao desenvolvimento de determinadas
bactrias.
Normalmente, as bactrias fabricam o cido flico (vitamina fundamental para as
bactrias) a partir do cido paraminobenzico (PABA), sendo a reaco catalisada por uma
enzima bacteriana. A sulfamida, tendo uma estrutura parecida com a PABA, bloqueia a enzima,
impedindo a formao do complexo enzima-substrato e, portanto, a sntese de cido flico. Sem
este as bactrias no se multiplicam e a infeco controlada.
So ainda exemplos de inibio competitiva o que acontece com o envenenamento com
cianeto de potssio e com a morte na cmara de gs, em que o gs ciandrico bloqueia certas
enzimas da respirao celular.
2.6.2. Inibio no competitiva ou alostrica
Neste caso, o inibidor no tem uma estrutura idntica do substrato, actuando ao nvel
de um outro local da enzima,
distinto do centro activo o
centro alostrico. No h, pois,
competio entre o inibidor e o
substrato para ocupar o centro
activo. A inibio ocorre porque o
inibidor provoca uma alterao
conformacional na enzima,
impedindo ou dificultando a
ligao do substrato ao centro
Fig. 5 Modelo de uma inibio enzimtica competitiva
Fig. 6 Modelo de uma inibio enzimtica no-competitiva
11
activo. A inibio das enzimas das enzimas pode ser ainda irreversvel ou reversvel,
consoante a ligao que se estabelece entre o inibidor e a enzima ou no definitiva.
Na inibio irreversvel o inibidor est fortemente ligado enzima, dificultando a sua
dissociao da molcula enzimtica. o que acontece com a inibio provocada pelo gs
ciandrico.
Pelo contrrio, na inibio reversvel h uma rpida dissociao do complexo enzima-
inibidor, como se verifica no modo da actuao das sulfamidas e de alguns antibiticos.
2.7. FACTORES QUE AFECTAM A ACTIVIDADE ENZIMTICA
A actividade enzimtica pode ser afectada pelos seguintes factores:
- temperatura
- pH
- concentrao da enzima
- concentrao do substrato
- efectores
- co-factores
2.7.1. Temperatura
A temperatura interfere com a actividade enzimtica.
Em qualquer reaco enzimtica, a velocidade da reaco aumenta com a temperatura
at um determinado valor, a partir do qual diminui at se
anular.
A temperatura para a qual a actividade enzimtica
mxima designa-se por temperatura ptima.
Temperaturas baixas ou muito elevadas dificultam a
aco enzimtica, podendo as altas temperaturas destruir a
enzima por desnaturao da protena enzimtica.
Embora cada enzima tenha a sua temperatura ptima
de actuao, verifica-se que a maioria das enzimas tem a
temperatura ptima prxima da temperatura de muitos seres
vivos 35C a 40C.
2.7.2. pH
A alterao do pH do meio em que uma enzima actua interfere na actividade enzimtica,
pois provoca alteraes nas cargas elctricas do centro activo e do substrato.
Verifica-se, pois, que cada enzima tem um pH ptimo de actuao, havendo, portanto,
enzimas que tm a sua actividade mxima em meio cido como as do estmago, outras em
meio neutro como as da boca e outras em meio alcalino como as do duodeno.
2.7.3. Concentrao da enzima
Verifica-se que a velocidade de qualquer reaco enzimtica directamente proporcional
concentrao da enzima, desde que haja excesso de substrato durante a reaco.
Fig. 7 Variao da actividade
enzimtica em funo da
temperatura
12
2.7.4. Concentrao do substrato
Este um dos factores que mais fortemente influencia a actividade enzimtica.
Para baixas concentraes de substrato h uma relao directa entre o aumento da
concentrao do substrato e a velocidade de reaco.
Para maiores concentraes de substrato,
o aumento da velocidade passa a ser cada vez
menor e, a partir de determinada concentrao, a
velocidade estabiliza, mesmo que a concentrao
do substrato continue a aumentar.
Isto acontece porque todos os centros
activos das enzimas que catalisam a reaco
esto sempre ligados a molculas do substrato,
havendo assim saturao dos centros activos
das enzimas. A partir deste momento, a
quantidade de produto formado por unidade de
tempo (velocidade da reaco) constante. A
nica possibilidade de, neste caso, aumentar a
velocidade da reaco fazer aumentar a concentrao da enzima.
2.7.5. Efectores
So compostos qumicos que interferem na catlise enzimtica e que podem actuar, quer
activando, quer inibindo a reaco.
Enquanto os activadores orientam os grupos catalticos presentes no centro activo da
enzima, facilitando a formao do complexo enzima-substrato e acelerando assim a reaco, os
inibidores actuam impedindo a ligao do substrato enzima, o que obriga a diminuir a
velocidade da reaco.
possvel ultrapassar a aco dos inibidores competitivos aumentando a concentrao
do substrato.
Se a inibio se deve a inibidores no competitivos, mesmo aumentando a concentrao
do substrato, a inibio mantm-se por incapacidade das enzimas. Esta inibio s pode ser
ultrapassada fazendo aumentar a concentrao das enzimas, ou seja, substituindo as enzimas
inibidas por outras.
2.7.6. Co-factores
Sendo os co-factores molculas ou ies cuja presena indispensvel actuao da
enzima, a sua concentrao interfere na capacidade cataltica das mesmas.
2.8. CLASSIFICAO DAS ENZI MAS
Em 1883, Duclaux sugeriu que se denominassem as enzimas a partir do nome do
substrato sobre a qual actuam, acrescentando o sufixo ase.
Este sistema, devido sua simplicidade, ainda hoje utilizado: por exemplo, a amilase
actua sobre o amido, a urease sobre a ureia, etc..
Fig. 8 Velocidade de uma reaco enzimtica
em funo da concentrao do substrato
13
Por este tipo de classificao no ter sido sempre utilizado e, alm disso, no especificar
o tipo de transformaes que ocorrem durante a catlise, sentiu-se a necessidade de
uniformizar critrios de classificao. Nessa perspectiva, foi criada uma Comisso
Internacional de Enzimas que props, em 1961, um sistema de nomenclatura que j foi
revisto em 1965 e 1972.
Segundo este sistema, as enzimas so divididas em 6 grupos de acordo com o tipo de
reaco que catalisam, conforme ilustra o seguinte quadro:
Classificao das Enzimas
GRUPOS TIPO DE REACO CATALISADA
xido-redutases
Catalisam reaces de oxi-reduo, isto , reaces em que h transferncia
de electres ou de tomos de hidrognio ou de oxignio de uma molcula
para outra.
Tm particular importncia as desidrogenases e as oxidases.
Exemplo: AH
2
+ B A + BH
2
Transferases
Catalisam reaces em que h transferncia de um grupo especfico de uma
molcula para outra.
Exemplos: as transaminases e as fosforilases, que transferem,
respectivamente, grupos amina e fosfato inorgnico.
A B + C A + B C
(B grupo a transferir)
Hidrolases
Catalisam reaces de hidrlise, ou seja, o desdobramento de compostos por
reaco com a gua.
Exemplo: AB + H
2
0 AOH + BH
Liases
Catalisam reaces em que h adio ou remoo de um grupo qumico de
um substrato, sem hidrlise, originando geralmente uma dupla ligao.
Exemplo: a descarboxilase catalisa a remoo de CO
2
Isomerases
Catalisam rearranjos moleculares, com formao de ismeros.
Exemplo: glucose 6 fosfato frutose 6 fosfato
Ligases
Catalisam a sntese de 2 molculas, normalmente utilizando energia obtida
por hidrlise do ATP.
Exemplo: X + Y + ATP XY + ADP + Pi
14
3. PROCEDIMENTO EXPERIMENTAL
3.1. Experincia 1 Biocatalisadores (enzimas)
Material:
- pina
- bisturi
- fsforo
- esptula
- etiquetas
- 2 pipetas
- almofariz
- marcador
- areia fina
- fgado fresco
- 6 tubos de ensaio
- suporte para tubos de ensaio
- perxido de hidrognio (H
2
O
2
)
Procedimento:
1. Etiquetou-se os tubos de ensaio de A a F;
2. Colocou-se no tubo B um pouco de areia fina;
3. Colocou-se no tubo C um fragmento de fgado fresco;
4. Introduziu-se no tubo D uma pequena poro de fgado fresco, previamente triturado
com areia fina;
5. Adicionou-se 2 ml de perxido de hidrognio nos tubos A, B, C, D e E, intercalando
com a operao do passo 6;
6. Colocou-se um fsforo em brasa na boca de cada tubo e anotou-se o observado;
7. Registou-se a velocidade das reaces ocorridas em cada um dos tubos;
8. Aps ter deixado de se observar qualquer reaco no tubo D, dividiu-se o seu
contedo (incluindo o fgado) por dois tubos de ensaio (E e F);
9. Adicionou-se ao tubo E um pedao de fgado fresco;
10. Adicionou-se ao tubo F 1 ml de perxido de hidrognio;
11. Colocou-se um fsforo em brasa na boca de cada tubo e anotou-se o que se
observou;
12. Registou-se os resultados das reaces ocorridas em ambos os tubos.
3.2. Experincia 2 Influncia da concentrao do substrato na actividade enzimtica
Material:
- pina
- bisturi
- pipeta
- esptula
- etiquetas
- almofariz
- marcador
- areia fina
- fgado fresco
- 5 tubos de ensaio
- suporte para tubos de ensaio
- perxido de hidrognio (H
2
O
2
)
Procedimento:
1. Etiquetou-se os tubos de ensaio de A a E;
2. No tubo A introduziu-se 2 ml de perxido de hidrognio;
15
3. Adicionou-se ao tubo B um pouco de areia fina;
4. Nos tubo C, D e E colocou-se um fragmento de fgado fresco, previamente triturado
com areia fina;
5. Adicionou-se ao tubo C 2 ml de perxido de hidrognio;
6. Colocou-se um fsforo em brasa na boca do tubo e anotou-se o observado;
7. Repetiu-se a operao anterior (passos 5 e 6) deitando, desta vez, nos tubos D e E,
respectivamente, 4 e 6 ml de perxido de hidrognio.
3.3. Experincia 3 Influncia da temperatura na actividade enzimtica
Material:
- pina
- bisturi
- pipeta
- esptula
- etiquetas
- almofariz
- marcador
- areia fina
- fgado fresco
- fgado previamente cozido
- 4 tubos de ensaio
- suporte para tubos de ensaio
- perxido de hidrognio
- gelo
Procedimento:
1. Etiquetou-se tubos de ensaio de A a D;
2. Adicionou-se ao tubo B uma poro de fgado bem cozido;
3. Adicionou-se ao tubo C uma pequena poro de fgado fresco;
4. Ao tubo D adicionou-se uma poro de fgado fresco e colocou-se o tubo num gobel
com gelo;
5. Colocou-se 2 ml de perxido de hidrognio em cada tubo;
6. Colocou-se um fsforo em brasa na boca de cada tubo e registou-se o observado.
3.4. Experincia 4 Influncia do pH na actividade enzimtica
Material:
- pina
- bisturi
- pipeta
- esptula
- etiquetas
- almofariz
- marcador
- areia fina
- fgado fresco
- 6 tubos de ensaio
- suporte para tubos de ensaio
- perxido de hidrognio
- vinagre (cido actico)
- fita indicadora de pH
- conta-gotas
Procedimento:
1. Etiquetou-se os tubos de ensaio de A a F;
2. Adicionou-se ao tubo B um pouco de areia fina;
16
3. No tubos C, D, E e F colocou-se uma pequena poro de fgado fresco previamente
triturado com areia fina;
4. Com o auxlio de um conta-gotas deite duas gotas de vinagre no tubo D, 6 gotas no
tubo E e 18 gotas no tubo F;
5. Colocou-se 2 ml de perxido de hidrognio em todos os tubos;
6. Colocou-se um fsforo em brasa em todos os tubos e observou-se;
7. Comparou-se as velocidades da reaco em todos os tubos;
8. Mediu-se e registou-se o pH em cada um dos tubos com a fita indicadora.
17
4. RESULTADOS
4.1. Experincia 1 Biocatalisadores (enzimas)
Contedo Reaco
A
Perxido de hidrognio
(H
2
O
2
)
(Tubo de controle)
0
B
Areia fina
+
H
2
O
2
(Tubo de controle)
0
C
Fgado fresco
+
H
2
O
2
+++
D
Fgado triturado com areia
fina
+
H
2
O
2
++++
E
do contedo de C
+
Fgado fresco
0
F
do contedo de C
+
H
2
O
2
++
TIPO DE REACO CDIGO
Ausncia de reaco 0
Reaco muito lenta +
Reaco lenta ++
Reaco rpida +++
Reaco muito rpida ++++
18
4.2. Experincia 2 Influncia da concentrao do substrato na actividade enzimtica
Contedo Reaco
A
H
2
O
2
(Tubo de controle)
0
B
Areia fina
+
H
2
O
2
(Tubo de controle)
0
C
Fgado triturado
+
2 ml de H
2
O
2
++
D
Fgado triturado
+
4 ml de H
2
O
2
+++
E
Fgado triturado
+
6 ml de H
2
O
2
++++
TIPO DE REACO CDIGO
Ausncia de reaco 0
Reaco muito lenta +
Reaco lenta ++
Reaco rpida +++
Reaco muito rpida ++++
19
4.3. Experincia 3 Influncia da temperatura na actividade enzimtica
Contedo Reaco
A
H
2
O
2
(Tubo de controle)
0
B
Fgado cozido
+
H
2
O
2
+
C
Fgado fresco
+
H
2
O
2
+++
D
Fgado fresco
+
H
2
O
2
(no gobel com gelo)
+
TIPO DE REACO CDIGO
Ausncia de reaco 0
Reaco muito lenta +
Reaco lenta ++
Reaco rpida +++
Reaco muito rpida ++++
20
4.4. Experincia 4 Influncia do pH na actividade enzimtica
Contedo Reaco
A
H
2
O
2
(Tubo de controle)
0
B
Areia fina
+
H
2
O
2
(Tubo de controle)
0
C
Fgado fresco
+
H
2
O
2
++++
D
Fgado fresco
+
2 gotas de cido actico
+
H
2
O
2
+++
pH = 5
E
Fgado fresco
+
6 gotas de cido actico
+
H
2
O
2
++
pH = 4
F
Fgado fresco
+
18 gotas de cido actico
+
H
2
O
2
+
pH = 3
TIPO DE REACO CDIGO
Ausncia de reaco 0
Reaco muito lenta +
Reaco lenta ++
Reaco rpida +++
Reaco muito rpida ++++
21
5. CONCLUSO
5.1. Experincia 1 Biocatalisadores (enzimas)
Nos tubos A e B (respectivamente com H
2
O
2
e areia fina e H
2
O
2
) no houve reaco, pois
eram tubos de controle.
Atravs da observao das reaces ocorridas nos tubos C (fgado fresco e H
2
O
2
) e D
(fgado fresco triturado com areia fina e H
2
O
2
), concluiu-se que as clulas do fgado possuem
uma enzima (catalase) que desdobra o perxido de hidrognio (H
2
O
2
), sendo os produtos da
reaco gua (H
2
O) e oxignio (O
2
) a libertao de oxignio foi testada a partir da colocao
de um fsforo em brasa na boca do tubo. Nos tubos C e D verificou-se a libertao de O
2
(o
tamanho da chama aumentou).
No entanto, a reaco foi maior e mais rpida em D devido ao facto de o fgado ter sido
triturado. No tubo C s as enzimas das clulas superficiais da amostra de fgado fresco
catalisaram a reaco. No tubo D o contedo foi triturado, esmagando algumas clulas que
libertaram enzimas, e aumentando a superfcie de contacto. Assim, devido libertao das
enzimas e ao aumento da superfcie de contacto, aumentou a rapidez da reaco, j que um
maior nmero de enzimas estiveram em contacto com o substrato e, portanto, a catalisar a
reaco.
Nos tubos E e F colocou-se meia poro do contedo de C (substrato j catalisado). No
tubo E acrescentou-se mais uma poro de fgado, ou seja, aumentaram-se as enzimas. No se
registou nenhuma reaco, pois todo o substrato j tinha sido catalisado. No tubo F
acrescentou-se H
2
O
2
, ou seja, aumentou-se o substrato. Houve novamente reaco porque
ainda havia enzimas (as enzimas no se gastam) que catalisassem aquela nova quantidade de
substrato.
5.2. Experincia 2 Influncia da concentrao do substrato na actividade enzimtica
Nos tubos A e B (respectivamente com H
2
O
2
e areia fina e H
2
O
2
) no houve reaco, pois
eram tubos de controle.
Nos tubos C, D e E, todos com fgado fresco triturado, deitaram-se, respectivamente, 2,
4 e 6 ml de H
2
O
2
. No tubo C a velocidade da reaco foi menor, aumentando no tubo D, e
principalmente no E. Conclui-se assim que, quanto maior a concentrao de substrato, maior a
velocidade da reaco.
Em todos os tubos houve, pois, libertao de oxignio, identificada pelo aumento da
chama do fsforo quando colocado na boca de cada tubo.
Conclui-se, assim, que para baixas concentraes de substrato h uma relao directa
entre o aumento da concentrao do substrato e a velocidade de reaco.
5.3. Experincia 3 Influncia da temperatura na actividade enzimtica
No tubo A (com H
2
O
2
) no houve reaco, pois era um tubo de controle.
22
Ao deitar-se H
2
O
2
no tubo B (com fgado cozido), verificou-se que no houve reaco.
Isto aconteceu devido desnaturao da enzima (que uma protena) por aco do calor
excessivo. Se a enzima desnaturada, j no pode catalisar a reaco, logo, o substrato no
catalisado e no h reaco.
Ao deitar-se H
2
O
2
no tubo C (com fgado fresco triturado), verificou-se que a reaco
decorreu normalmente, porque a enzima no estava desnaturada, e estava a uma temperatura
propcia actividade enzimtica. Houve, pois, libertao de oxignio, identificada pelo aumento
da chama do fsforo quando colocado na boca do tubo.
Ao deitar-se H
2
O
2
no tubo D (com fgado fresco triturado), que estava dentro de um
gobel com gelo, verificou-se que houve reaco, mas muito inferior observada em C. Como o
tubo com a amostra de fgado estava num gobel com gelo, as enzimas presentes nas clulas
desta amostra ficaram inactivas devido baixa temperatura, logo, a velocidade de reaco foi
muito menor.
Conclui-se assim que a temperatura interfere com a actividade enzimtica.
Em qualquer reaco enzimtica, a velocidade da reaco aumenta com a temperatura
at um determinado valor, a partir do qual diminui at se anular.
Temperaturas baixas ou muito elevadas dificultam a aco enzimtica, podendo as altas
temperaturas destruir a enzima por desnaturao da protena enzimtica.
Para cada tipo de enzima existe uma temperatura ptima, que corresponde sua
actividade mxima.
5.4. Experincia 4 Influncia do pH na actividade enzimtica
Nos tubos A e B (respectivamente com H
2
O
2
e areia fina e H
2
O
2
) no houve reaco, pois
eram tubos de controle.
No tubo C a reaco decorreu normalmente. O pH no foi alterado, logo, as enzimas no
sofreram desnaturao e a reaco foi muito rpida. Houve, pois, libertao de oxignio,
identificada pelo aumento da chama do fsforo quando colocado na boca do tubo.
No tubo D a reaco foi mais lenta do que no tubo C. Devido adio de cido actico,
houve uma alterao de pH (pH = 5) e provavelmente, devido a essa alterao, algumas
enzimas se tenham desnaturado; logo, a reaco foi mais lenta e houve menos libertao de
oxignio.
No tubo E a reaco foi ainda mais lenta. A adio de cido actico foi maior, havendo,
por isso, uma maior alterao do pH (pH = 4). Devido a essa alterao, um maior nmero de
enzimas se desnaturaram; logo, a reaco foi mais lenta e houve menos libertao de oxignio.
No tubo F a reaco foi a mais lenta. Devido adio de uma maior quantidade de cido
actico, houve uma grande alterao do pH (pH = 3). Como consequncia dessa alterao,
grande parte das enzimas foi desnaturada; logo, a reaco foi muito lenta e houve pouca
libertao de oxignio.
Conclui-se, assim, que cada enzima tem o seu pH ptimo de actuao e que as variaes
bruscas de pH so um dos factores que muitas vezes condicionam a actividade das enzimas.
23
6. BI BLI OGRAFI A
- Oliveira, Elsa; Pedrosa, Carmen; Pires, Rosa; Do Big Bang Clula; 4 Edio;
Texto Editora; 2001; pgs. 293-305
- Palma, Slvia; Braz, Ndia; Quintas, Clia; Ferreira, Ana Maria; No Laboratrio
Bloco 1; 2 Edio; Areal Editores; 1999; pgs. 85-88
Recursos multimdia:
- Diciopdia 2002; Porto Editora
Você também pode gostar
- Prolactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoNo EverandProlactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoAinda não há avaliações
- 2003 10 13168 Cinética e Propriedades EnzimáticasDocumento16 páginas2003 10 13168 Cinética e Propriedades EnzimáticasJoice CruzAinda não há avaliações
- Catalisadores BiológicosDocumento6 páginasCatalisadores BiológicosCleiton Belizario NetoAinda não há avaliações
- 1T.Cinética Química - 3ºanoEM.1 Etapa.2022Documento28 páginas1T.Cinética Química - 3ºanoEM.1 Etapa.2022Iara DaherAinda não há avaliações
- Estudo BioquimicaDocumento2 páginasEstudo Bioquimicadayannealves83% (6)
- EnzimasDocumento6 páginasEnzimasana_s_freireAinda não há avaliações
- Questionário enzimas: Fatores e tipos de inibiçãoDocumento9 páginasQuestionário enzimas: Fatores e tipos de inibiçãoRaffael Batista MarquesAinda não há avaliações
- Enzimas e processos fermentativosDocumento20 páginasEnzimas e processos fermentativosMatheus BañosAinda não há avaliações
- Enzimas bioengenhariaDocumento45 páginasEnzimas bioengenhariadaviAinda não há avaliações
- EnzimaDocumento11 páginasEnzimaMaestro VandaAinda não há avaliações
- Enzimas e reações metabólicasDocumento8 páginasEnzimas e reações metabólicasNareida MonteiroAinda não há avaliações
- JOSEFDocumento10 páginasJOSEFAnime BaAinda não há avaliações
- Enzimas e Metabolismo CelularDocumento10 páginasEnzimas e Metabolismo CelularNelson Pombal100% (2)
- EnzimasDocumento205 páginasEnzimasPâmela CristinaAinda não há avaliações
- EnzimasDocumento3 páginasEnzimaslucas022tgAinda não há avaliações
- Extração e Caracterização de EnzimasDocumento4 páginasExtração e Caracterização de EnzimasjoandroengAinda não há avaliações
- Trabalho de Biologia Celular2Documento9 páginasTrabalho de Biologia Celular2Jose PintoAinda não há avaliações
- Enzimas e Cinética EnzimáticaDocumento37 páginasEnzimas e Cinética EnzimáticamonekobeAinda não há avaliações
- Biologia 11 Classe I Trimestre 22 23Documento31 páginasBiologia 11 Classe I Trimestre 22 23jobhunhajosiasmatucaAinda não há avaliações
- ENEM 2019 Biologia Semana 07Documento190 páginasENEM 2019 Biologia Semana 07BlochMeisterAinda não há avaliações
- As enzimas: proteínas que catalisam reações bioquímicasDocumento5 páginasAs enzimas: proteínas que catalisam reações bioquímicasAngelique ViannyAinda não há avaliações
- EnzimasDocumento9 páginasEnzimasIsabellyAinda não há avaliações
- Bixo SP Semana 07Documento227 páginasBixo SP Semana 07kethelyn IsadoraAinda não há avaliações
- EnzimasDocumento15 páginasEnzimasines oliveiraAinda não há avaliações
- Fermentação e Atividade EnzimáticaDocumento36 páginasFermentação e Atividade EnzimáticaTatiana OliveiraAinda não há avaliações
- Colégio CAT: Enzimas e Metabolismo CelularDocumento30 páginasColégio CAT: Enzimas e Metabolismo CelularQuiala José100% (2)
- Resumo Expandido Atividade EnzimaticaDocumento4 páginasResumo Expandido Atividade EnzimaticaALLANAAinda não há avaliações
- Reação enzimática com pimentão verdeDocumento5 páginasReação enzimática com pimentão verdevitória souzaAinda não há avaliações
- Introdução À EnzimologiaDocumento23 páginasIntrodução À EnzimologiaFrancisco Oliveira100% (2)
- Estudo sobre enzimasDocumento4 páginasEstudo sobre enzimasVictor S. CarvalhoAinda não há avaliações
- En ZimasDocumento60 páginasEn ZimasEricaAinda não há avaliações
- 10 Eeq 5506Documento5 páginas10 Eeq 5506leandrohillenAinda não há avaliações
- Apostila EnzimologiaDocumento57 páginasApostila EnzimologiaBárbara MarinhoAinda não há avaliações
- Fermentação alcoólica e láctica: processos biológicos catalisados por enzimasDocumento1 páginaFermentação alcoólica e láctica: processos biológicos catalisados por enzimasInês RibeiroAinda não há avaliações
- Enzimas - SilvanDocumento39 páginasEnzimas - SilvanSilvandeOliveira50% (2)
- Composição Química da Célula - Enzimas como Catalisadores BiológicosDocumento3 páginasComposição Química da Célula - Enzimas como Catalisadores BiológicoslaviniaAinda não há avaliações
- 04 ProteinasDocumento5 páginas04 ProteinasSamuelSamuelAinda não há avaliações
- Atividade da enzima invertase livre determinada em diferentes temperaturasDocumento12 páginasAtividade da enzima invertase livre determinada em diferentes temperaturasPauloAinda não há avaliações
- Enzimas: propriedades e fatores que influenciam sua atividadeDocumento7 páginasEnzimas: propriedades e fatores que influenciam sua atividadeAline PiresAinda não há avaliações
- História e propriedades das enzimasDocumento12 páginasHistória e propriedades das enzimaskaratedoAinda não há avaliações
- EnzimasDocumento5 páginasEnzimasIsleia GomesAinda não há avaliações
- 06 EnzimasDocumento14 páginas06 EnzimasMatheus MAinda não há avaliações
- Estudo Dirigido 1 - BQA 2Documento7 páginasEstudo Dirigido 1 - BQA 2Esther LaisAinda não há avaliações
- EnzimasDocumento4 páginasEnzimasAlvim AlbertoAinda não há avaliações
- Aula EnzimasDocumento66 páginasAula EnzimasStefânya de Paula FreitasAinda não há avaliações
- Enzimas: estrutura, funções, regulação e classificaçãoDocumento3 páginasEnzimas: estrutura, funções, regulação e classificaçãoNayara SantiagoAinda não há avaliações
- Trabalho de Enzimas PDFDocumento5 páginasTrabalho de Enzimas PDFanon_387426005Ainda não há avaliações
- Curso Enem - Enzimas e proteínas especiaisDocumento180 páginasCurso Enem - Enzimas e proteínas especiaisDavi LacerdaAinda não há avaliações
- Relatorio Cinética Enzimática Da InvertaseDocumento20 páginasRelatorio Cinética Enzimática Da InvertaseJoaninha Faria100% (2)
- Atividade enzimática e fatores que influenciamDocumento11 páginasAtividade enzimática e fatores que influenciamLaís CaladoAinda não há avaliações
- Resumo BioquimicaDocumento22 páginasResumo BioquimicaedgardAinda não há avaliações
- Estudo Comparativo Da Atividade Da Amilase em Detergente em Pó e em SalivaDocumento14 páginasEstudo Comparativo Da Atividade Da Amilase em Detergente em Pó e em SalivaFelipe Pimentel PaixãoAinda não há avaliações
- Cinética Enzimática da Fosfatase AlcalinaDocumento4 páginasCinética Enzimática da Fosfatase AlcalinaLetícia CastroAinda não há avaliações
- Enzimas: Visão Geral e ClassificaçãoDocumento4 páginasEnzimas: Visão Geral e ClassificaçãoDébora Rocha100% (1)
- Estudo DirigidoDocumento5 páginasEstudo DirigidoJosé Rivaldo SoaresAinda não há avaliações
- Exercicio Parte Conceitual Do Capítulo de Enzimas - Janssen 10-03-2020Documento3 páginasExercicio Parte Conceitual Do Capítulo de Enzimas - Janssen 10-03-2020Janssen JulioAinda não há avaliações
- Enzimas: Uma breve introdução às enzimasDocumento19 páginasEnzimas: Uma breve introdução às enzimasjackspolAinda não há avaliações
- Enzimas catalíticasDocumento6 páginasEnzimas catalíticasAndré ScalaAinda não há avaliações
- Cinética Enzimática da Alfa-AmilaseDocumento15 páginasCinética Enzimática da Alfa-AmilaseJulie BarrosAinda não há avaliações
- Paleot 2 PDFDocumento14 páginasPaleot 2 PDFScribd_is_GreatAinda não há avaliações
- Dinossauros Andaram Por Aqui - Praia Da ParedeDocumento3 páginasDinossauros Andaram Por Aqui - Praia Da ParedeScribd_is_Great100% (1)
- PC Guia #246 PDFDocumento100 páginasPC Guia #246 PDFScribd_is_GreatAinda não há avaliações
- Departamento de Geologia da Universidade de LisboaDocumento19 páginasDepartamento de Geologia da Universidade de LisboaScribd_is_GreatAinda não há avaliações
- Equinodermes Do Cabeço Da Ladeira: Um Caso de Preservação Do Património GeológicoDocumento5 páginasEquinodermes Do Cabeço Da Ladeira: Um Caso de Preservação Do Património GeológicoScribd_is_GreatAinda não há avaliações
- Ficha Final Estudo Do MeioDocumento7 páginasFicha Final Estudo Do Meiodinamfaria100% (1)
- Grelhas Classificacao TestesDocumento6 páginasGrelhas Classificacao TestesXAinda não há avaliações
- Paleot 1Documento10 páginasPaleot 1Scribd_is_GreatAinda não há avaliações
- Ae 3ceb CN CoracaoDocumento1 páginaAe 3ceb CN CoracaoScribd_is_GreatAinda não há avaliações
- Aula5FRATURAS PDFDocumento63 páginasAula5FRATURAS PDFAlex RamiresAinda não há avaliações
- Grelha correção testes RFDocumento1 páginaGrelha correção testes RFScribd_is_GreatAinda não há avaliações
- Dinossáurios portugueses: pegadas reveladorasDocumento2 páginasDinossáurios portugueses: pegadas reveladorasScribd_is_GreatAinda não há avaliações
- Grelha correção testes RFDocumento1 páginaGrelha correção testes RFScribd_is_GreatAinda não há avaliações
- A Problemática Do Telemóvel Reflexão e ProcedimentosDocumento5 páginasA Problemática Do Telemóvel Reflexão e ProcedimentosScribd_is_GreatAinda não há avaliações
- 3º Ano-Ficha12Documento1 página3º Ano-Ficha12Carla Maria Pereira ViegasAinda não há avaliações
- 3º Ano AnimaisDocumento3 páginas3º Ano AnimaisScribd_is_GreatAinda não há avaliações
- Algas marinhas utilidadesDocumento19 páginasAlgas marinhas utilidadesYury LorenzAinda não há avaliações
- Omirante PTDocumento2 páginasOmirante PTScribd_is_GreatAinda não há avaliações
- Rochas e MineraisDocumento6 páginasRochas e MineraisAriana LimaAinda não há avaliações
- Minerais e Rochas MagmáticasDocumento2 páginasMinerais e Rochas MagmáticasRuiAlmeidaAinda não há avaliações
- Passeio Pedonal e Visita Guiada No Parque Natural Serra D'Aire e Candeeiros Dia 18 de MaioDocumento2 páginasPasseio Pedonal e Visita Guiada No Parque Natural Serra D'Aire e Candeeiros Dia 18 de MaioScribd_is_GreatAinda não há avaliações
- Texto de Visitação de Equinodermes para PNSACDocumento1 páginaTexto de Visitação de Equinodermes para PNSACScribd_is_GreatAinda não há avaliações
- João Varela Tese Mestrado Final PDFDocumento143 páginasJoão Varela Tese Mestrado Final PDFScribd_is_GreatAinda não há avaliações
- Ae 3oc Ciencias NaturaisDocumento13 páginasAe 3oc Ciencias NaturaisScribd_is_GreatAinda não há avaliações
- LVF Provas Escola ImgDocumento6 páginasLVF Provas Escola ImgScribd_is_GreatAinda não há avaliações
- 1-Formador Face Ao Contexto FuncoesDocumento70 páginas1-Formador Face Ao Contexto FuncoespmtoldaAinda não há avaliações
- Cor em Exames NacionaisDocumento22 páginasCor em Exames NacionaiscarlbispAinda não há avaliações
- Ler 1º Antes de InstalarDocumento1 páginaLer 1º Antes de InstalarScribd_is_GreatAinda não há avaliações
- Revistaecologia 6 Art 2 1Documento13 páginasRevistaecologia 6 Art 2 1Scribd_is_GreatAinda não há avaliações
- Dialnet ComoLocalizarOEpicentroDeUmTerremoto 5162227Documento13 páginasDialnet ComoLocalizarOEpicentroDeUmTerremoto 5162227Scribd_is_GreatAinda não há avaliações
- Manual Plataforma PantográficaDocumento39 páginasManual Plataforma Pantográficajesus.manhaesAinda não há avaliações
- Santillana - M11 - Ficha de Trabalho 5Documento3 páginasSantillana - M11 - Ficha de Trabalho 5Hugo SantosAinda não há avaliações
- Aulas 17 A 19 - Mquinas SncronasDocumento14 páginasAulas 17 A 19 - Mquinas SncronasAndré Soares da SilvaAinda não há avaliações
- Plano TCC - Rafael Figueiredo - r1Documento16 páginasPlano TCC - Rafael Figueiredo - r1Rafael FigueiredoAinda não há avaliações
- GlobmaticDocumento12 páginasGlobmaticPaulo Pinto100% (1)
- Cálculo da máxima altitude de foguetesDocumento4 páginasCálculo da máxima altitude de foguetesMARCUS ANDREY VIANAAinda não há avaliações
- Lagoas Anaeróbias: Tratamento de Esgotos com Baixo CustoDocumento60 páginasLagoas Anaeróbias: Tratamento de Esgotos com Baixo CustoFelipeAinda não há avaliações
- NR-12: Requisitos de segurança para máquinas e equipamentosDocumento88 páginasNR-12: Requisitos de segurança para máquinas e equipamentosFernando Martins100% (2)
- Captura de Tela 2023-02-04 À(s) 09.05.42Documento1 páginaCaptura de Tela 2023-02-04 À(s) 09.05.42laura diasAinda não há avaliações
- Vasco Moretto: Educar para Um Novo TempoDocumento7 páginasVasco Moretto: Educar para Um Novo TempoFelipe SantiagoAinda não há avaliações
- Centros Quadros e Paineis de DistribuicaoDocumento90 páginasCentros Quadros e Paineis de DistribuicaoCaldeira ElétricaAinda não há avaliações
- Derivadas de funções compostas e implícitasDocumento5 páginasDerivadas de funções compostas e implícitasPedro HenriqueAinda não há avaliações
- Catalogo-Supervisao-REV-14.12.23Documento22 páginasCatalogo-Supervisao-REV-14.12.23ASTEC PERAinda não há avaliações
- FrasesDocumento4 páginasFrasesAlex PiratiniAinda não há avaliações
- Algebra - 2 Fase Dos Vestibulares 2 (2018)Documento6 páginasAlgebra - 2 Fase Dos Vestibulares 2 (2018)Luiz Antonio Ponce AlonsoAinda não há avaliações
- Apostila Concreto ArmadoDocumento159 páginasApostila Concreto ArmadoLuciano RibeiroAinda não há avaliações
- 443Documento8 páginas443Júlio CésarAinda não há avaliações
- Apostila Refrigeração IndustrialDocumento41 páginasApostila Refrigeração IndustrialNelson Silva100% (2)
- Ficha Tecnica Icf Plastbau ParedesDocumento2 páginasFicha Tecnica Icf Plastbau ParedesPedroJorge_UCAinda não há avaliações
- Introdução A Química Exercícios - PDF 0Documento55 páginasIntrodução A Química Exercícios - PDF 0Fabiano AlvesAinda não há avaliações
- Moyses v2c08Documento11 páginasMoyses v2c08EphramoliverAinda não há avaliações
- Relatório Experimento 4Documento5 páginasRelatório Experimento 4Eduarda LealAinda não há avaliações
- Lista de exercícios de dinâmicaDocumento2 páginasLista de exercícios de dinâmicaHenry Moreno0% (1)
- Punto BRDocumento235 páginasPunto BRduhkacttusAinda não há avaliações
- Análise de circuitos elétricosDocumento6 páginasAnálise de circuitos elétricosmscaboraAinda não há avaliações
- Exercícios Experimento1Documento3 páginasExercícios Experimento1thayna.borgesAinda não há avaliações
- Aula 5 - Exercícios Tabela Periódica e Propriedades PeriódicasDocumento3 páginasAula 5 - Exercícios Tabela Periódica e Propriedades PeriódicasnatyrrrAinda não há avaliações
- Semicondutores: materiais e dispositivos básicosDocumento32 páginasSemicondutores: materiais e dispositivos básicosrewtwAinda não há avaliações
- Física 2 - Calor e Sua PropagaçãoDocumento2 páginasFísica 2 - Calor e Sua PropagaçãoArret Lorak100% (1)
- QI II Compostos de Coordenação III-TCCDocumento46 páginasQI II Compostos de Coordenação III-TCCLuanAinda não há avaliações