Escolar Documentos
Profissional Documentos
Cultura Documentos
Tema 4 - Mezcla de Gases Sin Reaccion y Psicrometria
Enviado por
jaagoodTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Tema 4 - Mezcla de Gases Sin Reaccion y Psicrometria
Enviado por
jaagoodDireitos autorais:
Formatos disponíveis
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
77
TEMA 4
MEZCLA DE GASES SIN REACCIN Y PSICROMETRA
4.1.- MEZCLA DE GASES SIN REACCIN.-
Una mezcla de gases no reactiva puede tratarse como una sustancia pura
porque casi siempre es una mezcla homognea de diferentes gases. Las propiedades
de una mezcla de gases dependen de las propiedades de los gases individuales
(llamados componentes o constituyentes), as como de la cantidad de gas en cada
mezcla. En consecuencia, es posible elaborar tablas de propiedades para mezclas y
as se ha hecho para el aire. No obstante, no es prctico preparar tablas de
propiedades para todas las mezclas que puedan concebirse, pues sera interminable.
Por tanto, es necesario desarrollar reglas para determinar propiedades de
mezclas a partir del conocimiento de la composicin de la mezcla y de las propiedades
de los componentes individuales.
4.2.- COMPOSICIN DE UNA MEZCLA DE GASES: MASA Y FRACCIN MOLAR.-
Para determinar las propiedades de una mezcla es necesario conocer su
composicin, as como las propiedades de los componentes individuales. Hay dos
maneras de describir la composicin de una mezcla:
- Anlisis molar: especificando el nmero de moles (n) de cada componente.
- Anlisis gravimtrico: especificando la masa (m) de cada componente.
En una mezcla de gases compuesta por i componentes, se cumple:
La masa de una mezcla es igual a la suma de las masas de sus
componentes:
=
=
k
i
i m
m m
1
(4.1)
El nmero de moles de una mezcla, no reactiva, es igual a la suma del
nmero de moles de sus componentes:
=
=
k
i
i m
n n
1
(4.2)
La suma de las fracciones de masa o molares de una mezcla es igual a la
unidad:
( )
m
i
i
m
m
fm
mezcla la de masa
componente un de masa la entre lacin
fm masa de Fraccin = =
Re
( )
m
i
i
n
n
mezcla la de moles de nmero
componente un de moles de nmero el entre lacin
molar Fraccin = = _ _
Re
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
78
Si dividimos las ecs.4.1 y 4.2 , respectivamente, por m
m
y n
m
, se demuestra
fcilmente que 1 =
m
i
m
m
o que 1 =
m
i
n
n
.
La masa de una sustancia puede expresarse en trminos del nmero de moles n
y la masa molar M de la sustancia como { m = n M (kg) } , y entonces la masa molar
aparente (o promedio) de una mezcla ser:
|
.
|
\
|
=
= =
=
kmol
kg
M
n
M n
n
m
n
m
M
k
i
i i
m
i i
m
i
m
m
m
1
_ (4.3)
As, la constante promedio (o aparente) de gas de la mezcla se determina por:
|
|
.
|
\
|
=
K kg
kJ
M
R
R
m
u
m
(4.4)
4.3.- COMPORTAMIENTO P-V-T DE MEZCLAS DE GASES: IDEALES Y REALES.-
Un gas ideal es aquel cuyas molculas estn tan separadas, que el
comportamiento de una molcula no se ve afectado por las que le rodean (ocurre a
bajas densidades). Tambin sabemos que los gases reales se aproximan mucho a este
comportamiento cuando se encuentran a baja presin o alta temperatura respecto de
sus valores de punto crtico; es decir a baja presin reducida o alta temperatura
reducida.
El comportamiento p-v-T de un gas ideal se expresa por la ecuacin p v = RT;
pero en el caso de los gases reales se expresa con ecuaciones ms complejas
(estudiadas en el tema anterior) o por medio de p v = Z R T , donde Z es el factor de
compresibilidad.
Cuando se mezclan gases ideales, el comportamiento de una molcula no se ve
afectado por el comportamiento de otras molculas similares o diferentes, y en
consecuencia, una mezcla no reactiva de gases ideales se comporta tambin como un
gas ideal. Sin embargo, cuando una mezcla de gases est compuesta por gases
reales, la prediccin del comportamiento p-v-T de la mezcla se vuelve bastante difcil.
La prediccin del comportamiento p-v-T de mezclas de gases suele basarse en
dos modelos: la ley de Dalton de las presiones aditivas y la ley de Amagat de
volmenes aditivos.
Ley de Dalton de presiones aditivas: la presin de una mezcla de gases es
igual a la suma de las presiones que cada gas ejercera si existiera solo a la
temperatura y volumen de la mezcla.
( )
=
=
k
i
m m i m
V T p P
1
, (4.5)
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
79
Ley de Amagat de volmenes aditivos: El volumen de una mezcla de gases
es igual a la suma de los volmenes que cada gas ocupara si existiera slo
a la temperatura y presin de la mezcla.
( )
=
=
k
i
m m i m
p T V V
1
, (4.6)
Las leyes de Dalton y Amagat se cumplen con exactitud en mezclas de gases
ideales, pero slo como aproximacin en mezclas de gases reales.
En las ec.4.5 y 4.6, p
i
recibe el nombre de componente de presin y V
i
se
denomina componente de volumen. Adems, la relacin (V
i
/ V
m
) recibe el nombre de
fraccin de volumen del componente i.
4.3.1.- Mezclas de gases ideales.-
Para gases ideales, p
i
y V
i
pueden relacionarse con
i
_ mediante la relacin de
gas ideal tanto para los componentes como para la mezcla de gas.
( )
( )
i
m
i
m
i
m
i
i
m
i
m m u m
m m u i
m
m m i
i
m
i
m m u m
m m u i
m
m m i
n
n
V
V
p
p
n
n
p T R n
p T R n
V
p T V
n
n
V T R n
V T R n
p
V T p
_
_
_
= = =
= = =
= = =
/
/
,
/
/
,
(4.7)
La ec.4.7 nos indica que en una mezcla de gases ideales son iguales la fraccin
molar, la fraccin de presin y la fraccin de volumen de un componente.
De aqu se deduce que
m i i
p p _ = , que es la presin parcial (idntica al
componente de presin para gases ideales), y que
m i i
V V _ = , que es el volumen
parcial (idntico al componente de volumen para gases ideales).
4.3.2.- Mezclas de gases reales.-
La ley de Dalton de las presiones aditivas y la ley de Amagat de los volmenes
aditivos pueden emplearse tambin en gases reales con bastante precisin. Sin
embargo, en estos casos, los componentes de presin o los componentes de volumen
deben evaluarse a partir de relaciones que consideran la desviacin de cada
componente del comportamiento de gas ideal. Para ello existen ecuaciones de estado
como son las de Van der Waals, Beatti-Bridgeman, Benedict-Webb-Rubin y otras, ms
exactas que la ecuacin de estado para gas ideal, y que hemos visto anteriormente.
Otra forma es emplear el factor de compresibilidad Z, como:
T R n Z V p
u
= (4.8)
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
80
Una expresin que relaciona el factor de compresibilidad de la mezcla Z
m
con
los factores de compresibilidad de los gases individuales Z
i
, se obtiene al aplicar la
ec.4.8 a ambos lados de la ecuacin de la ley de Dalton o de Amagat (ecs.4.5 y 4.6):
( )
1
1
,
k
m i m m
k
i m m m m m
m i i
i m m m i i m i m i i m
m m
p p V T
p V Z n R T
Z Z
Z n R T Z n R T p V Z n R T
V V
_
=
=
=
=
=
` `
=
)
=
)
(4.9)
donde Z
i
, se determina a T
m
y V
m
(ley de Dalton) o bien a T
m
y p
m
(ley de Amagat)
para cada gas individual. El factor de compresibilidad nos da valores ms exactos,
cuando los Z
i
en la ec.4.9 se evalan con la ley de Amagat, pues as se considera la
presin de la mezcla p
m
, que es la que tiene en cuenta la influencia de las fuerzas
intermoleculares entre las molculas de gases diferentes. Por tanto, para bajas
presiones emplearemos la ley de Dalton y para altas presiones la ley de Amagat.
El factor de compresibilidad predice con bastante precisin el comportamiento p-
v-T de gases independientes, pero no el correspondiente a mezclas de gases. Cuando
se usan factores de compresibilidad para los componentes de una mezcla de gases, se
tiene en cuenta la influencia de molculas similares entre s, pero no la influencia entre
molculas diferentes; por este motivo un valor de una propiedad predicha mediante
este enfoque puede ser muy diferente de un valor determinado en forma experimental.
Otro enfoque para predecir el comportamiento p-v-T de una mezcla de gases es
tratarla como una sustancia pseudopura. Este mtodo es conocido como regla de Kay
e implica el uso de una presin pseudocrtica
m C
p
,
' y una temperatura pseudocrtica
m C
T
,
' para la mezcla, definidas en trminos de las presiones y temperaturas de los
componentes de la mezcla como:
= =
= ' = '
k
i
i C i m C
k
i
i C i m C
T T y p p
1
, ,
1
, ,
_ _ (4.10)
El factor de compresibilidad de la mezcla Z
m
se obtiene de la grfica A-2 a partir
de T
R
y p
R
, definidas como:
m C m R
T T T
,
' = y
m C m R
p p p
,
' =
Otra manera de tratar una mezcla de gases como una sustancia pseudopura es
emplear una ecuacin de estado ms exacta (Van der Waals, etc.) para la mezcla y
determinar los coeficientes constantes en trminos de los coeficientes de los
componentes. En la ecuacin de Van der Waals, por ejemplo, las dos constantes para
la mezcla se determinan a partir de:
( )
= =
= =
k
i
i i m
k
i
i i m
b b y a a
1 1
2
2 / 1
_ _ (4.11)
donde las expresiones para a
i
y b
i
, en funcin de los datos del punto crtico (Tabla A-
1) , vienen dadas por las ecuaciones:
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
81
C
C
C
C
p
T R
b y
p
T R
a
8 64
27
2 2
= = (4.12)
4.4.- PROPIEDADES DE MEZCLA DE GASES: IDEALES Y REALES.-
Las propiedades extensivas de una mezcla se determinan al sumar las
propiedades de los componentes. As, la energa interna, la entalpa y la entropa
totales de una mezcla de gases pueden expresarse como:
) (
1 1 1
kJ u n u m U U
k
i
i i
k
i
i i
k
i
i m
= = =
= = = (4.13)
) (
1 1 1
kJ h n h m H H
k
i
i i
k
i
i i
k
i
i m
= = =
= = = (4.14)
|
.
|
\
|
= = =
= = =
K
kJ
s n s m S S
k
i
i i
k
i
i i
k
i
i m
1 1 1
(4.15)
Con una lgica similar, los cambios en la energa interna, entalpa y entropa de
una mezcla de gases durante un proceso pueden expresarse, como:
) (
1 1 1
kJ u n u m U U
k
i
i i
k
i
i i
k
i
i m
= = =
A = A = A = A (4.16)
) (
1 1 1
kJ h n h m H H
k
i
i i
k
i
i i
k
i
i m
= = =
A = A = A = A (4.17)
|
.
|
\
|
A = A = A = A
= = =
K
kJ
s n s m S S
k
i
i i
k
i
i i
k
i
i m
1 1 1
(4.18)
Para obtener las correspondientes propiedades intensivas, bastar con dividir
las anteriores por la masa o por el nmero de moles de la mezcla, obteniendo as:
|
.
|
\
|
=
|
|
.
|
\
|
=
= =
kmol
kJ
u u
kg
kJ
u fm u
k
i
i i m
k
i
i i m
1 1
; _ (4.19)
|
.
|
\
|
=
|
|
.
|
\
|
=
= =
kmol
kJ
h h
kg
kJ
h fm h
k
i
i i m
k
i
i i m
1 1
; _ (4.20)
|
|
.
|
\
|
=
|
|
.
|
\
|
=
= =
K kmol
kJ
s s
K kg
kJ
s fm s
k
i
i i m
k
i
i i m
1 1
; _ (4.21)
y de forma similar:
|
|
.
|
\
|
=
|
|
.
|
\
|
=
= =
C kmol
kJ
c c
C kg
kJ
c fm c
k
i
i v i m v
k
i
i v i m v
1
, ,
1
, ,
_ (4.22)
|
|
.
|
\
|
=
|
|
.
|
\
|
=
= =
C kmol
kJ
c c
C kg
kJ
c fm c
k
i
i p i m p
k
i
i p i m p
1
, ,
1
, ,
_ (4.23)
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
82
Las relaciones que acabamos de ver son aplicables, por lo general, tanto a
mezclas de gases ideales como reales (de hecho tambin se aplican a soluciones
lquidas y slidas no reactivas). La nica gran dificultad asociada a estas relaciones es
la determinacin de las propiedades para cada gas individual en la mezcla. Sin
embargo, el anlisis puede simplificarse si los gases individuales se tratan como
ideales, siempre y cuando no se introduzca con ello un error significativo.
4.4.1.- Mezclas de gases ideales.-
Los gases que componen una mezcla, con frecuencia, se encuentran a alta
temperatura y baja presin respecto de los valores del punto crtico de los gases
individuales. En estos casos, la mezcla de gases y sus componentes pueden tratarse
como gases ideales con un error despreciable.
Bajo la aproximacin de gas ideal, las propiedades de un gas no se ven
afectadas por la presencia de otros gases, y cada componente de gas en la mezcla se
comporta como si existiera solo a la temperatura de la mezcla T
m
y al volumen de la
mezcla V
m
. Este principio se conoce como ley de Gibbs-Dalton, que es una extensin
de la ley de Dalton de las presiones aditivas.
Por otro lado, la h, u, c
v
, y c
p
de un gas ideal dependen solo de la temperatura
y son independientes de la presin o el volumen de la mezcla de gases ideales. La
presin parcial de un componente ser
m i i
p p _ = , siendo p
m
la presin de la mezcla.
La evaluacin de u o h de los componentes de una mezcla de gases ideales
durante un proceso es relativamente fcil, porque solo requiere conocer las
temperaturas inicial y final. Sin embargo, a la hora de determinar s hay que tener
cuidado porque adems de la temperatura, tambin depende de la presin o volumen
del componente. As pues, el cambio de entropa de gases individuales en una mezcla
de gases ideales, durante un proceso se calcula as:
|
|
.
|
\
|
~ = A
K kg
kJ
p
p
R
T
T
c
p
p
R s s s
i
i
i
i
i
p
i
i
i i i i
i
1
2
1
2
1
2 0
1
0
2
ln ln ln (4.24)
|
|
.
|
\
|
~ = A
K kmol
kJ
p
p
R
T
T
c
p
p
R s s s
i
i
u
i
i
p
i
i
u
i i
i i
1
2
1
2
1
2
0
1
0
2 ln ln ln (4.25)
donde:
2 2 2 m i i
p p _ = y
1 1 1 m i i
p p _ =
Obsrvese que es la presin parcial de cada componente (p
i
) la que se emplea
en la evaluacin del cambio de entropa y no la presin de la mezcla p
m
4.4.2.- Mezclas de gases reales.-
Cuando los componentes de una mezcla de gases no se comportan como
ideales, el anlisis es ms complejo debido a que las propiedades de los gases reales
(u, h , c
v
, ) dependen de la presin (o volumen especfico), as como de la
temperatura.
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
83
Cuando se trata de mezclas de gases reales, tal vez sea necesario considerar el
efecto del comportamiento no ideal en las propiedades de la mezcla como la entalpa y
la entropa. Una manera de hacerlo es usar factores de compresibilidad en conjuncin
con las ecuaciones y grficas generalizadas que se desarrollaron en el tema anterior,
para gases reales.
Teniendo en cuenta el primer principio para una mezcla de gas
(
m m m m m
dp v ds T dh + = ) , tendremos:
( ) ( ) 0
i i m i i i i m i i m i i m
fm dh T fm ds fm v dp fm dh T ds v dp = + =
m i i m i
dp v ds T dh + = (4.26)
Esta ecuacin obtenida es la inicial en el desarrollo de las relaciones y grficas
generalizadas para la entalpa y la entropa. Esto sugiere que las relaciones y grficas
de propiedades generalizadas para gases reales, que se desarrollaron anteriormente,
tambin pueden utilizarse para los componentes de mezclas de gases reales.
Ahora bien, la temperatura reducida T
R
y la presin reducida p
R
para cada
componente deben evaluarse mediante la temperatura de la mezcla T
m
y la presin
de la mezcla p
m
y no la presin correspondiente p
i
.
Esta forma de determinar las propiedades de la mezcla es aproximada, pero con
bastante precisin para la mayor parte de propsitos.
En el caso que se especifiquen el volumen y la temperatura de la mezcla en
lugar de las presiones y temperatura, evaluaremos la presin de la mezcla con la ley de
Dalton de las presiones aditivas y despus emplearemos este valor (que solo es
aproximado) como la presin de la mezcla.
Otra forma de evaluar las propiedades de una mezcla de gases reales es tratar
la mezcla como una sustancia pseudopura que tiene propiedades pseudocrticas,
determinadas en trminos de propiedades crticas de los gases componentes mediante
la regla de Kay.
4.5.- PSICROMETRA. MEZCLA DE GAS-VAPOR.-
A temperaturas por debajo de la crtica, a la fase gaseosa de una sustancia se le
denomina como vapor. El trmino vapor implica un estado gaseoso que se encuentra
cerca de la zona de saturacin de la sustancia, lo cual incrementa la posibilidad de
condensacin durante el proceso.
En los epgrafes anteriores se analizaron mezclas de gases que se encontraban
por encima de sus temperaturas crticas, luego no exista la condensacin de los gases
durante el proceso. Cuando tenemos una mezcla de gas-vapor, el vapor puede
condensarse fuera de la mezcla durante un proceso, formando una mezcla bifsica y
complicando el anlisis considerablemente. Por tanto, estas mezclas hay que tratarlas
de forma diferente a las estudiadas en los epgrafes anteriores.
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
84
4.6.- AIRE SECO Y AIRE ATMOSFRICO.-
El aire es una mezcla de nitrgeno, oxigeno y pequeas cantidades de otros
gases. Generalmente, el aire atmosfrico contiene cierta cantidad de vapor de agua (o
humedad) y se conoce como aire atmosfrico o aire hmedo, en contraste con el aire
que no contiene vapor de agua que se llama aire seco.
Es conveniente tratar al aire como una mezcla de vapor de agua y aire seco, ya
que la composicin del aire seco permanece relativamente constante, pero la cantidad
de vapor de agua cambia por la condensacin y evaporacin de los ocanos, lagos,
ros, incluso del agua del cuerpo humano.
A pesar de que la cantidad de vapor de agua en el aire es pequea, desempea
un importante papel en el confort de los seres humanos, por lo que es necesario tenerlo
en cuenta en los dispositivos de aire acondicionado.
La temperatura del aire en aplicaciones de acondicionamiento de aire vara de
-10C a 50C. . En este intervalo el aire seco puede tratarse como un gas ideal con un
valor c
p
= Cte = 1,005 kJ/(kg C) cometiendo un error despreciable (menor de 0,2 %). Si
se toma como temperatura de referencia los 0C, la entalpa y el cambio de entalpa de
aire seco puede determinarse por:
|
|
.
|
\
|
|
|
.
|
\
|
= =
kg
kJ
C T
C kg
kJ
T c h
p o aire
) (
005 , 1
sec
(4.27)
|
|
.
|
\
|
A
|
|
.
|
\
|
= A = A
kg
kJ
C T
C kg
kJ
T c h
p o aire
) (
005 , 1
sec
(4.28)
donde T es la temperatura del aire en C e T es la variacin de temperatura. En
procesos de acondicionamiento de aire interesan los cambios en la entalpa (h), los
cuales son independientes del punto de referencia elegido.
A 50C, la presin de saturacin del agua es 12,3 kPa. Como puede verse en la
fig.3.3, a presiones por debajo de este valor, el vapor de agua puede tratarse como un
gas ideal con un error despreciable (menor del 0,2%), incluso cuando es un vapor
saturado. Por tanto, el vapor de agua en el aire se comporta como si existiera solo
obedeciendo la relacin de gas ideal pv = R T. En este caso el aire atmosfrico puede
tratarse como una mezcla de gases ideales cuya presin es la suma de la presin
parcial de aire seco p
a
y la del vapor de agua p
v
, es decir:
) (kPa p p p
v a
+ = (4.29)
A la presin parcial del vapor de agua se le conoce como presin de vapor y es
la presin que el vapor de agua ejercera si existiera solo a la temperatura y volumen
de la mezcla.
Si el vapor de agua por debajo de 50C podemos considerarlo como ideal, la
entalpa del vapor de agua ser nicamente funcin de la temperatura ) (T h h = . Por
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
85
tanto, la entalpa del vapor de agua en el aire puede tomarse igual a la entalpa del
vapor saturado a la misma temperatura (observar tablas de vapor), es decir:
( ) ) ( , T h p T h
g baja v
~
La entalpa del vapor de agua puede calcularse, aproximadamente, si tenemos
en cuenta que la entalpa del vapor de agua a 0C es 2501,3 kJ/kg y que el valor de c
p
promedio del vapor de agua en el intervalo de temperatura -10C a 50C puede
tomarse igual a 1,82 kJ/(kg C). Luego:
( ) ( ) kg kJ C en T T T h
g
/ ) ( 82 , 1 3 , 2501 + ~ (4.30)
4.7.- HUMEDAD ESPECFICA Y RELATIVA DEL AIRE.-
La cantidad de vapor de agua en el aire puede expresarse de varias formas,
pero quizs la ms lgica sea indicar la masa de vapor de agua presente en una masa
unitaria de aire seco, a la cual se le denomina humedad absoluta o especfica
(conocida tambin como relacin de humedad) y que se expresa por:
|
|
.
|
\
|
=
o aire kg
agua vapor kg
m
m
a
v
sec
e (4.31)
y que tambin puede expresarse como:
|
|
.
|
\
|
= = = = = e
o aire kg
agua vapor kg
p p
p
p
p
R p
R p
T R V p
T R V p
m
m
v
v
a
v
a a
v v
a a
v v
a
v
sec
622 , 0
622 , 0
/
/
/
/
(4.32)
donde p es la presin total.
En la fig.4.1 se muestra un estado tpico de vapor de agua en el aire hmedo. En
este estado, fijado por la presin parcial
v
p y la temperatura de la mezcla T , el vapor
est recalentado. Cuando la presin parcial del vapor de agua es la de saturacin del
agua a la temperatura de la mezcla
g
p , se dice que la mezcla es saturada. El aire
saturado es una mezcla de aire seco y vapor de agua saturado. La cantidad de vapor
de agua en el aire hmedo vara desde cero en el aire
seco hasta un mximo, cuando la mezcla est
saturada, dependiente de la presin y la temperatura.
El nivel de confort depende de la cantidad de
humedad que el aire contiene (m
v
) en relacin con la
cantidad mxima de humedad que el aire puede
contener a la misma temperatura (m
g
). La relacin
entre estas dos cantidades es la humedad relativa ().
g
v
v g
v v
g
v
p
p
T R V p
T R V p
m
m
= = = u
/
/
(4.33)
Temperatura
de la mezcla
T
a
P
v
P
g
s
T
Fig.4.1
b
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
86
donde :
T a
sat g
p p
,
= ; a = estado del vapor de agua en una mezcla saturada ; b = estado tpico
del vapor de agua en el aire hmedo
Combinando las ecs.4.32 y 4.33, podemos expresar la humedad especfica y
relativa por:
( )
g g
g
p
p
p p
p
e +
e
= u
u
u
= e
622 , 0
622 , 0
(4.34)
La humedad relativa vara de 0 (para aire seco) a 1 (para aire saturado).
Advirtase que la cantidad de humedad que el aire puede contener depende de su
temperatura; por tanto la humedad relativa del aire cambia con la temperatura aunque
su humedad especfica permanezca constante.
Al ser el aire atmosfrico una mezcla de aire seco y vapor de agua, la entalpa
del aire se expresa en funcin de las entalpas del aire seco y del vapor de agua. En la
mayor parte de las aplicaciones prcticas, la cantidad de aire seco en la mezcla aire-
agua-vapor permanece constante, si bien la cantidad de vapor de agua cambia. En
consecuencia, la entalpa del aire atmosfrico se expresa por unidad de masa del aire
seco y no por unidad de masa de la mezcla aire-agua-
vapor (fig.4.2).
La entalpa total (propiedad extensiva) del aire
atmosfrico es la suma de las entalpas del aire seco y del
vapor de agua.
v v a a v a
h m h m H H H + = + =
dividiendo por m
a
, se obtiene:
|
|
.
|
\
|
+ ~ + = + = =
o aire de kg
kJ
h h h h h h
m
m
h
m
H
h
g a v a v
a
v
a
a
sec
e e (4.35)
ya que
g v
h h ~ a bajas presiones y a la temperatura que se encuentra la mezcla.
La temperatura del aire atmosfrico se conoce como temperatura de bulbo seco
para diferenciarla de otras formas de temperatura que estudiemos.
4.8.- TEMPERATURA DE PUNTO DE ROCO.-
En los climas muy hmedos, el exceso de humedad en el aire se condensa en
las superficies fras formando el roco. En verano una cantidad considerable de agua se
evapora durante el da. Cuando desciende la temperatura, por la noche, tambin lo
hace la capacidad de humedad del aire, que es la cantidad mxima de humedad que
el aire puede contener. Transcurrido un tiempo, la capacidad de humedad del aire se
iguala al contenido de humedad de ste. En este punto, el aire est saturado y su
Aire seco
1 kg
h
a
Humedad
kg
h
g
(1+) kg de aire hmedo
Fig.4.2
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
87
humedad relativa es 100%. Cualquier descenso adicional en la temperatura del aire
tiene como consecuencia la condensacin de un poco de humedad, y este es el inicio
de la formacin del roco.
La temperatura de punto de roco (T
PR
) se
define como la temperatura a la cual se inicia la
condensacin si el aire se enfra a presin
constante; es decir, T
PR
es la temperatura de
saturacin del agua correspondiente a la presin
de vapor.
p a
sat PR
T T
,
= (4.36)
Esto se muestra tambin en la fig.4.3. Cuando el
aire se enfra a p = Cte, la presin de vapor p
v
permanece constante; por tanto, el vapor en el aire (punto 1) experimenta un proceso
de enfriamiento a presin constante hasta que alcanza la lnea de vapor saturado
(punto d). La temperatura en este punto es T
PR
, y si la temperatura desciende un poco
ms, algo de vapor se condensa. En consecuencia, la cantidad de vapor en el aire
disminuye, produciendo una disminucin de p
v
. El aire permanece saturado durante el
proceso de condensacin y, por ello, sigue una trayectoria de humedad relativa del
100% (la lnea de vapor saturado). En el estado final, el sistema estar compuesto por
una fase gaseosa de aire hmedo y agua lquida en equilibrio con ella. El vapor que
permanece se puede considerar saturado a la temperatura final T
2
con una presin
parcial igual a la presin de saturacin p
g2
correspondiente a esta temperatura. El
condensado ser lquido saturado a la temperatura final (estado 3). Obsrvese que la
presin parcial del vapor de agua en el estado final p
g2
es menor que su valor inicial p
v
.
La presin parcial disminuye porque la fraccin molar del vapor de agua presente en el
estado final es menor que la inicial debido a la condensacin.
4.9.- SATURACIN ADIABTICA Y TEMPERATURAS DE BULBO HMEDO.-
La humedad relativa y la humedad especfica no son fciles de medir
directamente. Una forma de determinar la humedad relativa sera encontrar la
temperatura de punto de roco del aire, as sera posible determinar la presin de vapor
p
v
y de este modo la humedad relativa; pero este planteamiento tan sencillo no es
prctico.
Otra manera de determinar la humedad absoluta o relativa est relacionada con
lo que se conoce como proceso de saturacin adiabtico, y que se muestra
esquemticamente en la fig 4.4. El sistema se compone de un canal largo y aislado que
contiene agua. Por el canal se hace circular una corriente permanente de aire no
saturado que contiene una humedad especfica
1
(desconocida) y una temperatura T
1
.
Cuando el aire fluye sobre el agua, parte de esta se evapora y se mezcla con la
corriente de aire. El contenido de humedad del aire aumentar durante este proceso y
su temperatura descender, debido a que parte del calor latente de evaporacin del
agua proviene del aire.
Punto roco
Condensado
T
2
P
g2
3
2
d
1
T
PR
T
1
P
v1
= Cte
P
g1
s
T
Fig.4.3
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
88
Si el canal tiene una longitud suficiente larga, la corriente de aire saldr como
aire saturado ( = 100%) a la
temperatura T
2
, que recibe el nombre de
temperatura de saturacin adiabtica.
Si aadimos un flujo estacionario
de agua de reposicin al canal al mismo
ritmo que se va evaporando y a la
temperatura T
2
, el proceso de saturacin
adiabtico descrito puede analizarse
como un proceso de flujo permanente. El
proceso no incluye interacciones de calor
o trabajo y los cambios en la energa
cintica y potencial pueden despreciarse.
Por tanto, las ecuaciones de
conservacin de la masa y la energa
para este sistema de flujo permanente de
dos entradas y una salida se reduce a:
( )
1 2
2 1
2 1
2 1
:
:
tan sec
:
e e
e e
=
= +
= +
)
`
= =
a f
a f a
w f w
f
a a a
m m luego
m m m
bien o m m m
m n evaporaci de relacin la a igual cantidad
una en aumenta aire el en vapor del masa de flujo El
m m m te. cons permanece o aire del masa de flujo El
MASA LA DE N CONSERVACI
( )
( )
2 2 1 2 1 1 2 2 2 1 1
:
0 0
:
h m h m h m bien o h m h m h m
W y Q que ya h m h m
ENERGA LA DE N CONSERVACI
a f a a a f f a
s s e e
= + = +
= = =
e e
Dividiendo por
a
m , y teniendo en cuenta la ec.4.35, se obtiene:
( ) ( ) ( ) ( )
2 2 2 2 1 2 1 1 1 2 2 1 2 1 g p f g p f
h T c h h T c h h h e e e e e e + = + + = +
Despejando
1
, tendremos:
( ) ( )
2 1 2 2 2
1
1 2
p g f
g f
c T T h h
h h
e
e
+
=
(4.37)
y teniendo en cuenta la ec.4.34, se obtiene:
2
Agua lquida
T
1
,
1
1
No
saturado
T
2
,
2
2
= 100%
Aire
saturado
Aire
2 1
T saturacin adiabtica
P
v1
Punto roco
1
s
T
Fig.4.4
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
89
( ) % 100
622 , 0
2
2 2
2
2
= u
= que ya
p p
p
g
g
e (4.38)
Por tanto, si se miden la presin y la temperatura del aire a la entrada y a la
salida de un saturador adiabtico, podremos determinar la humedad especfica y la
relativa del aire por medio de las ecs.4.37 y 4.38.
Si el aire que entra al canal ya est saturado, entonces la temperatura de
saturacin adiabtica T
2
ser idntica a la temperatura de entrada T
1
, en cuyo caso la
ec.4.37 nos da que
1
=
2
. En general la temperatura de saturacin adiabtica estar
entre las temperaturas de entrada y de punto de roco (fig.4.4).
Un planteamiento ms prctico que el descrito es emplear un termmetro cuyo
bulbo est cubierto con una mecha de algodn saturada con agua y soplar aire sobre
ella. La temperatura medida de esta manera se denomina temperatura de bulbo
hmedo (T
bh
) y se emplea comnmente en aplicaciones de acondicionamiento de aire.
A menudo, un termmetro de bulbo seco se monta conjuntamente con otro de
bulbo hmedo sobre un soporte para formar un aparato llamado psicrmetro. Al
psicrmetro se le hace girar en el seno del aire cuya humedad especfica se quiera
determinar. Esto induce la circulacin del aire sobre los dos termmetros. Si el aire no
est saturado el agua de la mecha del termmetro de bulbo hmedo se evapora y la
temperatura del agua desciende por debajo de la de bulbo seco. Al final se alcanza una
situacin estacionaria en el termmetro de bulbo hmedo. Las temperaturas de bulbo
seco y hmedo se leen en los termmetros respectivos.
La temperatura de bulbo hmedo depende de los ritmos de las transferencias de
calor y masa entre la mecha hmeda y el aire. Puesto que stos dependen a su vez de
la geometra del termmetro, la velocidad del aire, la temperatura del agua
suministrada y otros factores, la temperatura de bulbo hmedo no es una propiedad de
la mezcla.
En la actualidad existen equipos electrnicos de medicin de humedad basados
en el cambio de capacitancia en una delgada pelcula polimrica, que al absorber vapor
de agua son capaces de detectar y mostrar digitalmente la humedad relativa con gran
precisin en cuestin de segundos.
En general la temperatura de saturacin adiabtica y la temperatura de bulbo
hmedo no son iguales; pero para mezclas aire-agua-vapor a presin atmosfrica, la
temperatura de bulbo hmedo es casi igual a la temperatura de saturacin adiabtica.
As, la temperatura de bulbo hmedo (T
bh
) puede emplearse en la ec.4.37 en lugar de
T
2
para determinar la humedad especfica del aire.
4.10.- DIAGRAMA PSICROMTRICO.-
Estos diagramas proporcionan la representacin grfica de varias propiedades
importantes del aire hmedo. Este tipo de diagramas se limita a una presin de la
mezcla de 1atm, pero se pueden elaborar diagramas para otras presiones. Las
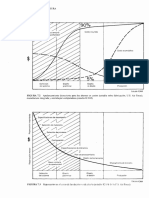
caractersticas ms importantes se presentan en la fig.4.5:
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
90
Fig.4.5.- Diagrama psicromtrico
En el eje de abscisas figuran la temperatura de bulbo seco (T
bs
en C) y en
ordenadas la humedad especfica () en (kg vapor de agua / kg aire seco).
La ec.4.32
|
|
.
|
\
|
= e
v
v
p p
p 622 , 0
muestra que para una presin determinada de la
mezcla existe una correspondencia directa entre la presin parcial del vapor de
agua y la humedad especfica; por tanto, la presin del vapor (p
v
) tambin puede
aparecer en ordenadas.
En el diagrama psicromtrico tambin aparecen las curvas de humedad relativa
constante. Puesto que el punto de roco es el estado en el que la mezcla se
satura al enfriarla a presin de vapor constante, la temperatura de roco de un
estado determinado del aire hmedo se puede obtener trazando una lnea de
constante (p
v
= Cte) hasta la lnea de saturacin ( = 100%). Para aire saturado,
las temperaturas de bulbo seco, bulbo hmedo y punto de roco son idnticas.
Los diagramas psicromtricos dan los valores de la entalpa de la mezcla
( )
v a
h h e + por unidad de masa del aire seco en la mezcla ( ) o aire kg kJ sec / . Los
valores numricos proporcionados por dicha grfica utilizan como estados de
referencia para la entalpa del aire seco (h
a
) el 0C y no el 0 K como hacen las
tablas de propiedades de gas ideal para el aire. Por tanto, en lugar de la
ecuacin
}
=
T
p
dT T c T h
0
) ( ) ( empleada para obtener datos de dichas tablas,
emplearemos la ec.4.27:
|
|
.
|
\
|
|
|
.
|
\
|
= =
kg
kJ
C T
C kg
kJ
T c h
p o aire
) (
005 , 1
sec
(4.27)
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
91
Otro parmetro importante en los diagramas psicromtricos es la temperatura de
bulbo hmedo. Las lneas de T
bh
constantes tienen forma descendente hacia la
derecha y coinciden prcticamente con las de entalpa constante de la mezcla
por unidad de masa de aire seco. Este hecho se puede establecer estudiando el
balance de energa del saturador adiabtico. Dado que la contribucin
energtica del agua de reposicin que entra al saturador es mucho menor que la
del aire hmedo, la entalpa del aire saliente es casi igual a la del aire entrante;
por tanto, todos los estados con la misma temperatura de bulbo hmedo
(temperatura de saturacin adiabtica) tienen aproximadamente la misma
entalpa por unidad de masa de aire seco.
Como se indica en la fig.4.5, los diagramas psicromtricos tambin incluyen las
lneas de volumen por unidad de masa de aire seco (V/m
a
) en unidades de
m
3
/kg. Estas lneas de volumen especfico se pueden interpretar como las que
dan el volumen del aire seco o del vapor, por unidad de masa de aire seco, al
considerarse que cada componente de la mezcla ocupa todo el volumen.
4.11.- ANLISIS DE PROCESOS DE ACONDICIONAMIENTO DE AIRE.-
Para mantener una vivienda o una construccin industrial a la temperatura y
humedad deseadas se emplean procesos
de acondicionamiento de aire. Estos
procesos incluyen el calentamiento simple
(elevar la temperatura), el enfriamiento
simple (reducir la temperatura), la
humidificacin (agregar humedad) y la
deshumidificacin (eliminar humedad). En
ocasiones dos o ms de estos procesos
son necesarios para llevar el aire a un nivel
de temperatura y humedad deseadas.
Estos procesos se ilustran en la fig.4.6. El
aire se calienta y humidifica en invierno y
se enfra y deshumidifica en verano.
La mayor parte de los procesos de acondicionamiento de aire pueden modelarse
como procesos de flujo permanente y, por tanto, pueden analizarse con los principios
de conservacin de la masa de flujo permanente (tanto para aire seco como para agua)
y de la conservacin de la energa:
s a e a
m m o aire de Masa
, ,
sec = (4.39)
s s a e e a s w e w
m m o m m agua de Masa e e
= =
, , , 1 , 1
(4.40)
=
e e s s
h m h m W Q Energa
(4.41)
Los subndices e y s denotan los estados de entrada y salida, respectivamente.
Los cambios de energa cintica y potencial sern despreciables. El nico trabajo es el
del ventilador, pero al ser muy pequeo frente a los otros trminos, suele despreciarse.
Humidificacin
Deshumidificacin
calentamiento y
humidificacin
Enfriamiento y
deshumidificacin
Calentamiento
Enfriamiento
Fig.4.6
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
92
4.11.1.- Calentamiento y enfriamiento simples.-
En estos procesos (fig.4.6), la humedad especfica del aire permanece
constante, pero la relativa disminuye y se desarrolla en el sentido de las temperaturas
crecientes de bulbo seco para el calentamiento y viceversa para el enfriamiento.
La humedad relativa del aire calentado
puede estar muy por debajo de los niveles de
confort, lo que ocasiona sequedad en la piel,
dificultades respiratorias y aumento de la
electricidad esttica.
En el proceso de enfriamiento a humedad
especfica constante, la temperatura de bulbo seco
disminuye y la humedad relativa aumenta (fig.4.6).
Las ecuaciones de conservacin de la masa para estos procesos de
enfriamiento o calentamiento se reducen a:
( ) ( ) agua para o aire para m m m
a a a 2 1 2 1
; sec e e = = =
y la ecuacin de conservacin de la energa, descartando cualquier trabajo del
ventilador se reduce a:
( )
1 2
h h m Q
a
=
donde h
2
y h
1
son las entalpas por unidad de masa de aire seco a la entrada y a la
salida de la seccin de calentamiento o enfriamiento.
4.11.2.- Calentamiento con humidificacin.-
Los problemas asociados con la humedad relativa baja, producto del
calentamiento simple, se eliminan al humidificar el aire calentado. Esto se consigue al
pasar el aire por una seccin de calentamiento (proceso 1-2) y despus por una
seccin de humidificacin (proceso 2-3) como se muestra en la fig.4.8. La ubicacin del
estado 3 depender de cmo se lleve a cabo la humidificacin:
a) Si se introduce vapor en la seccin
de humidificacin, produce una
razonable humidificacin (
3
>
2
)
con calentamiento adicional (T
3
> T
2
)
b) Si la humidificacin se realiza
rociando agua en la corriente de
aire, parte del calor latente de
vaporizacin provendr del aire, lo que producir enfriamiento en la corriente de
aire calentada (T
3
< T
2
). En este caso el aire debe calentarse a una temperatura
ms alta en la seccin de calentamiento para compensar el enfriamiento durante
el proceso de humidificacin.
T
2
2
=
1
2
<
1
T
1
,
1
,
1
Aire
Fig.4.7
Calor
1
3
>
2
Aire
Fig.4.8
Calentamiento
2
=
1
2 3
Humidificacin
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
93
4.11.3.- Enfriamiento con deshumidificacin.-
La humedad especfica del aire
permanecer constante durante un
proceso de enfriamiento simple, pero su
humedad relativa aumenta. Si la humedad
relativa alcanza niveles extremadamente
altos, tal vez sea necesario
deshumidificarlo; para ello es necesario
enfriar el aire por debajo de su temperatura
de punto de roco.
El proceso de enfriamiento con
deshumidificacin se presenta de forma
esquemtica y en el diagrama
psicromtrico en la fig.4.9.
El aire caliente y hmedo entra a la seccin de enfriamiento en el estado 1. Cuando
pasa por los serpentines de enfriamiento, su temperatura disminuye y su humedad
relativa aumenta (a humedad especfica constante). Si la seccin de enfriamiento
tiene longitud suficiente el aire alcanzar su punto de roco (estado 2, aire
saturado). El enfriamiento adicional del aire originar la condensacin de parte de la
humedad contenida en el aire. Este permanece saturado durante todo el proceso de
condensacin, el cual sigue una lnea de 100% de humedad relativa hasta que
alcanza el estado final (3). El vapor de agua que se condensa fuera del aire, durante
este proceso, se elimina de la seccin de enfriamiento por medio de un canal
independiente, considerndose que el condensado sale a T
3
.
4.11.4.- Enfriamiento evaporativo.-
El enfriamiento evaporativo se basa en un sencillo principio: cuando se evapora
el agua, el calor latente de evaporacin se
absorbe del cuerpo del agua y del aire
circundante; como resultado, tanto el agua
como el aire se enfran durante el proceso
(fig.4.10).
El enfriamiento en climas clidos
relativamente secos se puede conseguir
mediante el enfriamiento evaporativo que
implica, o bien pulverizar agua lquida en el
aire, o bien forzarlo a circular a travs de
un tejido que se mantiene constantemente
mojado con agua, como muestra la
fig.4.10.
Debido a la baja humedad del aire
que entra en el estado 1, parte del agua
inyectada se evapora. La energa para la
evaporacin la suministra la corriente de
14 C 30 C
80%
1
2
3
= 100%
Condensado
Serpentn de
enfriamiento
Aire
T
1
= 30C
= 80%
T
3
= 14C
=100%
Condensado a 14C
Fig.4.9
2
T
1
T
2
1
2
Entalpa de la mezcla por
unidad de masa de aire seco
Fig.4.10
Agua a T
w
T
2
< T
1
2
>
1
Aire hmedo
m
a
, T
1
,
1
Tela hmeda
1
2
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
94
aire, que reduce su temperatura y sale en el estado 2 con una temperatura inferior a
la de su entrada. Como el aire entrante es relativamente seco, la humedad adicional
que transporta la corriente de aire que sale suele ser beneficiosa.
Si el calor intercambiado con el entorno es despreciable y no se realiza trabajo ni
hay variaciones apreciables de energa cintica y potencial, los balances
estacionarios de masa y energa para el volumen de control de la fig.4.10, son:
( ) ( ) ( )
1 1 1 1 2 2 2 2 g a f g a
h h h h h e e e e + + = +
donde h
f
representa la entalpa especfica de la corriente de lquido que entra al
volumen de control. Se supone que toda el agua inyectada se evapora en la
corriente de aire hmedo. El primer miembro del lado derecho de la igualdad
contabiliza el aporte energtico del agua inyectada. Este trmino es normalmente
mucho menor que cualquiera de los dos trminos entlpicos del aire hmedo. Por
consiguiente, la entalpa de la corriente de aire permanece aproximadamente
constante, segn se ve en la fig.4.10. Esto nos recuerda, lo ya dicho, que las
isentlpicas estn muy prximas a las lneas de temperatura de bulbo hmedo
constante y por tanto el proceso se realiza a T
bh
Cte., o bien a h Cte.
4.11.5.- Mezcla adiabtica de corrientes de aire hmedo.-
Un proceso comn en sistemas de acondicionamiento de aire es la mezcla de
corrientes de aire hmedo (fig.4.11).
El objetivo del anlisis termodinmico de este proceso es, habitualmente, fijar el
caudal y el estado de la corriente de salida para unos determinados caudales y
estados de las dos corrientes de entrada.
Teniendo en cuenta que la transferencia de
calor con los alrededores suele ser despreciable
(proceso de mezcla adiabtico), que no hay
interacciones de trabajo y que las variaciones de
energa cintica y potencial son despreciables, las
ecuaciones de conservacin de la masa y la energa
quedan como sigue:
3 2 1
sec
a a a
m m m o aire Masa = + (4.42)
a w v v v
m m como y m m m agua de Masa e = = +
3 2 1
3 3 2 2 1 1 a a a
m m m e e e = + (4.43)
3 3 2 2 1 1
h m h m h m Energa
a a a
= + (4.44)
recordando que, segn la ec.4.35,
v a
h h h e + =
1
3
1
2
Fig.4.11
2
h
1
h
3
h
2
C
A
D B
h
1
1
h
2
2
h
3
3
3
2
1
3
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
95
Si se elimina
3 a
m de las relaciones anteriores, se obtiene:
1 3
3 2
1 3
3 2
2
1
h h
h h
m
m
a
a
=
e e
e e
(4.45)
Esta ecuacin tiene una interpretacin geomtrica instructiva en el diagrama
psicromtrico (fig.4.11). En el se muestra que los estados que satisfacen la ecuacin
1 3
3 2
2
1
e e
e e
=
a
a
m
m
, se indican mediante la lnea AB; por otro lado, los estados que
satisfacen
1 3
3 2
2
1
h h
h h
m
m
a
a
se representan por la lnea CD. El nico estado que
satisface ambas condiciones es el punto de interseccin de estas dos lneas, el cual se
localiza en la recta que une los estados 1 y 2. As se concluye que:
Cuando dos corrientes de aire en dos estados diferentes (1 y 2)
se mezclan adiabticamente, el estado de la mezcla (3) estar
sobre la lnea recta que une los estados 1 y 2 en el diagrama
psicromtrico y que la relacin entre las distancias 2-3 y 3-1 es
igual a la relacin de los flujos de masa
1 a
m y
2 a
m .
Por tener forma cncava la curva de saturacin y teniendo en cuenta la
conclusin anterior, cabe pensar que cuando los estados 1 y 2 se encuentren prximos
a la curva de saturacin, la lnea recta que une ambos estados cruce la lnea de
saturacin y el estado 3 tal vez se encuentre a la izquierda de dicha curva. En este
caso, algo de agua se condensar inevitablemente durante el proceso de mezcla.
4.11.6.- Torres de refrigeracin.-
Las centrales termoelctricas descargan forzosamente, por transferencia de
calor una gran cantidad de energa al
entorno. Aunque se emplea frecuentemente
agua de algn ro o lago cercano, en
aquellas localidades donde no se puede
obtener agua de refrigeracin en cantidades
suficientes o donde existen limitaciones
ambientales para la temperatura a la que se
puede devolver el agua al entorno, existe la
alternativa de las torres de refrigeracin.
Estas se emplean tambin para suministrar
agua fra en otro tipo de plantas.
Las torres de refrigeracin pueden ser
de tiro natural o forzado. Sus flujos pueden
ser a contracorriente, cruzados o una
combinacin de ambos. Un diagrama
esquemtico de una torre de refrigeracin
forzada a contracorriente se presenta en la
Fig.4.12
m
a
, T
4
,
4
>
3
Salida de aire hmedo
Agua de retorno
m
w2
, T
2
<
Agua de entrada
Aire atmosfrico
m
a
, T
3
,
3
m
w1
, T
1
Agua caliente
Ventilador
Lquido
1
3
2
4
5
INGENIERA TRMICA TEMA 4
Universidad de Jan. rea de Mquinas y Motores Trmicos
Jos Manuel Palomar Carnicero ; Fernando Cruz Peragn ; Vicente Montoro Montoro
96
fig.4.12. El agua caliente a refrigerar que entra en 1 se pulveriza en lo alto de la torre.
El agua que cae pasa habitualmente a travs de un conjunto de deflectores cuyo
objetivo es mantenerla dispersa en gotas finas para facilitar la evaporacin. En el punto
3 entra aire atmosfrico que es aspirado hacia arriba por el ventilador y circula en
sentido opuesto al de las gotas de agua que caen. Al interaccionar ambas corrientes,
una pequea fraccin de agua se evapora en el aire hmedo, que sale en 4 con una
mayor humedad especfica que la que tena al entrar en 3. La energa necesaria para la
evaporacin procede principalmente del agua que no se evapora, con el resultado de
que el agua que sale en 2 se encuentra a menor temperatura que la que entra en 1.
Puesto que parte del agua entrante se evapora, una cantidad equivalente de agua de
reposicin se aade en 5 de manera que el caudal de agua que retorna es el mismo
que el del agua caliente que entra en 1.
En estado estacionario, los balances de masa para el aire seco y el agua y el
balance de energa para el conjunto de la torre proporcionan informacin sobre su
rendimiento. Al aplicar el balance de energa se suele despreciar el intercambio de
calor con el entorno. La energa para mover el ventilador de las torres de tiro forzado
tambin se pueden despreciar frente a los otros intercambios de energa presentes.
, , , 3 , 4
sec
a e a s a a a
Masa aire o m m m m m = = =
( )
, , , 3 3 1 , 4 4 2
1 2 4 3
a e e a s s a w a w
w w a reposicin
Masa de agua m m m m m m
m m m m
e e e e
e e
= + = +
= =
( ) ( )
, 4 4 2 2 , 3 3 1 1
4 3 1 2 1 1
0 0
0
s s e e a w a w
a w reposicin w
Energa m h m h m h m h m h m h
m h h m m h m h
= = +
= +
Você também pode gostar
- AIRE Problemas Resueltos P1Documento5 páginasAIRE Problemas Resueltos P1Marcial Nuñez75% (4)
- Informe de Laboratorio Capacidad CalorificaDocumento4 páginasInforme de Laboratorio Capacidad CalorificaBrayan JimenezAinda não há avaliações
- EL AJEDREZ. Institución Educativa Emiliano GarcíaDocumento35 páginasEL AJEDREZ. Institución Educativa Emiliano GarcíaFrancesco RossetiAinda não há avaliações
- Unidad 3 Cálculo Vectorial Funciones Vectoriales de Una Variable Real.Documento32 páginasUnidad 3 Cálculo Vectorial Funciones Vectoriales de Una Variable Real.Jennifer Zazueta100% (1)
- Unidad 5. Actividad 1. Cálculo Medidas DispersiónDocumento5 páginasUnidad 5. Actividad 1. Cálculo Medidas DispersiónJulio DíazAinda não há avaliações
- Recomendaciones Maestros FIME 2022Documento24 páginasRecomendaciones Maestros FIME 2022Bhir SahaadAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 697Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 697jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 699Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 699jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 700Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 700jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 698Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 698jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 695Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 695jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 694Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 694jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 696Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 696jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 682Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 682jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 678Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 678jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 692Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 692jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 688Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 688jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 689Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 689jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 693Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 693jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 686Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 686jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 687Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 687jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 684Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 684jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 683Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 683jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 680Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 680jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 685Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 685jaagoodAinda não há avaliações
- Certificación de La Instalación de Una Red PDFDocumento1 páginaCertificación de La Instalación de Una Red PDFjaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 679Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 679jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 681Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 681jaagoodAinda não há avaliações
- MAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 677Documento1 páginaMAYNARD. Manual Del Ingeniero Dustrial I - William K. Hodson 677jaagoodAinda não há avaliações
- Inst. Telecomunicacións 0-36 14Documento1 páginaInst. Telecomunicacións 0-36 14jaagoodAinda não há avaliações
- Inst. Telecomunicacións 0-36 13Documento1 páginaInst. Telecomunicacións 0-36 13jaagoodAinda não há avaliações
- Inst. Telecomunicacións 0-36 17Documento1 páginaInst. Telecomunicacións 0-36 17jaagoodAinda não há avaliações
- Inst. Telecomunicacións 0-36 18Documento1 páginaInst. Telecomunicacións 0-36 18jaagoodAinda não há avaliações
- Inst. Telecomunicacións 0-36 15Documento1 páginaInst. Telecomunicacións 0-36 15jaagoodAinda não há avaliações
- Inst. Telecomunicacións 0-36 16Documento1 páginaInst. Telecomunicacións 0-36 16jaagoodAinda não há avaliações
- Parte1 5 PDFDocumento1 páginaParte1 5 PDFjaagoodAinda não há avaliações
- Gráficos Estadísticos PDFDocumento17 páginasGráficos Estadísticos PDFHarvey Leonardo Reina RodriguezAinda não há avaliações
- Apel, El Desafío de La Crítica Total A La Razón y El Programa de Una Teoría Filosófica de Ls Tipos de RacionalidadDocumento34 páginasApel, El Desafío de La Crítica Total A La Razón y El Programa de Una Teoría Filosófica de Ls Tipos de RacionalidadPasajera OníricaAinda não há avaliações
- Esquema Del Perfil Del Trabajo de InvestigacionDocumento10 páginasEsquema Del Perfil Del Trabajo de Investigacionleonardo vidal corralesAinda não há avaliações
- Guia N5 Matema 3p 4 GradoDocumento8 páginasGuia N5 Matema 3p 4 GradoYaritza Bonilla YañezAinda não há avaliações
- MCD y MCMDocumento3 páginasMCD y MCMapi-295885253Ainda não há avaliações
- Calendario Maya AnualDocumento3 páginasCalendario Maya Anualelizabeth canizal marinAinda não há avaliações
- Redondeo de Cifras o NúmerosDocumento6 páginasRedondeo de Cifras o NúmerosWenceslao MartinezAinda não há avaliações
- Definiciones AeronauticasDocumento4 páginasDefiniciones AeronauticasBrunoAinda não há avaliações
- Taller 3 Calculo Diferencial Leider SalcedoDocumento13 páginasTaller 3 Calculo Diferencial Leider SalcedoCristian Mercado UrielesAinda não há avaliações
- Capac SpectorDocumento16 páginasCapac SpectorinzyAinda não há avaliações
- Parcial Algoritmia y Programación 03D Tipo 1 Céd ImparDocumento2 páginasParcial Algoritmia y Programación 03D Tipo 1 Céd ImparRoberto Porto BarcelóAinda não há avaliações
- Papus - El Tarot de Los Bohemios (Parte 2)Documento47 páginasPapus - El Tarot de Los Bohemios (Parte 2)puirgolAinda não há avaliações
- Fisica 1 Resultado de Una MedicionDocumento10 páginasFisica 1 Resultado de Una MedicionCarlos CelisAinda não há avaliações
- 11 Hidrologia Precipitacion Dist Espacial ArcGISDocumento29 páginas11 Hidrologia Precipitacion Dist Espacial ArcGISHugo Alberto0% (1)
- SR JoseDocumento5 páginasSR JoseAlejandro Antonio Lopez GaitanAinda não há avaliações
- Acm 001Documento7 páginasAcm 001chinchay95Ainda não há avaliações
- Tema 11 - Estadística BidimensionalDocumento12 páginasTema 11 - Estadística BidimensionalElena Martínez MazónAinda não há avaliações
- S11. Control ProporcionalDocumento28 páginasS11. Control ProporcionalBryan QueaAinda não há avaliações
- Practica 4Documento2 páginasPractica 4Aleja Acero AlmanzaAinda não há avaliações
- Iv Concurso de Matem Atica BINARIA 2014 - Etapa Final Cuarto y Quinto de SecundariaDocumento2 páginasIv Concurso de Matem Atica BINARIA 2014 - Etapa Final Cuarto y Quinto de SecundariaJhoncito CalcinaAinda não há avaliações
- NMX Aa 007 Scfi 2000Documento28 páginasNMX Aa 007 Scfi 2000Yohnatan VegaAinda não há avaliações
- Reflexión y Refracción de La LuzDocumento21 páginasReflexión y Refracción de La LuzronaldroviraAinda não há avaliações
- Ic0505 Mecanica de Fluidos Sílabo 2023-I (1) - 10Documento4 páginasIc0505 Mecanica de Fluidos Sílabo 2023-I (1) - 10YADHIRA ANDREA HILARIO RAMIREZAinda não há avaliações
- F H Topografia Jaime Orlando Montoya EstradaDocumento5 páginasF H Topografia Jaime Orlando Montoya EstradaRafael Pacompia FloresAinda não há avaliações