Escolar Documentos
Profissional Documentos
Cultura Documentos
Estado Liquido
Enviado por
Maria Marcela MenardDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estado Liquido
Enviado por
Maria Marcela MenardDireitos autorais:
Formatos disponíveis
Estado liquido:
Momento dipolar:
Es el producto de las carga por la longitud entre las cargas.
Fuerza ion-dipolo:
Son aquellas las cuales atraen entre s a un ion y a una molcula polar. Esta fuerza de atraccin
depende de la carga y tamao del ion as como de la magnitud del momento dipolar y del tamao
de la molcula.
Fuerza ion-ion:
Se establece entre iones de igual o distinta carga. Los iones que poseen distinta carga son los que
se atraen, los que poseen la misma carga se repelen
Fuerza dipolo-dipolo :
Son las fuerzas de atraccin entre molculas polares, es decir entre molculas que poseen
momentos dipolares. A mayor momento dipolar mayor ser la fuerza.
Fuerza ion-dipolo inducido:
Es la fuerza de atraccin que se da entre un ion y una molcula no polar
Un ion puede deformar (polarizar) la nube electrnica de una molcula neutra, generando un
dipolo inducido.
La polarizabilidad:
es que tan fcil se distorsiona la distribucin electrnica del tomo, y es proporcional a la masa
molecular y la extensin de la nube electrnica. El carcter polarizarle de los gases que contienen
tomos o molculas no polares les permite condensarse.
Dipolo inducido:
Si un ion o una molcula polar se acerca a un tomo, la distribucin electrnica del tomo se
distorsiona por la fuerza que ejerce el ion o la molcula polar, dando lugar a lo que se conoce
como dipolo inducido.
Fuerza de dipolo instantneo:
En un instante cualquiera los tomos pueden tener un momento dipolar generado por las
posiciones especficas de los electrones. Se denomina instantneo porque solo dura una pequea
fraccin de segundos. Este proceso se puede repetir varias veces.
Fuerza de dispersin:
Son aquellas fuerzas de atraccin que se generan a partir de los dipolos temporales inducidos en
los tomos o molculas. Estas fuerzas, a temperaturas muy bajas, son las que permiten que los
gases se condensen. Aumenta con la masa molar y el nmero de electrones.
Puente de hidrogeno:
Es un tipo especial de interaccin dipolo-dipolo entre el tomo de hidrogeno y un enlace polar.
Vale destacar que esta atraccin intermolecular es muy fuerte, por este motivo las molculas que
se unan mediante la misma tendrn un alto punto de ebullicin.
Tensin superficial:
Las molculas de los lquidos de la superficie son atradas hacia los costados y hacia abajo por
otras molculas, pero no hacia arriba de la superficie. En conciencia estas atracciones
intermoleculares tienden a atraer esas molculas hacia el lquido lo que ocasiona que la superficie
se tense como si fuera una pelcula elstica. La tensin superficial es la cantidad de energa
necesaria para estirar o aumentar la superficie de un liquido por unidad de rea.
Fuerza de cohesin:
Son las fuerzas intermoleculares que hay entre molculas de la misma sustancia, como los puentes
de hidrgeno en las molculas de agua.
Fuerza de adhesin:
Son las fuerzas intermoleculares que se genera entre molculas de sustancias diferentes.
Viscosidad:
Es una medida de la resistencia de los lquidos a fluir. Cuanto ms viscoso es un lquido ms lento
es su flujo. La viscosidad de un lquido suele aumentar con la temperatura.
Los lquidos con fuerza intermoleculares fuertes son ms viscosos que los que tienen fuerzas
intermoleculares dbiles.
Ascenso capilar:
El ascenso capilar se debe a la fuerza de adhesin y cohesin.
Si la fuerza de adhesin es mas fuerte que la de cohesin el contenido del tubo es impulsado hacia
arriba. Este proceso continua hasta que la fuerza adhesiva se contrarresta por el peso del agua.
Cuando la fuerza de cohesion es mayor que la de adhesin la altura del liquido es mayor que la
que se encuentra dentro del tubo(esto sucede con el mercurio)
Vaporizacin de los lquidos:
Las situaciones a y b son aquellas que no estn en equilibrio dinmico. La situacin c alcanza el
equilibrio dinmico.
El equilibrio dinmico se da cuando la velocidad de condensacin es exactamente la misma que la
de vaporizacin.
La presin de vapor es la presin ejercida por el vapor cuando esta se encuentra en equilibrio con
su fase condensada.
Punto de ebullicin:
El punto de ebullicin es la temperatura a la cual la presin de vapor de un lquido es igual a la
presin externa(presin atmosfrica). El punto de ebullicin normalmente de un liquido es la
temperatura a la cual hierve cuando la presin externa es de 1 atm. Las fuerzas intermoleculares
fuertes suelen conducir a un alto punto de ebullicin.
Punto de fusin:
Es la temperatura a la cual las fases solida y liquida coexisten en equilibrio. El punto de fusin
normal de una sustancia es la temperatura a la cual una sustania se funde a 1 atm de presin.
Diagrama de fases:
Un diagrama de fases resume las condiciones en las cuales una sustancia existe como solido
liquido o gas. Este diagrama de fases posee un punto triple que indica a la nica condicin en el
que las tres fases de la sustancia pueden estar en equilibrio entre si.
Los diagramas de fase permiten predecir cambios en el punto de fusin y ebullicin debido a los
cambios de presin externa.
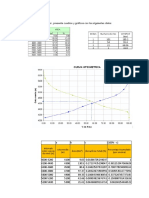
Diagrama de fases del agua:
Você também pode gostar
- (2016) Qué Es El EnsayoDocumento33 páginas(2016) Qué Es El EnsayoMaria Marcela MenardAinda não há avaliações
- Ponencia Zwanck Jornadas 2007Documento12 páginasPonencia Zwanck Jornadas 2007Maria Marcela MenardAinda não há avaliações
- 703569457.el Eternauta I II y IIIDocumento2 páginas703569457.el Eternauta I II y IIIMaria Marcela MenardAinda não há avaliações
- 1 Definiciones Texto Discurso Enunciado Maingeneau MarcheseDocumento3 páginas1 Definiciones Texto Discurso Enunciado Maingeneau MarcheseEmiliaGabrielaAinda não há avaliações
- Novela PolicialDocumento1 páginaNovela PolicialMaria Marcela MenardAinda não há avaliações
- Los Asesinos, HemingwayDocumento14 páginasLos Asesinos, HemingwayletrasdelfondoAinda não há avaliações
- Qué Significa Progresar en Competencia LiterariaDocumento8 páginasQué Significa Progresar en Competencia Literariacavil2006Ainda não há avaliações
- Leng8 Docentes PDFDocumento16 páginasLeng8 Docentes PDFRosana ColomboAinda não há avaliações
- Burton - La Piedra y La Raíz - SelecciónDocumento11 páginasBurton - La Piedra y La Raíz - SelecciónMaria Marcela MenardAinda não há avaliações
- Ciencia FicciónDocumento3 páginasCiencia FicciónMaria Marcela MenardAinda não há avaliações
- Bremond Poesía PuraDocumento22 páginasBremond Poesía PuraMaria Marcela Menard100% (2)
- Burton - La Piedra y La Raíz - SelecciónDocumento11 páginasBurton - La Piedra y La Raíz - SelecciónMaria Marcela MenardAinda não há avaliações
- 4 - Manual de Argumentación para Web Capitulo 4Documento23 páginas4 - Manual de Argumentación para Web Capitulo 4Andrés SerranoAinda não há avaliações
- El Grito SagradoDocumento3 páginasEl Grito SagradoMaria Marcela MenardAinda não há avaliações
- Como Citar Hacer Referencias APADocumento10 páginasComo Citar Hacer Referencias APASylvie CarballoAinda não há avaliações
- El Microrrelato Es Una Narración Literaria Que Se Caracteriza Por Los Siguientes RasgosDocumento2 páginasEl Microrrelato Es Una Narración Literaria Que Se Caracteriza Por Los Siguientes RasgosMaria Marcela MenardAinda não há avaliações
- Cronologias de Aprendizaje - TerigiDocumento28 páginasCronologias de Aprendizaje - TerigiMaria Marcela MenardAinda não há avaliações
- El Discutible Canon ArgentinoDocumento3 páginasEl Discutible Canon ArgentinoMaria Marcela MenardAinda não há avaliações
- WilliamsDocumento2 páginasWilliamsMaria Marcela MenardAinda não há avaliações
- Como Mil FloresDocumento34 páginasComo Mil FloresMacky Poeta100% (1)
- Cruzar La NocheDocumento101 páginasCruzar La NocheClaudio ZamparAinda não há avaliações
- Abrams Espejo y LámparaDocumento52 páginasAbrams Espejo y LámparaMaria Marcela MenardAinda não há avaliações
- 8 Juan López y John WardDocumento1 página8 Juan López y John WardMaria Marcela MenardAinda não há avaliações
- Dussel - Currículum y Conocimiento en La Escuela Media ArgentinaDocumento9 páginasDussel - Currículum y Conocimiento en La Escuela Media ArgentinaNerakAinda não há avaliações
- Lectura Fácil Métodos de Redacción y Evaluación - Feaps MadridDocumento72 páginasLectura Fácil Métodos de Redacción y Evaluación - Feaps MadridLorenzo CarmonaAinda não há avaliações
- La Pedagogia de Paulo FreireDocumento6 páginasLa Pedagogia de Paulo FreireMaria Marcela MenardAinda não há avaliações
- Cuad Alfabet Academica 2012 PDFDocumento36 páginasCuad Alfabet Academica 2012 PDFMaria Marcela MenardAinda não há avaliações
- Teorias LiterariasDocumento19 páginasTeorias LiterariasMaria Marcela MenardAinda não há avaliações
- Ponencia Zwanck Jornadas 2007Documento12 páginasPonencia Zwanck Jornadas 2007Maria Marcela MenardAinda não há avaliações
- Formas de Representar La TierraDocumento4 páginasFormas de Representar La TierraJose Reynold Quintanilla100% (1)
- Analisis Precios Unitarios AGUA FRIA Y AGUA CALIENTE FFDocumento6 páginasAnalisis Precios Unitarios AGUA FRIA Y AGUA CALIENTE FFJairo Polopon Jeferson0% (1)
- AcroleinaDocumento15 páginasAcroleinakevin_ru_icq9831Ainda não há avaliações
- Informe Determinacion de Solidos en El Agua PDFDocumento6 páginasInforme Determinacion de Solidos en El Agua PDFGlenis RozoAinda não há avaliações
- Analisis de Situacion de Salud La Guardia Dra CarolDocumento35 páginasAnalisis de Situacion de Salud La Guardia Dra CarolgenesisAinda não há avaliações
- Universidad Peruana Los AndesDocumento36 páginasUniversidad Peruana Los AndesMary SilveraAinda não há avaliações
- Memoria de Calculo Cam Rejas LariDocumento8 páginasMemoria de Calculo Cam Rejas LarijosehernaniAinda não há avaliações
- 24-08 Distribucion Del Agua en La TierraDocumento2 páginas24-08 Distribucion Del Agua en La TierraCarmen Helena Sampayo BenavidesAinda não há avaliações
- Plano de Agua ResidualDocumento1 páginaPlano de Agua ResidualMarioly Rodriguez Vidal100% (1)
- Calle Farfan PC1Documento16 páginasCalle Farfan PC1alvaro calleAinda não há avaliações
- Nota2-Edic.49 2024Documento9 páginasNota2-Edic.49 2024JohnAinda não há avaliações
- 01-Caratula - SeparadorDocumento7 páginas01-Caratula - Separadorjose luis meza galianoAinda não há avaliações
- Sistemas Hidraulicos PDFDocumento93 páginasSistemas Hidraulicos PDFdaniloAinda não há avaliações
- Material de ApoyoDocumento12 páginasMaterial de ApoyoMario Herrera CartesAinda não há avaliações
- Campos Maduros y MarginalesDocumento24 páginasCampos Maduros y MarginalesAlexander Mamani RuizAinda não há avaliações
- GARDENA MygardenDocumento9 páginasGARDENA MygardenmicochetoledoAinda não há avaliações
- 1101propiedades de Aislapol 1225760698745114 9Documento4 páginas1101propiedades de Aislapol 1225760698745114 9Mauricio RamirezAinda não há avaliações
- Taller de Contaminación Ambiental (2009)Documento16 páginasTaller de Contaminación Ambiental (2009)gonabeAinda não há avaliações
- Metodo de Curva MasaDocumento12 páginasMetodo de Curva MasaDany Frank Taquila VelásquezAinda não há avaliações
- Reino Animal ExposicionDocumento23 páginasReino Animal ExposicionJudith Villanueva QuispeAinda não há avaliações
- Trabajo de Abastecimiento de Aguasy Desague SWMMDocumento23 páginasTrabajo de Abastecimiento de Aguasy Desague SWMMHumberto Alejandro Montes SánchezAinda não há avaliações
- P.N de Trucha Arco IrisDocumento47 páginasP.N de Trucha Arco IrisSantiago Fortunatoc Cercado RamosAinda não há avaliações
- Desierto Del PacificoDocumento3 páginasDesierto Del PacificoMaico Castillo AlemanAinda não há avaliações
- Formato Trabaja Peru - ConcursableDocumento67 páginasFormato Trabaja Peru - ConcursableEsau Cabanillas CristobalAinda não há avaliações
- Preinforme de LaboratorioDocumento4 páginasPreinforme de LaboratorioJimmy NarvaezAinda não há avaliações
- Rio UribanteDocumento3 páginasRio UribanteJhosemaryBlancoVillarrealAinda não há avaliações
- AST BH SERVICIOS Escalera TelescopicaDocumento4 páginasAST BH SERVICIOS Escalera TelescopicaPatricio Sarmiento ParraAinda não há avaliações
- Intemperismo y ErosionDocumento4 páginasIntemperismo y ErosionFrancisco Eduardo Gil HurtadoAinda não há avaliações
- Estudio de RiesgosDocumento45 páginasEstudio de Riesgosheydi garay riosAinda não há avaliações
- Dolomita Alpha Organic de Mexico SRL de CVDocumento20 páginasDolomita Alpha Organic de Mexico SRL de CVAlonso RangelAinda não há avaliações