Escolar Documentos
Profissional Documentos
Cultura Documentos
El Sistema de Complemento Está Constituido Por Moléculas Implicadas Principalmente en La Defensa Frente A Infecciones y Células Tumorales
Enviado por
KarlaItzelDom0 notas0% acharam este documento útil (0 voto)
34 visualizações10 páginasTítulo original
El Sistema de Complemento Está Constituido Por Moléculas Implicadas Principalmente en La Defensa Frente a Infecciones y Células Tumorales
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
34 visualizações10 páginasEl Sistema de Complemento Está Constituido Por Moléculas Implicadas Principalmente en La Defensa Frente A Infecciones y Células Tumorales
Enviado por
KarlaItzelDomDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 10
El sistema de complemento est constituido por molculas
implicadas principalmente en la defensa frente a infecciones y
clulas tumorales. Parte de los factores del complemento
potencian la inflamacin y la fagocitosis y actan produciendo
la lisis de clulas y microorganismos. El complemento es
especialmente importante frente a grmenes gram negativos
que pueden ser directamente lisados por anticuerpos y
complemento.
La mayor parte de los factores del complemento son protenas
plasmticas y una pequea proporcin de ellos son protenas
de membrana (Tabla 13.1). Muchos de los componentes del
complemento (C2, C3, C4, C6, C7, C8, Factor B y Factor I) son
polimrficos, es decir que existen diferentes formas allicas
que se expresan con distintas frecuencias en poblaciones o
razas.
El hepatocito es el principal productor de factores del
complemento. No obstante, por ejemplo los componentes de
C1 son sintetizados por las clulas epiteliales del intestino y del
sistema genito-urinario y los adipocitos sintetizan factor D. Se
ha observado que los macrfagos activados producen algunos
factores del complemento; sin embargo, esto solo tiene
importancia, en el foco inflamatorio. Las citocinas inflamatorias
(IL1, IL6 y TNF) e IFN-gamma incrementan la sntesis de algunos
factores del complemento en el hgado.
ACTIVACION DEL COMPLEMENTO
En la activacin del complemento se pone en marcha una serie
de reacciones consecutivas en cascada, de tal forma que a
partir de cada una de ellas se genera un producto activo que
adems de determinar que la reaccin consecutiva prosiga,
puede tener diferentes acciones biolgicas importantes en la
defensa del organismo. Se puede ver este conjunto de
reacciones en cascada en la figura 13.1.
Algunos de los factores del complemento son enzimas con
carcter proteoltico, de tal forma que durante el proceso de
activacin, algunas molculas son rotas en fragmentos a los que
para identificarlos se les aade letras minsculas (Ej. C3a, C3b).
Estos fragmentos poseen importanes funciones biolgicas y son
mediadores de la inflamacin.
La activacin del complemento puede iniciarse por dos vas: la
va clsica y la va alternativa. La va clsica se activa por la
unin antgeno-anticuerpo, mientras que la va alternativa se
activa por productos bacterianos. En ambas vas el factor C5 se
transforma en C5b lo que permite, en uno y otro caso, poder
entrar en la va terminal o ltica que conduce a la lisis celular o
bacteriana (Figura 13.1)
Una vez producida la activacin del complemento, toda la serie
de reacciones subsiguientes se llevan a cabo por un proceso
multiplicador, de tal forma que, aunque la activacin comienza
por un nmero limitado de molculas, son muchos los factores
con actividad biolgica que aparecen en el curso de las
reacciones. La accin de las molculas puede ser local, en el
sitio de su produccin, pero tambin puede ejercerse a
distancia por dispersin a otras zonas. Un esquema general de
las reacciones del complemento en su conjunto es complejo
(Figura 13.2).
VIA ALTERNATIVA
Esta va es ms antigua desde el punto de vista evolutivo- que
la clsica, diferencindose adems de sta en que la va
alternativa no necesita anticuerpos para activarse, por lo que es
un mecanismo de defensa importante en los estadios iniciales
de la infeccin cuando todava no se han sintetizado cantidades
importantes de anticuerpos. Funciona de forma continua a un
bajo nivel y solo en presencia de determinados factores se
amplifica. Por ello, podemos distinguir dos situaciones para la
va alternativa: en estado de reposo y en estado de activacin.
La va alternativa en estado de reposo
En condiciones normales, en el plasma, el factor C3 se escinde
continuamente y de forma lenta, en un proceso que se
denomina marcapasos de C3, dando lugar a C3b y quedando as
su enlace tioester interno expuesto. Si no se une a la superficie
de algn microorganismo C3b permanece en fase fluida y se
combina con una molcula de agua, quedando as su
enlace tioester hidrolizado y el C3b inactivo (Figura 13.3) El
factor B es equivalente al factor C2 de la va clsica.
El factor D circula en la sangre de forma activada aunque no es
perjudicial para el organismo, debido a su baja concentracin.
Este factor tiene actividad esterasa de tipo serina y unindose
al complejo C3bB rompe a B en una pequea fraccin, Ba, que
se libera y en una de mayor peso molecular, Bb, que se
mantiene unida al complejo (C3bBb). Este complejo, que
permanece en la fase fluida, tiene actividad convertasa de C3
de la va alternativa, es decir que puede degradar a C3 en dos
fracciones: C3a y C3b, radicando la actividad proteoltica del
complejo en la molcula Bb.
El factor C3b puede unirse covalentemente mediante enlace
ster o amida a las membranas celulares (Figura 13.4), incluso a
las propias, captando ms factor B y amplificando el proceso, lo
que permitira la entrada en la va ltica. No obstante, en
condiciones normales o de reposo, esto no ocurre ya que C3b
tiene una vida media muy corta. Por otra parte, los sistemas de
regulacin que se comentarn ms abajo mantienen en un bajo
nivel el funcionamiento de este circuito.
Amplificacin de la va alternativa
Cuando C3b se une a las membranas de bacterias, hongos y
parsitos, los mecanismos de regulacin que bloquean la
amplificacin en el estado de reposo no funcionan. El factor
C3b sobre estas membranas capta factor B formando el
complejo C3bB sobre el que acta el factor D liberando Ba y
quedando el complejo C3bBb que tiene actividad convertasa de
C3, siendo Bb la molcula responsable de la actividad
proteoltica. Esa convertasa libera ms factor C3b que al formar
C3bBb3b retroalimenta el circuito y consigue su amplificacin
(Figura 13.2).
El complejo C3bBb3b adems puede actuar sobre C5 (C3bBb3b
es la convertasa de C5 de la va alternativa) e iniciar la va ltica
que lleva a la lisis de los grmenes. C3b puede unirse a
receptores en la membrana de los fagocitos lo que favorece la
fagocitosis. Por otra parte el fragmento C3a, por su actividad de
anafilotoxina, activa mastocitos y basfilos, induciendo la
liberacin de mediadores qumicos por parte de estas clulas,
lo que potencia la inflamacin.
La properdina (P) es una protena constituida por 4 subunidades
aparentemente idnticas asociadas entre s de manera no
covalente. Este factor se une al complejo C3bBb, que es lbil,
dando lugar a C3bBbP que es ms estable lo que contribuye a la
amplificacin.
Tambin puede amplificar la va alternativa el factor C3b
generado en la va clsica, suponiendo este fenmeno un
mecanismo de conexin entre ambas vas
El veneno de cobra contiene un factor (CVF, cobra venenom
factor) que acta de forma semejante a C3b formando un
complejo muy estable CVFBb que puede liberar grandes
cantidades de C3b y producir, por agotamiento, una depleccin
de C3 del plasma.
VIA CLASICA
Se inicia tras la unin Ag-Ac y siempre que el anticuerpo que
participe en ello sea del tipo IgM o IgG de las clases IgG1, IgG2 o
IgG3. Los anticuerpos solubles o libres no activan el
complemento, solo se activa este sistema cuando se forman
complejos antgeno-anticuerpo (Ag-Ac). En el caso de la IgG,
que es una Ig monomrica, se necesitan al menos dos
complejos Ag-Ac cercanos para que las fracciones Fc de la IgG
unan y activen el factor C1. En el caso de la IgM, al ser una
molcula pentamrica, solo es necesario un complejo Ag-Ac. La
unin de la Ig al antgeno, induce un cambio conformacional en
los dominios de la regin Fc que permite la unin del factor C1.
Factor C1
El factor C1 est compuesto por tres subunidades proteicas (q, r
y s), que en el momento de la activacin del complemento se
unen entre s por enlaces dependientes del Ca
++
formando un
complejo constituido con una unidad de C1q, 2 de C1r y 2 de
C1s (C1qr
2
s
2
).
La molcula C1q es una protena con dos partes bien
diferenciadas, globular y fibrilar (Figura 13.5). Parece ser que en
las porciones globulares se encuentran los sitios de
combinacin con el anticuerpo con los que se une solo cuando
ste est unido al Ag. Las porciones fibrilares poseen una
estructura qumica que guarda similitud con el colgeno, con
gran cantidad de aminocidos hidroxilados que unen
disacridos de glucosa y galactosa. El complejo molecular C1q
est integrado por 18 cadenas polipeptdicas organizadas en
seis subunidades idnticas.
Activacin de C1
La subunidad C1q se fija al anticuerpo en los sitios de unin que
son el dominio CH2 de la IgG y el CH3 y/o CH4 de la IgM). Este
fenmeno es el primero que ocurre en la activacin mediada
por anticuerpos de la va clsica del complemento y es el que
pone en marcha la cascada de reacciones subsiguientes. El
fragmento C1q va a activar a las dos subunidades C1r, que
actuar sobre las dos C1s que, entonces, adquieren actividad de
esterasa de tipo serina, responsable de iniciar las fases
siguientes.
Para que se produzca la activacin de C1q, ste debe estar
unido por su regin globular al menos a dos dominios de
distinta fraccin Fc (Figura 13.6). Esto implica que los
anticuerpos, para activar al complemento, han de encontrarse
con la disposicin espacial apropiada que permita a C1q
acoplarse a varios de ellos al mismo tiempo (complejos Ag-Ac
dispersos sobre una superficie celular pueden no llegar a
activar el complemento). C1q, por otra parte, solo se une a
inmunoglobulinas cuando stas, a su vez, se encuentran unidas
a sus antgenos y stos estn integrados en una misma
superficie (membrana celular). Este concepto es importante
para comprender por qu complejos antgeno-anticuerpo
solubles no conectados con membranas, pueden convivir en el
suero con los factores del complemento sin llegar a activarlos y
que, por el contrario, si se activan cuando tales complejos
quedan atrapados sobre algn tejido, originando, en este caso,
un proceso inflamatorio localizado.
La activacin de C1q provoca que una molcula de C1r del
complejo C1qr2s2 pierda por autocatlisis un trozo de bajo
peso molecular, quedando activada. Esta molcula, a su vez,
activa a la otra molcula de C1r. Las dos molculas de C1r
atacan a las dos molculas de C1s liberando sendos trozos de
bajo peso molecular y dejando expuestos sus dominios
catalticos.
La MBP (mannose-binding protein) es una molcula del grupo
de las colectinas (protenas con colas de colgeno y dominios
globulares de tipo lectina). Esta protena reconoce
carbohidratos en distintos grmenes, lo que le permite unirse a
ellos y tiene la capacidad de sustituir a C1q en la activacin de
C1r y C1s, pudiendo iniciar de esta forma la va clsica. A su vez,
la MASP (MBP associated binding protease) es una proteasa de
tipo serina que puede sustituir a C1r y C1s en la activacin de la
va clsica. Estos resultados han determinado que algunos
autores hablen de una tercera va de activacin del
complemento: La Va de la Lectina.
Activacin de C4 y C2
C1s del complejo C1q2r2s va a actuar sobre la cadena a de C4
produciendo su escisin en dos molculas, una pequea, C4a,
que difunde a la fase fluida y otra mayor, C4b, que se une por
enlace covalente de tipo ster o amida (equivalente al del C3b)
a la superficie celular. Esta fraccin C4b unida a la membrana,
en presencia de iones Mg
++
, forma un complejo con la fraccin
C2. C1s tambin acta sobre C2, provocando la escisin de esta
molcula en dos fragmentos, uno menor C2b y otro mayor C2a.
Este ltimo se une al C4b para formar el complejo C4b2a
(convertasa C3 de la va clsica), que tiene actividad estersica
(Figura 13.7).
Convertasa de C5 de la va clsica
El complejo C4b2a, cuyo centro activo se encuentra en el
componente C2a, acta sobre la cadena a del factor C3 que se
transforma por proteolisis en dos fragmentos activos: la
anafilotoxina C3a, que pasa al medio lquido, y el fragmento
C3b que se une a la membrana celular mediante un enlace de
tipo ster o amida. Al complejo formado por C4b2a3b se le
denomina convertasa de C5 de la va clsica ya que tiene
capacidad de actuar sobre este factor, siendo ste el primer
paso de la denominada va ltica. (Figura 13.2).
El factor C3b unido a la membrana celular tambin puede ser
captado por los fagocitos, que al presentar receptores de
membrana para C3b, se facilita de esta forma el proceso de la
fagocitosis (opsonizacin) (Tabla 13.2).
La anafilotoxina C3a, por otra parte, potencia la inflamacin al
inducir la desgranulacin de los basfilos y mastocitos y liberar,
por tanto, mediadores de la inflamacin. El incremento de la
permeabilidad capilar facilita el acceso al foco de nuevos
factores del complemento y de inmunoglobulinas desde la
sangre, as como la llegada de fagocitos que son movilizados
por la actividad quimiotxica del propio C3a y otros factores
quimiotxicos del foco inflamatorio (Tabla 13.2).
VIA LITICA. FORMACION DEL COMPLEJO DE ATAQUE A LA
MEMBRANA
Las reacciones finales del complemento se encuentran
esquematizadas en la Figura 13.8. Las enzimas convertasas de
C5 (C4b2a3b y C3bBb3b), formadas ya sea en la va clsica o en
la alternativa, actan fijando el factor C5 a C3b, que es
escindido por los factores con actividad esterasa (C2a o Bb) en
2 fragmentos, la anafilotoxina C5a, que pasa al medio fluido y
el fragmento C5b de mayor peso molecular que se une no
covalentemente a C3b. La fraccin C5b capta C6 y C7 de la fase
fluida, formando un complejo estable C5b67 con actividad
quimiotxica y capacidad de fijacin a las membranas.
Si al complejo C5b67 se une la fraccin C8, C5b678 es ya
citoltico, pues el factor C8 modifica su configuracin espacial
ofreciendo zonas hidrofbicas que determinan su insercin en
la membrana. Este grupo de molculas, adquiere la capacidad
de interaccionar con molculas de C9 formando el complejo
C5b6789 (Figura 13.9). Las molculas de C9 (en nmero de 1 a
18) sufren cambios en su configuracin, desplegndose y
presentando ms zonas hidrofbicas que potencian y aceleran
la penetracin de este complejo de ataque a la membrana
(MAC, Membrane Attack Complex), dando origen a la
formacin de canales hidroflicos (Figura 13.10), que permiten
el libre intercambio de sodio y agua con el exterior de la clula,
provocando la consiguiente lisis osmtica de la clula atacada.
C9 es estructuralmente homologo a la perforina, protena
liberada por los linfocitos T citotxicos y las clulas NK, y que es
tambin responsable de la formacin de poros en la membrana
de las clulas diana.
CODIFICACIN GENTICAS DE LAS FRACCIONES DEL
COMPLEMENTO.
Las molculas C2, C4 y el factor B (Bf) estn codificadas por
genes ubicados en el cromosoma 6, entre los loci HLA-B y
HLA-DR del Complejo Principal de Histocompatibilidad humano
(MHC, Major Histocom-patibility Complex). El resto de los
componentes del sistema del complemento no estn
vinculados a HLA. Mientras que el factor B y C2 estn
codificados por un solo locus, existen dos loci que codifican C4,
C4a y C4b.
Otros genes que codifican componentes del sistema
complemento tambin se encuentran agrupados. As en el
brazo corto del cromosoma 1 del hombre se localizan los genes
que codifican las cadenas alfa y beta de C8 y las cadenas alfa y
beta de C1q. Los genes C6 y C7, que se han originado por
duplicacin, se detectan en el cromosoma 5.
En el brazo largo del cromosoma 1 se encuentra la regin RCA
(regulators of complement activation) que contiene genes
ligados que codifican distintas protenas reguladoras: CR1, CR2,
DAF, H, C4BP y MCP.
RECEPTORES PARA FACTORES DEL COMPLEMENTO
Muchas de las funciones del complemento se llevan a cabo tras
la unin de fragmentos de algunos factores del complemento a
receptores especficos presentes en la superficie de varios tipos
de clulas (Tabla 13.2). Los mejor conocidos son los que tienen
como ligando a fragmentos de C3.
CR1 (Receptor de complemento tipo 1, CD35).
Sus ligandos son los fragmentos C3beta, iC3beta y C4beta.
Se encuentra sobre todo en las clulas del sistema fagoctico
mononuclear, en los neutrfilos, en los linfocitos T y B y en los
eritrocitos. En las clulas fagocitarias facilita la fagocitosis de
partculas opsonizadas por sus ligandos. En los eritrocitos
facilita su unin a inmunocomplejos opsonizados por C3beta y
C4beta. Estos inmunocomplejos son retirados de la superficie
de los hemates en el hgado y bazo por los fagocitos. De esta
forma los hemates quedan con sus receptores libre para
continuar el aclaramiento de inmunocomplejos de la circulacin
(ver mas adelante).
CR2 (Receptor de complemento tipo 2, CD21).
Sus ligandos son C3b, la forma inactiva de ste, iC3b y sus
fragmentos de degradacin C3delta y C3deltagamma. Este
receptor se encuentra en los linfocitos B, en las clulas
dendrticas foliculares y en algunas clulas epiteliales.
El CR2 se encuentra en las clulas B formando un complejo
trimolecular junto con otras dos protenas, CD19 y CD81. Este
complejo es el llamado correceptor del linfocito B y enva
seales al interior de la clula B que facilitan su respuesta una
vez unida al antgeno por su receptor (inmunoglobulina +
molculas Ig-alfa e Ig-beta).
En las clulas dendrticas foliculares CR2 sirve para atrapar en
los centros germinales complejos Ag-Ac opsonizados por
iC3beta o C3deltagamma.
El CR2 es el receptor usado por el virus de Epstein-Barr para
invadir a las clulas B. Este virus es el causante de la
enfermedad mononucleosis infecciosa y est relacionado con
tumores como el linfoma de Burkitt y el carcinoma
nasofarngeo.
CR3 (Receptor de complemento tipo 3, Mac-1, CD11bCD18).
Se encuentra en fagocitos mononucleares, neutrfilos, clulas
cebadas y NK. La cadena beta de CR3 (CD18) se encuentra en
otras dos molculas (LFA-1 y p150,95). CR3, LFA-1 y p150,95
pertenecen a la familia de las integrinas.
El ligando de CR3 es iC3b por lo que participa en la fagocitosis
de partculas opsonizadas por este factor. Pero en los fagocitos
y neutrfilos se une tambin a ICAM-1. Esta molcula se
encuentra en los endotelios por lo que facilita el anclaje de
fagocitos a las clulas endoteliales para posteriormente
abandonar los vasos por diapdesis.
CR4 (CD11cCD18, p150,95).
Su ligando es tambin iC3b y probablemente la funcin de CR4
es similar a la de CR3. CR4 es abundantemente expresado por
las clulas dendrticas por lo que se usa como marcador para
identificarlas.
FUNCIONES DEL COMPLEMENTO
Las funciones del complemento son muy diversas, de ah la
gran potencialidad defensiva del mismo.
Estas funciones se llevan a cabo por diferentes fracciones del
complemento activas. La tabla 13.2 muestra la accin
fisiolgica de stas. Los factores activos frecuentemente
desarrollan su funcin conectando con distintos receptores de
membrana. La Tabla 13.2 expone los receptores de membrana
para las distintas fracciones del complemento. Comentamos, a
continuacin, las funciones biolgicas fundamentales. Las
acciones anafilotxicas, quimiotxicas y opsonizantes del
complemento lo convierten en un factor fundamental en la
potenciacin de la inflamacin, fenmeno bsico en la defensa
frente a la infeccin
Accin citoltica
Una vez puesta en marcha la cascada del complemento, si se
forma el complejo final C5b67, y sobre l se acopla la fraccin
C8 y molculas de C9, se produce la lisis de las clulas sobre
cuyas membranas se ha adosado dicho complejo. La lisis se
produce por la formacin de mltiples poros formados por el
complejo C5b6789 (Figura 13.10). Como se ha explicado
anteriormente, a este efecto se puede alcanzar por la unin del
Ag-Ac (va clsica) o por la activacin grmenes (va alternativa).
Por uno u otro mecanismo se produce la lisis de gran nmero
de bacterias, tales como bacteridium, salmonella, shigella,
escherichia, vibrio, treponema y otras clulas. Todas estas
acciones se agrupan bajo la denominacin conocida de
citotoxicidad dependiente del complemento.
Accin anafilotxica
Las fracciones C3a y C5a, conectando con receptores de
membrana (C3aR, C5aR, Tabla 13.2), ejercen una accin
anafilotxica, esto es, poseen una potente accin activadora
sobre los mastocitos y basfilos que en consecuencia, liberan
mediadores de la inflamacin. Las sustancias vasoactivas
liberadas incrementan la permeabilidad capilar, lo que facilita la
afluencia de leucocitos y molculas al foco inflamatorio.
Accin quimiotxica
Las fraccin C5a posee una potente actividad quimiotxica, que
determina la atraccin de leucocitos al foco inflamatorio.
Accin facilitadora de la fagocitosis (opsonizacin)
Los macrfagos y polimorfonucleares neutrfilos presentan en
sus membranas receptores (CR1, CR3 y probablemente CR4,
Tabla 13.2) capaces de unir la molcula C3b y sus derivados
resultantes de la activacin del complemento. De esta forma, si
el C3b est fijado sobre la superficie de un germen, los
fagocitos pueden conectar con ste mediante los receptores
para C3b, facilitndose as, el fenmeno de la fagocitosis. Esta
actividad facilitadora de la fagocitosis se denomina
opsonizacin. La fagocitosis de microorganismos dependiente
de C3b e iC3b es probablemente el mayor mecanismo de
defensa frente a las infecciones bacterianas (Figura 13.11).
Otra funcin de especial importancia ligada a la capacidad
inductora de la fagocitosis de cierto factores del complemento
es la de aclaramiento de inmunocomplejos.
Aclaramiento de inmunocomplejos
En condiciones normales, se pueden detectar inmunocomplejos
solubles circulando en sangre. Estos inmunocomplejos son
potencialmente peligrosos, pues de precipitar en algn tejido
activaran el complemento e iniciaran un foco inflamatorio. No
obstante, existe un mecanismo fisiolgico de aclaramiento de
inmunocomplejos. Los eritrocitos, las clulas ms abundantes
de la sangre, presentan CR1 en su membrana y mediante este
receptor captan inmunocomplejos circulantes a travs del
factor C3b. Cuando los hemates atraviesan el hgado o el bazo,
los macrfagos de estos rganos, mediante sus receptores CR1,
CR3 o CR4, unen los inmunocomplejos a travs de C3b (o
mediante receptores para Fc a travs de IgG) y los fagocitan.
Los eritrocitos quedan libres para captar nuevos
inmunocomplejos (Figura 13.12)..
Accin reguladora de la respuesta inmune
El factor C3b tiene importantes funciones reguladoras de la
respuesta inmune. As, el C3b o sus derivados (C3d), unido a
membranas facilita la cooperacin entre las clulas inmunes y
acta en la estimulacin de las clulas T y B probablemente
debido a su capacidad de promover la adhesin clula-clula.
Las clulas presentadoras del antgeno tienen receptores para
el complemento, lo que permite su conexin con el antgeno
para su posterior presentacin.
MECANISMOS DE REGULACION DEL COMPLEMENTO
Dado el potencial lesivo del sistema del complemento, ste se
encuentra estrechamente regulado por diversos mecanismos y
molculas (Tabla 13.3), cuyo objeto es evitar la lisis de las
clulas autlogas. El mecanismo ms simple de regulacin es la
baja concentracin y labilidad de muchos de sus factores. No
obstante los factores que actan en la regulacin del
complemento ejercen su accin en distintos puntos tanto en la
va clsica como en la alternativa o ltica, centrndose
fundamentalmente en la activacin de C3.
Inhibicin de C1
El inhibidor de la C1 esterasa (C1inh) inhibe la formacin de
C3b convertasa de la va clsica por su capacidad de unin a los
fragmentos C1r y C1s. En los casos de deficiencia en C1inh
(edema angioneurtico hereditario), el C1 activado degrada
elevadas cantidades de C2 produciendo un acumulo de C2b.
Este factor es degradado anormalmente por plasmina lo que da
lugar a C2-Kinina que es un potente vasodilatador y aumenta la
permeabilidad vascular produciendo los edemas caractersticos
del cuadro.
Inhibicin de C4
El factor C4BP (C4-binding protein) tiene la capacidad
de captar C4b facilitando su disociacin del complejo
C4b2a e inhibiendo, por tanto, la actividad de
convertasa de C3.
El factor I (FI) es una esterasa de tipo serina que circula
en forma activada. El C4b disociado es susceptible de
ser atacado por el factor I y ser degradado en C4c y
C4d.
Los receptores de membrana DAF (factor acelerador
de la degradacin) y la MPC (cofactor protenico de
membrana) se encuentran ampliamente distribuidos
en clulas inmunes y no inmunes. Tienen la capacidad
de inhibir la unin, facilitar la disociacin de C4b y C2a
(DAF) o favorecer que el factor C4b pueda ser
degradado por el FI (MCP). Estos receptores son de
gran importancia en los mecanismos de prevencin de
lisis de las clulas autlogas.
Inhibicin de C3
La regulacin de C3, al ser ste el factor central en la activacin
del complemento, es probablemente el mecanismo de
regulacin ms importante.
El factor H (FH) es una protena plasmtica homloga a la C4BP
que tiene la capacidad de unir C3b en la fase fluida. El Factor I
ataca entonces C3b liberando una pequea fraccin C3f y
convirtindolo en iC3b. Por otra parte FH tambin promueve la
disociacin del complejo C3bBb. Un defecto en este tipo de
regulacin acontece en un tipo de glomerulonefritis
(membranosa tipo II), en la que aparecen autoanticuerpos
(factores nefrticos) que se une al complejo C3bBb,
estabilizndolo y hacindolo resistente a la accin de FH.
Los receptores de membrana CR1, DAF y MCP actan sobre el
C3b de forma semejante a su actuacin sobre C4b: inhiben la
unin o facilitan la disociacin C3bBb (CR1, DAF) o actan como
cofactores del factor I en la degradacin de C3b unido a la
membrana (CR1, MCP). En este caso C3b tambin se degrada a
iC3b, sobre el que el factor I puede seguir ejerciendo su
actividad cataltica originando las fracciones C3c y C3dg.
Todos estos mecanismos inhiben la capacidad de C3b de formar
convertasa de C5, as como de que C3b medie la adherencia
celular. Sin embargo iC3b s mantiene la capacidad de
adherencia a clulas fagocticas por los receptores de estas
clulas para iC3b (CR1, CR3 y CR4) (Tabla 13.2).
Inhibicin del MAC
La protena S (vitronectina) es una glucoprotena
plasmtica con capacidad para unirse al complejo
C5b67 impidiendo que ste se una a la membrana
celular.
CD59 es una protena ampliamente distribuida en las
membranas celulares que inhibe la insercin de C9 en
el complejo C5b-8.
El factor de restriccin homloga (Homologous
Restriction Factor, HRF) tambin est ampliamente
distribuido en la membrana de las distintas clulas y
presenta una funcin equivalente al CD59.
La capacidad de MAC de lisar las clulas puede ser
modulada tambin por una protena circulante
llamada SP-40,40, esta es un heterodmero que ha sido
aislado de complejos solubles C5-9. Podra ser un
componente normal de MAC cuyo efecto principal
sera controlar la capacidad de MAC de lisar las clulas.
El mecanismo de accin de SP-40,40 es desconocido.
Proteccin de lo propio, lisis de lo extrao
De los factores reguladores estudiados DAF, HRF y CD59, se
piensa que actan exclusivamente en la inhibicin de la lisis de
las clulas del propio organismo donde asienta. Estas protenas
de membrana se detectan fundamentalmente en eritrocitos y
clulas endoteliales que son las clulas que se encuentran en
mayor peligro de autolisis por el complemento.
En la enfermedad hemoglobinuria paroxistica nocturna hay un
defecto congnito de DAF, HRF y CD59 producindose una
anemia debido a la lisis de los hemates, lo cual ocurre
frecuentemente durante la noche.
Lgicamente los grmenes no presentan en sus membranas
molculas reguladoras de la autolisis por lo que no pueden
protegerse de los efectos lticos del complemento. Esto
determina, por tanto, un mecanismo rudimentario de
discriminacin entre lo propio y lo no propio.
No obstante, algunos grmenes han desarrollado mecanismos
que le permiten evadirse de la actuacin del complemento. En
algunos grmenes la simple presencia de una cpsula puede ser
un mecanismo de resistencia. Otros grmenes presentan
protenas de membrana que impiden el desarrollo del MAC o
enzimas que degradan los factores del complemento o liberan
factores proteicos que inactivan las convertasas de C3, etc.
LABORATORIO EN EL ESTUDIO HEMATOLOGICO. Anemias.
En la actualidad, para el diagnstico y evaluacin de los
trastornos hematolgicos que afectan a las series blanca, roja y
megacarioctica juegan un rol muy importante los contadores
hematolgicos de ltima generacin.
Los mtodos de recuento electrnico se basan en la medicin
de distintas propiedades:
impedancia elctrica: las clulas que atraviesan una
abertura por la cual est pasando una corriente
provocan cambios en la resistencia elctrica que se
registran como impulsos elctricos.
dispersin luminosa: aqu se detecta la luz dispersa,
por reflexin externa de las superficies celulares o por
transmisin y refraccin a travs de las clulas.
Estos instrumentos, que son muy estables y generalmente no
requieren calibracin interna, se basan en la determinacin de
partculas por su tamao, brindando una medida ms exacta
del nmero de clulas y una valoracin ms precisa de los
ndices hematimtricos.
Adems permiten conocer el ndice RDW (Amplitud de
Distribucin de hemates), que es una medida del grado de
anisocitosis de las clulas rojas. Este ndice (junto con VCM)
permite diferenciar entre distintos estados anmicos por
ejemplo, pacientes ferropnicos y pacientes con rasgo
talasmico.
El recuento leucocitario diferencial automatizado se basa
principalmente en un sistema de flujo continuo que permite
analizar rpidamente miles de clulas y reducir
significativamente el error estadstico del recuento. Los
resultados de las cinco poblaciones leucocitarias se expresan en
porcentaje y en concentraciones absolutas: neutrfilos,
eosinfilos, basfilos, linfocitos y monocitos.
Los contadores hematolgicos de nueva generacin se basan
en la combinacin de varias tecnologas:
Citoqumica, conductividad y medida de la densidad
ptica: en estos instrumentos se somete cada clula a
dos medidas consecutivas de impedancia y de
absorcin ptica que permiten las separaciones en
siete poblaciones leucocitarias: neutrfilos,
eosinfilos, basfilos, linfocitos, monocitos, linfocitos
atpicos y clulas grandes inmaduras.
Citoqumica, citometra de flujo y densidad ptica:
aqu el anlisis se realiza con tres sistemas analticos:
el contador hematolgico ADVIA 120 consta de dos
citmetros de flujo y un colormetro.
Para el anlisis de glbulos blancos y el recuento diferencial
leucocitario la muestra se colorea con la tincin de peroxidasa y
luego se analiza con el citmetro de flujo. El instrumento mide
el tamao de las clulas utilizando la dispersin de la luz de una
lmpara de tungsteno y la intensidad de la coloracin de
acuerdo a la absorbancia. El resultado se expresa en un
citograma en el cual las clulas se separan en funcin del
tamao y la intensidad de la tincin de peroxidasa-absorbancia:
neutrfilos, eosinfilos, basfilos, linfocitos, monocitos, clulas
grandes indiferenciadas (blastos), hemates nucleados y
acmulos de plaquetas.
El anlisis diferencial de leucocitos es una herramienta de
diagnstico clnico importante para la identificacin de
anormalidades morfolgicas. Para identificar subpoblaciones
leucocitarias se usan reactivos monoclonales marcados con
fluorescena clula-especficos, confirmando la presencia de
clulas inmaduras y atpicas en leucemias. En el ADVIA 120 se
pueden diferenciar blastos y clulas atpicas (CD 34+) y
granulocitos inmaduros (CD 13+ 16+).
En cuanto a la serie roja se basa en el mismo principio, pero
aqu se utiliza una fuente de luz lser. Los hemates (RBC) se
presentan en un diagrama bidimensional (citograma) en
funcin del VCM y de la CHCM. Tambin se obtienen tres
histogramas para los ndices hematimtricos: VCM, HCM y
CHCM.
El recuento de reticulocitos se realiza simultneamente con el
recuento de RBC (recuento de hemates) expresndose el
resultado en porcentaje y valor absoluto, como as tambin un
conjunto de parmetros relacionados con ellos, a saber:
Medicin del contenido de Hb de los reticulocitos
(CHr) en forma independiente de la medida de
hemoglobina en los hemates.
Grado de absorbancia de los reticulocitos, lo cual
permite diferenciar la subpoblaciones ms inmaduras
de los reticulocitos y su transformacin en glbulos
rojos maduros.
El volumen corpuscular medio de los reticulocitos
(MCVr)
El recuento de plaquetas se realiza mediante un anlisis
bidimensional midiendo el volumen y la densidad de cada
clula (de esta manera se eliminan las interferencias que
pueden provocar algunos elementos, tales como fragmentos
celulares y microcitos). La mayor exactitud en el recuento de
plaquetas por el mtodo bidimensional se debe a la mejor
discriminacin entre plaquetas y otras partculas, lo cual
permite adems el recuento de plaquetas cuyo volumen se
encuentre en el rango de 1 a 60 fl. Esto tiene importancia, por
ejemplo en un sndrome de Bernard-Soulier, un trastorno
hemorrgico con tiempo de sangra prolongado,
trombocitopenia y plaquetas muy grandes, que en otro mtodo
no permitira el reconocimiento de las plaquetas gigantes.
Los elementos bsicos para clasificar anemias.
Los parmetros obtenidos en el contador hematolgico
permiten una orientacin inicial con respecto a varias
patologas hematolgicas, conjuntamente con estas
determinaciones como transferrina, saturacin de transferrina,
ferritina, reticulocitos, electroforesis de hemoglobina.
1) Indices hematimtricos
MCV (Volumen Corpuscular Medio). Es una expresin,
en trminos absolutos, del volumen promedio de los
eritrocitos. Los valores de referencia son 82 95 fl. Es
una determinacin muy til en la diferen-ciacin de las
anemias microcticas, macrocticas y nomocticas.
MHC (Hemoglobina Corpuscular Media). Es el valor
promedio de la hemoglobina contenida en cada
eritrocito. Su valor de referencia es de 28 a 32
picogramos. Valores menores a 27 pg se observan en
anemias microcticas, mientras que valores mayores a
35 pg son tpicos de anemias macrocticas.
MCHC (Concentracin de Hemoglobina Corpuscular
Media). Define la concentracin de hemoglobina
promedio por ml de eritrocitos. En adultos, los valores
de referencia son 32 36 %. Sobre la base de valores
de MCHC, la sangre puede ser definida como
nomocrmica, hipocrmica o hipercrmica.
2) Morfologa de hemates.
RDW (Amplitud de distribucin de glbulos rojos): es una
medida de la anisocitosis, indicando si la sangre analizada es
homognea o heterognea. Representa el coeficiente de
variacin de la distribucin volumtrica eritrocitaria. Los valores
de referencia son 11,5 15,0 %.
3) Recuento de glbulos rojos (RBC).
Valores de referencia:
recin nacido: 4,0 - 6,0 10
6
/ l
3 meses 3,2 - 4,8 10
6
/ l
1 ao 3,6 5,2 10
6
/ l
3 6 aos 4,1 5,5 10
6
/ l
10 12 aos 4,0 5,4 10
6
/ l
adultos : hombres: 4,5 6,5 10
6
/ l
mujeres: 3,8 5,8 10
6
/ l
4) Hemoglobina.
Valores de referencia:
recin nacido: 13,5 19,5 g/dl
3 meses 9,0 13,0 g/dl
1 ao 10,5 13,5 g/dl
3 6 aos 12.0 14.0 g/dl
10 12 aos 11,5 14,5 g/dl
adultos: hombres 13,0 17,0 g/dl
adultos: mujeres 11,5 16,0 g/dl
5) Hematocrito.
Valores de referencia:
recin nacido: 0,44 0,64 l/l
3 meses 0,32 0,44 l/l
1 ao 0,36 0,44 l/l
3 6 aos 0,36 0,44 l/ll
10 12 aos 0,37 0,45 l/l
adultos: hombres 0,40 0,54 l/l
adultos: mujeres 0,37 0,47 l/l
6) Leucocitos WBC.
Valores de referencia:
recin nacido: 10.000 6.000 /l
3 meses 18.000 6.000 /l
1 ao 6.000 - 15.000 /l
3 6 aos 5.000 15.000 /l
10 12 aos 4.500 13.500 /l
adultos 4.000 10.000 /l
7) Reticulocitos:
Valores de referencia:
recin nacido: 20.000 - 150.000 /l
3 meses a 12 aos 10.000 - 100.000 /l
adultos 20.000 - 80.000 /l
Los valores porcentuales son : en nios : 0,5 2,5 % - adultos :
0,5 1,5 %
8) Indices plaquetarios:
1 - MPV (Volumen plaquetario medio): este ndice tiene una
relacin inversamente proporcional no lineal con el nmero de
plaquetas. Sus valores de referencia son: 7,5 20,0 fl. El MPV
est aumentando en enfermedades mieloproliferativas,
talasemias heterocigotas alfa y beta, coagulacin intravascular
diseminada, procesos microangiopticos, trombocitopenia por
destruccin perifrica.
Disminuye en pacientes con anemia aplsica, anemia
megaloblstica, quimioterapia antitumoral, trombocitopenia
por hipoplasia medular.
El MPV es normal en pacientes ferropnicos, por ello junto con
el RDW y el MCV se utiliza para diferenciar sideropenia de
talasemia heterocigota.
2 MPC (Densidad de plaquetas o concentracin media de
plaquetas): es un indicador del estado de activacin plaquetaria
y sera as un indicador clnico til en pacientes con riesgo de
trombosis (dializados, diabticos, fumadores, angina inestable,
mujeres embarazadas). Las plaquetas son fundamentales en el
proceso de coagulacin que se inicia con el dao vascular o,
incluso, por arterosclerosis de los vasos sanguneos
Nuevos parmetros para el estudio de anemias
1) CHr (Contenido de hemoglobina de los reticulocitos): los
reticulocitos son glbulos rojos inmaduros que estn presentes
en sangre perifrica por alrededor de un da en personas
normales. El CHr es una medida directa de la Hb presente en los
reticulocitos nuevos y en un indicador precoz de eritropoyesis
deficiente en hierro.
El recuento y anlisis de reticulocitos se utiliza en diversas
situaciones clnicas:
Identificacin de deficiencia funcional del hierro:
cuando los valores medios de las concentraciones de
Hb de las RBC y de los reticulocitos difieren
significativamente.
Monitoreo del tratamiento con hierro: el parmetro
CHr es mucho ms sensible a la respuesta del
suplemento de hierro que otros parmetros, tales
como hematocrito, hemoglobina, MCV, RDW, MCH,
Ferritina (esta ltima puede presentar variaciones en
un proceso inflamatorio).
Monitoreo de los efectos de la administracin de
eritropoyetina recombinante humana rHu EPO en
pacientes dializados tratados con hierro y
eritropoyetina. (ver Reticulocitos)
2) Porcentajes de clulas Hipocrmicas (%H) y de clulas
Microcticas (%M). Cociente M/H.
El %H indica la cantidad de los glbulos rojos hipocrmicos; el
incremento de hipocroma es indicativo de eritropoyesis
deficiente en hierro.
En la deficiencia de Fe como en las talasemias a y b, hay
microcitosis e hipocroma tanto en los eritrocitos como en los
reticulocitos. La relacin M/H constituye un parmetro
importante para la diferenciacin entre rasgo talasmico y
anemia por deficiencia de hierro:
M/H menor que 0,9 : se trata de una anemia ferropnica.
M/H mayor que 0,9 : se trata de una talasemia.
Clasificacin de anemias:
Las anemias se pueden clasificar de acuerdo a distintos
criterios. Los dos ms importantes (segn las ltimas
publicaciones) son:
1) Por su etiopatogenia :
A) Produccin disminuida de eritrocitos: anemias
arregenerativas o centrales;
a) Trastornos de la maduracin eritroblstica
-Alteraciones de la hemoglobinognesis.
-Anemia por carencia de hierro.
-Alteraciones en la utilizacin del hierro.
-Alteraciones en la sntesis del ADN.
-Dficit de Vitamina B12.
-Dficit del Acido flico.
b) Insuficiente produccin de eritropoyetina.
-Nefropata crnica.
-Hipotiroidismo.
c) Lesin de la clula madre pluripotente.(CFU-s)
-Aplasia medular.
-Anemias reflactarias
-Infiltracin neoplsica o leucmica de la mdula sea.
-Mielofibrosis.
d) Lesin de los precursores eritroblsticos (BFU-E y CFU-E).
-Eritroblastopenia congnita (Blackfan Diamond)
-Eritroblastopenia adquirida.
-Autoanticuerpos contra eritroblastos o sus precursores.
e) Diseritropoyesis congnita.
B) Aumento en la prdida de eritrocitos: anemias regenerativas
perifricas.
a) Hemorragias.
-Agudas.
-Crnicas.
b) Hemlisis.
Mecanismo congnito:
-Alteraciones de membrana: Esferocitosis hereditaria.
Estomatocitosis.
Eliptocitosis.
Hemoglobinuria paroxstica nocturna.
Piropoiquilocitosis hereditaria.
- Alteraciones de hemoglobina:
Hemoglobinopatias (S,C,D,E)
Talasemias.
-Alteraciones metablicas: Dficit de glucosa6
fosfatodehidrogenasa.
Mecanismo adquirido:
-Mecanismo inmune (Enfermedad Hemoltica del recin nacido)
-Efecto mecnico (valvulopata, microangiopata)
-Agentes infecciosos.
-Trastornos metablicos del organismo (sndrome de Zieve)
-Anemias hemolticas inmunes:
Anemia hemoltica autoinmune.
Anemia hemoltica isoinmune.
Anemia inducida por frmacos.
2) Clasificacin morfolgica: basada en el estudio de los ndices
hematimtricos de los autoanalizadores hematolgicos, lo cual
permite una orientacin importante en las patologas
hematolgicas.
N = RDW Normal
D = RDW aumentado
( ) = RDW disminuido
La clasificacin morfolgica propuesta por Bessman en 1986
se puede resumir en la siguiente tabla:
MCV bajo MCV normal MCV alto
RDW
Norma
l
RDW Alto RDW
Normal
RDW Alto RD
W
Nor
mal
RDW
Alto
Enfer
medad
crnic
a.
Dficit de
Fe
Normal Dficit
nutriciona
l
Ane
mias
apl
sica
Dficit de
folato y
vitamina
B12
Talase
mias
hetero
cigotas
Talasemia
s S/beta
Hemoglo
binopatia
s
Enfermed
ad crnica
Hemoglob
inopatas.
Anomalas
Enzimtic
as.
Esplenect
oma. LLC.
Anemia
post
Hemorrgi
ca.
Quimioter
apia.
Esferocito
sis
hereditari
a.
Hemoglo
binopata
s
Mielofibr
osis.
Mielodisp
lasia
Ane
mia
neo
nata
l
Anemia
falcifor-
me
Anemia
inmunoh
emoltica
Preleuce
mia
Otros parmetros de laboratorio:
Anemia por carencia de Fe;
- Transferrina
- Capacidad total de fijacin de hierro. (CTFH)
- Porcentaje de saturacin de transferrina.
- Ferritina.
Anemias hemolticas:
- Haptoglobina: es una alfa 2-glucoprotena plasmtica. La
destruccin intravascular del eritrocito conduce a la liberacin
de hemoglobina (Hb) en la corriente sangunea, fijndose esta
ltima a la Haptoglogina (Hp). La formacin del complejo Hb-Hp
impide la excrecin renal de la Hb plasmtica, se metaboliza en
el hgado y por lo tanto, los niveles plasmticos de Hp
disminuyen en los procesos de hemlisis.
- Hemosiderina en orina: en los procesos hemolticos el plasma
queda libre de Hp y los dmeros a-b de la Hb son filtrados por
los glomrulos renales siendo reabsorbidos en las clulas
tubulares renales y convertidos en hemosiderina.
- Hemopexina: los dmeros a-b que no se fijan a la Hp ni
tampoco son procesados por filtracin glomerular se oxidan a
methemalbmina, los grupos hemos se liberan y son fijados a
una b-globulina: la hemopexina. El complejo hemo-hemopexina
se cataboliza en hgado
Você também pode gostar
- Tiposdecontraccinmuscular Phpapp02Documento9 páginasTiposdecontraccinmuscular Phpapp02KarlaItzelDomAinda não há avaliações
- Silla TurcaDocumento9 páginasSilla TurcaKarlaItzelDomAinda não há avaliações
- Fisiopatología de ObesidadDocumento25 páginasFisiopatología de ObesidadKarlaItzelDomAinda não há avaliações
- Exploracion FuncionalDocumento6 páginasExploracion FuncionalKarlaItzelDomAinda não há avaliações
- Periodo SomiticoDocumento7 páginasPeriodo SomiticoPatricia Fuenmayor WinterdaalAinda não há avaliações
- Periodo SomiticoDocumento7 páginasPeriodo SomiticoPatricia Fuenmayor WinterdaalAinda não há avaliações
- PenicilinasDocumento13 páginasPenicilinasKarlaItzelDomAinda não há avaliações
- ElectrocardiogramaDocumento4 páginasElectrocardiogramaKarlaItzelDomAinda não há avaliações
- Presentacion ArritmiasDocumento38 páginasPresentacion ArritmiasKarlaItzelDomAinda não há avaliações
- Adios A Las VegasDocumento2 páginasAdios A Las VegasKarlaItzelDomAinda não há avaliações
- YLa Ley de FrankDocumento7 páginasYLa Ley de FrankKarlaItzelDomAinda não há avaliações
- Mecánica VentilatoriaDocumento14 páginasMecánica VentilatoriaKarlaItzelDomAinda não há avaliações
- SX DiarreicoDocumento28 páginasSX DiarreicoKarlaItzelDomAinda não há avaliações
- ElectrocardiogramaDocumento4 páginasElectrocardiogramaKarlaItzelDomAinda não há avaliações
- Resumen CardioDocumento11 páginasResumen CardioKarlaItzelDomAinda não há avaliações
- Cavidad ToráCica FannieDocumento32 páginasCavidad ToráCica FannieKarlaItzelDomAinda não há avaliações
- Linfo Grupos SanguineosDocumento4 páginasLinfo Grupos SanguineosKarlaItzelDomAinda não há avaliações
- Biometria Hematica-PC-linfo (1) BuenoDocumento2 páginasBiometria Hematica-PC-linfo (1) BuenoKarlaItzelDomAinda não há avaliações
- Nariz Fanny RespiDocumento25 páginasNariz Fanny RespiKarlaItzelDomAinda não há avaliações
- Factores de Virulencia Bacterianos y PatogenicidadDocumento42 páginasFactores de Virulencia Bacterianos y PatogenicidadAlfredo Capo PfmAinda não há avaliações
- Gartner, Leslie P. - Texto Atlas de Histologia, 2da Edición (12 Sistema Linfoide (Inmunitario) )Documento25 páginasGartner, Leslie P. - Texto Atlas de Histologia, 2da Edición (12 Sistema Linfoide (Inmunitario) )William Salgado0% (2)
- Trabajo Inflamacion y FagocitosisDocumento30 páginasTrabajo Inflamacion y FagocitosisAlexka Silva CamachoAinda não há avaliações
- Foro Preguntas Inmunología: 1-: Doc. Juan BurdissoDocumento16 páginasForo Preguntas Inmunología: 1-: Doc. Juan BurdissoLuciano David PelliAinda não há avaliações
- Microb Solemne 2Documento26 páginasMicrob Solemne 2Allison Sanhueza RiffoAinda não há avaliações
- Fisio Sangre Rincon Del Vago 1Documento15 páginasFisio Sangre Rincon Del Vago 1erickmattosAinda não há avaliações
- Adherencia y QuimiotaxisDocumento2 páginasAdherencia y QuimiotaxisCatty Regalado RosasAinda não há avaliações
- Microbiología e InmunologíaDocumento30 páginasMicrobiología e InmunologíaAlma ChableAinda não há avaliações
- Inmunología GuiaDocumento10 páginasInmunología GuiaLinda MagdalenoAinda não há avaliações
- El Diagnostico PDFDocumento16 páginasEl Diagnostico PDFG̶d̶n̶ ̶f̶l̶Ainda não há avaliações
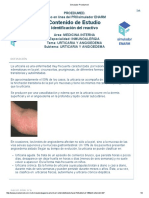
- Urticaria AngioedemaDocumento9 páginasUrticaria AngioedemaValeria Emili FajardoAinda não há avaliações
- Guia Sistema InmunologicoDocumento3 páginasGuia Sistema InmunologicoInes CantilloAinda não há avaliações
- Actualización en Alergia Ocular - Tomo I, II & IIIDocumento307 páginasActualización en Alergia Ocular - Tomo I, II & IIIDavid Molina100% (3)
- Semana 10Documento45 páginasSemana 10Kaylee Lopez LinguinniAinda não há avaliações
- Conversion ResultDocumento72 páginasConversion ResultMarielytha ArpAinda não há avaliações
- Inmunoglobulina GDocumento2 páginasInmunoglobulina GFacundo Horacio Xeling SanchezAinda não há avaliações
- Examen Final 2020Documento14 páginasExamen Final 2020Tito LivioAinda não há avaliações
- Cuestionario InmunologiìaDocumento5 páginasCuestionario Inmunologiìaanon_686516841Ainda não há avaliações
- Resolucion 5171 de 2017 - CUPS 2018Documento415 páginasResolucion 5171 de 2017 - CUPS 2018juanferAinda não há avaliações
- Inmunología ActualizadoDocumento124 páginasInmunología ActualizadoCesar IgnacioAinda não há avaliações
- Guia Inmuno 2do Parcial 1 1Documento25 páginasGuia Inmuno 2do Parcial 1 1Damaris Pérez CastañedaAinda não há avaliações
- Prueba de Autoanticuerpos Formalmente Conocido ComoDocumento2 páginasPrueba de Autoanticuerpos Formalmente Conocido ComoAydee Milenca MacAinda não há avaliações
- Inmunidad Frente A BacteriasDocumento55 páginasInmunidad Frente A BacteriasKarely IreneAinda não há avaliações
- Urticaria VasculíticaDocumento2 páginasUrticaria VasculíticaKaren Rivera AlvaradoAinda não há avaliações
- Anticuerpos. Inmunologia.Documento6 páginasAnticuerpos. Inmunologia.adalbertopAinda não há avaliações
- Hemoglobinuria Paroxistica NocturnaDocumento4 páginasHemoglobinuria Paroxistica NocturnaAndres Agustin AnselmoAinda não há avaliações
- Cambio de Clase de InmunoglobulinaDocumento8 páginasCambio de Clase de InmunoglobulinaJORGE ISAAC ZAMBRANO CEDEÑOAinda não há avaliações
- Capitulo 19 INMUNOLOGÍADocumento3 páginasCapitulo 19 INMUNOLOGÍADavidArChambaAinda não há avaliações
- Guia SERV 01 SegundaRevisionDocumento66 páginasGuia SERV 01 SegundaRevisionLara3456Ainda não há avaliações
- TrabajoDocumento79 páginasTrabajoJoao SantibáñezAinda não há avaliações