Escolar Documentos
Profissional Documentos
Cultura Documentos
Estados de Agregacion de La Materia PDF
Enviado por
Ale ChiapperoDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estados de Agregacion de La Materia PDF
Enviado por
Ale ChiapperoDireitos autorais:
Formatos disponíveis
Cap
Cap
tulo 9.
tulo 9. Estados de agregacin de la materia
Objetivos:
Establecer las caractersticas qumico-fsicas de gases, lquidos y slidos.
Establecer la ecuacin de estado de los gases ideales y describir las
desviaciones del comportamiento real de los gases reales
Presentar algunas propiedades qumico-fsicas (presin de vapor, punto de
fusin, punto de ebullicin, como medida de las interacciones entre las
molculas)
Hacer una breve revisin de los distintos tipos de fuerzas intermoleculares
que justifican las propiedades qumico-fsicas de gases lquidos y slidos:
interacciones electrostticas, de Van der Waals
y enlaces de hidrgeno.
Describir las caractersticas estructurales de los diferentes tipos de slidos
que se presentan en la naturaleza: metales, slidos inicos, covalentes,
moleculares, slidos amorfos
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Estados de agregaci
Estados de agregaci
n de materia
n de materia
Estado gaseoso
Tienen densidades bajas
Son muy compresibles
Se expanden hasta ocupar
todo el volumen del recipiente
Estado lquido
Tienen densidades mayores
que los gases
Son poco compresibles
Fluyen y cubren el fondo del
recipiente que los contiene
Estado slido
Tienen altas densidades
Son muy poco compresibles
No son fluidos
Las molculas estn muy
prximas
entre si y con muy
poca energa cintica
Las molculas estn ms
cercanas que en el estado
gaseoso y con menor energa
cintica
Las molculas estn muy
separadas entre s
y con una
energa cintica grande
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Cul es la causa de que a una P y T dadas, la materia sea slida,
lquida o gas?
Dependiendo de la presin y la
temperatura, la materia puede
presentarse en los tres estados:
slido, lquido o gas
La magnitud de las fuerzas entre las molculas
-
Las Fuerzas Intermoleculares
Las Fuerzas Intermoleculares
-
-
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Ecuacin de Estado de los gases perfectos o gases ideales.
(Teora Cintico-Molecular de los gases)
PV = nRT
P = presin; V= volumen; n= nmero de moles; T = temperatura (K)
R= constante de los gases = 8,3145 J mol
-1
K
-1
= 0,082 at.l
mol
-1
K
-1
Un gas est
formado por un nmero muy grande de partculas muy pequeas
(molculas o tomos) en movimiento constante, lineal y al azar
Las Molculas de los gases distan mucho unas de las otras. La mayor parte del
espacio ocupado por el gas est
vaco (Las molculas son masas puntuales, es
decir una masa que no ocupa volumen)
Las molculas chocan unas con otras y con las paredes del recipiente en que
se aloja el gas. Estas colisiones tienen lugar rpidamente, de modo que la
mayor parte del tiempo las molculas no estn chocando
Entre las molculas no se ejercen fuerzas, excepto en el pequeo instante de
la colisin. Es decir, una molcula dada acta independientemente de las
otras, sin que su presencia le afecte.
Las molculas individuales pueden ganar o perder energa por efecto de las
colisiones. Sin embargo, para el conjunto de las molculas que estn a
temperatura constante la energa total permanece constante.
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Isotermas de gases ideales y reales
Isoterma de un gas ideal: PV=constante
(Ley de Boyle)
Isoterma de un gas real: agua
Ecuacin de estado de un gas real:
Ecuacin de Van der Waals
( ) nRT nb V
V
a n
P =
+
2
2
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Fen
Fen
menos de cambios de fase
menos de cambios de fase
A T constante la presin de las molculas de gas sobre las paredes del recipiente
en el equilibrio es la
presin de vapor P
v
lquido gas
Algunas molculas con suficiente energa cintica
pueden romper las atracciones
intermoleculares del lquido y pasar al estado gas
El valor de la P
v
de un lquido es un ndice de la magnitud de las fuerzas
intermoleculares
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Diagramas P,T
de transiciones de fase
Gas
Lquido
H
vap
>0
H
con
<0
El valor del Punto de ebullicin de un lquido y de fusin
de un slido son un ndice de
la magnitud de las fuerzas intermoleculares
Punto de ebullicin a P atmosfrica
Punto de fusin a P atmosfrica
Regla de las fases: F+ L = C+2
Gas Lquido
Lquido Slido
Gas Slido
vaporizacin
condensacin
sublimacin
fusin
congelacin
deposicin
H
sub
= H
fus
+ H
vap
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Punto Triple
Punto Crtico
Fuerzas intermoleculares
Fuerzas intermoleculares
Ion
ion
r
q
1
q
2
Interacciones muy fuertes
y de
largo alcance. Responsables del
enlace inico (energa de red)
1
,
interacciones inicas en
disolucin
1 Enlace inico
Cap-6
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Ion
dipolo permanente
Interacciones muy fuertes
y de largo alcance. Responsables de los procesos
de disolucin de compuestos inicos (solvatacin
de iones)
-
+
-
-
+
+
-
+
+
Energa de interaccin entre 1 molcula de agua (0,14nm) y un in sodio
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
ind
=l.e
=
0
E
Ion
dipolo inducido
0
es la Polarizabilidad
Creacin de un dipolo inducido en un tomo
de H por un campo elctrico externo E
La Energa de interaccin es la mitad
de lo que sera si el dipolo fuera
permanente. Interacciones fuertes
Polarizacin de una molcula
homonuclear
apolar
por un anin
La polarizabilidad
aumenta
con el nmero de
electrones, es decir con la masa molecular
y
depende de la forma de la molcula. Es un
tensor, es decir
x
Neopentano
Pentano
(CH
3
)
4
C CH
3
-(CH
2
)
3
-CH
3
T
b
=9,5
C T
b
=36,1
C
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Interaccin atractiva mxima
Interaccin atractiva (1/2)mxima
Si los dipolos moleculares no son muy fuertes la
energa trmica kT
provoca que la orientacin de los
dipolos oscile sobre la orientacin de mxima
interaccin. La energa de interaccin promediada en
la orientacin depende de 1/r
6
Fuerzas de Van der Fuerzas de Van der Waals Waals
Orientacin de dipolos moleculares en
slidos y lquidos
Interacciones dipolo-dipolo
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Interacciones dipolo-dipolo
inducido
La
energa de interaccin dipolo-dipolo
inducido (Interaccin de Debye)
depende de la polarizabilidad
molecular,
y de 1/r
6
La interaccin es suficientemente importante para favorecer una pequea solubilidad del O
2
en agua
Interacciones dipolo inducido-dipolo inducido
Fuerzas de dispersin de London
Distribucin promedio en el tiempo de
carga electrnica rodeando al ncleo
en un tomo de hidrgeno
Situacin del protn y el electrn del tomo de H en
un momento particular
Dipolo Instantneo
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Distribucin electrnica en
molculas apolares
Generacin de un dipolo
instantneo
Interaccin dipolo-dipolo
+ -
+
+
-
-
Las interacciones de London
dependen de las polarizabilidades
moleculares
y de los
potenciales de ionizacin moleculares
Importancia relativa de las contribuciones VdW
N
2
NO O
2
=0
M=28 g/mol
T
b
=77,34 K
=0,153 D
M=30 g/mol
T
b
=121,39 K
=0;
M=32g/mol
T
b
=90,19 K
Fuerzas de Van der Waals
M(g/mol) (D)
% dispersion
% dipolo T
b
(K)
F
2
38,0 0 100 0 85,01
HCl 36,46 1,08 81,4 18,6 188,11
FBr 80,92 0,82 94,5 5,5 206,43
HI 127,91 0,44 99,5 0,5 237,80
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
U(r)= A/r
12
- B/r
6
= 4
[(/r)
12
- (/r)
6
] Funcin de potencial Lennard-Jones:
Funciones de estado entre tomos de
H. Cuando forman molcula (izquierda)
y cuando no la forman (derecha y
abajo)
H
2
molecular
H
atmico
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Enlaces de hidr Enlaces de hidr geno geno
Comparacin de los puntos de ebullicin de algunos hidruros de no metales
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Distancias entre los tomos en los enlaces
de hidrgeno
Qu
es un enlace de hidrgeno?
Interaccin atractiva entre dos
especies que proviene de una unin
de tipo A-H...B
donde A y B son
elementos muy electronegativos y B
tiene un orbital de par solitario.
El enlace de hidrgeno es de naturaleza
fundamentalmente electrosttica;
interacciones dipolo-dipolo
([O
-_
H
+
(1'51 D), N
-
_
H
+
(1'31 D), F
-_
H
+
(1'94 D)])
aunque se estima
que tiene un 10% de naturaleza cuntica
(enlace sigma)
Los enlaces de hidrgeno son fuertemente direccionales: A-HB180
Tienen altas
energas de enlace
que oscilan entre los 12 y 37 kJ/mol
(20 kJ/mol)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Enlaces intermoleculares: lquidos asociados
Asociacin de alcoholes
Asociacin del cido fluorhdrico
Asociacin de amidas
Dimerizacin
de cidos carboxlicos
Enlaces de hidrgeno intermoleculares
C
N H
H
O
R
H N
H
C
O
R
C
O H
O
R
H O
C
O
R
O
H
R
O
R
H
F
H
F
H
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Enlaces de hidrgeno
intramoleculares
C
O HO
O
H
cido o-hidroxibenzoico
cido saliclico
C C
C C
H H
O
O
O O H
-
cido 2-Propendioico
Enlaces de hidrgeno de una molcula de H
2
0
Estructura tridimensional del hielo
H
fus
=6,01kJ/mol
hielo
<
ag.liq.
T<4
C
(origen de interacciones hidrfobas)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
La estructura
secundaria
de
las protenas
y
los cidos
nucleicos
est
totalmente
condicionada
por
la formacin de
enlaces de
hidrgeno
Apareamiento de bases en el ADN
Formacin de hlices en las protenas
Enlaces de hidrgeno en compuestos biolgicos
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
interacciones hidrfobas
Micela
de un surfactante
Bicapa
lipdica
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
El estado s
El estado s
lido
lido
Redes cristalinas
Las estructuras tridimensionales de los slidos puede describirse como redes
cristalinas
de tomos, iones o molculas.
La celda unitaria
es la unidad repetitiva ms pequea
que posee toda la
simetra caracterstica de la agrupacin atmica, inica o molecular
Construccin de la red tridimensional
con la celda unitaria cbica
a
b
c
Celda unitaria de una red critalina
cbica.
a = b = c; = = = 90
Es convencional elegir como celda unitaria
aquella que tiene los tomos,
iones o molculas en los puntos de la red cristalina
(vrtices, centro de las
caras, etc.)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Simetria
cbica simple
Simetria
cbica centrada
en el cuerpo
Simetria
cbica centrada
en las caras
1 tomo por ceda
unitaria
2 tomos por ceda
unitaria
4 tomos por ceda
unitaria
Diversas formas de empaquetamiento molecular en una celda cbica
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
El enlace qumico III
Enlace Qumico y Estructura de la Materia J. Donoso. Curso 07-08
Ejemplo de empaquetamiento
hexagonal compacto.
La celda unidad es un paraleleppedo
Cul es la propiedad caracterstica que
determina la clasificacin de los slidos
cristalinos?
Las fuerzas de atracci
Las fuerzas de atracci
n entre
n entre
los
los
tomos, iones y mol
tomos, iones y mol
culas
culas
que forman la red
que forman la red
Slidos Covalentes
La unin entre unos tomos y otros en la red es mediante enlaces covalentes
Cristal de grafito, con enlaces entre los tomos de
C con hibridacin sp
2
Cristal de diamante, con enlaces entre los tomos de C
con hibridacin sp
3
. Ordenacin hexagonal, no plana
(ciclohexano)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Slidos Inicos
La unin entre los iones en la red es mediante fuertes interacciones
electrostticas in-in
Cristal de Cloruro Sdico, con enlaces
inicos entre sus iones. ENERGA DE RED
(Captulo 6. Enlace inico. Ciclo de Born)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Slidos Moleculares
La unin entre los tomos o molculas en la red es mediante fuerzas de
dispersin, electrostticas dipolo-dipolo
o enlace de hidrgeno.
Estructura en la red de metano slido.
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Slidos Metlicos
Estructura electrnica en molculas. Teora de Orbitales Moleculares (OM)
(revisin)
Los OM se forman por combinacin lineal de los OA de igual simetra de los tomos que forma la molcula
g
1s
u
1s
E
+
E
-
(a)
(b)
Diagrama de OM en molculas diatmicas
homonucleares
(a) del primer periodo, H
2
, y (b) del
segundo periodo
La combinacin lineal de 2 OA da lugar a 2 OM (enlazante
y antienlazante, *)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Estructura electrnica en molculas. Teora de Orbitales Moleculares (OM)
(revisin)
Los OM se forman por combinacin lineal de los OA de igual simetra de los tomos que forma la molcula
La combinacin lineal de 6 OA da lugar a 6 OM (enlazante
y antienlazante, *)
(a) OA de simetra p, perperdiculares
al plano molecular (b) Diagrama de energa de
los OM de tipo
del benceno. Los 6 electrones de los OA 2p
y
, de los 6 tomos de
C que forman la molcula estn en los OM enlazantes
1
,
2
y
3
. es la energa
del electrn en el C2p
y
atmico. (c) Forma de los 3 OM
enlazantes
de la molcula
de benceno.
C
6
C
5
C
4
H
6
C
3
H
3
H
5
H
4
C
1
H
1
C
2
H
2
y
(a)
6
HOMO
LUMO
E
n
e
r
g
a
(b)
1
2
3
4
5
6
1
+
1
2
3 5
6
-
2
4
+
1
3
4
5
6
+
3
-
(c)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
El enlace qumico-II-
Estados de agregacin de la materia
J D
Estructura electrnica en molculas. Teora de Orbitales Moleculares (OM)
(revisin)
Los OM se forman por combinacin lineal de los OA de igual simetra de los tomos que forma la molcula
La combinacin lineal de n OA da lugar a n OM (enlazante
y antienlazante, *)
Efecto sobre la energa del aumento del nmero de OA que se combinan linealmente
para obtener los OM. La diferencia de energas entre ellos es dada vez menor
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Slidos Metlicos
Estructura electrnica en metales. Teora de bandas (OM)
E
n
e
r
g
a
2s
Li
Li
2
Li
3
Li
4
.Li
N
Los OM obtenidos por la CL de los N OA de los tomos
de la red critalina
estn tan prximos en energa que casi
forman un continuo, es decir forman una Banda de
energa
Ejemplo de la formacin de la Banda de energa de
Valencia en la red metlica de Litio.
Banda de energa 2p en la red metlica de Berilio.(conduccin)
Banda de energa 2s
en la red metlica de Berilio
En el Li, la banda de valencia
es la Banda de
Conduccin
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
Slidos Metlicos
Estructura electrnica en metales. Teora de bandas (OM)
E
E
Conductores Semiconductores Aislantes
Qu
son semiconductores intrnsecos?
Qu
son semiconductores extrnsecos?
Qu
es el dopaje de semiconductores?
Utilidad de los semiconductores (clulas fotovoltaicas)
El enlace qumico-II-
Estados de agregacin de la materia
4802. J. Donoso-2008-2009
El enlace qumico III
Bibliografa
Qumica General.Vol
1. Enlace Qumico y Estructura de la Materia. 8
Ed. R.H.
PETRUCCI, W.S. HARWOOD, F.G. HERRING. Prentice Hall. Madrid. 2002
Qumica y Reactividad Qumica. 5
ed. J. C. KOTZ, P.M. TREICHEL. Ed.
Paraninfo-Thomson
Learning. Madrid. 2003
Estructura Atmica y Enlace Qumico. J. CASABO Ed. Revert, 1996
Enlace Qumico y Estructura de la Materia J. Donoso. Curso 07-08
Você também pode gostar
- API RP 571 - Mecanismos de Fallas Equipo EstaticoDocumento36 páginasAPI RP 571 - Mecanismos de Fallas Equipo EstaticoErick Cruz MontañezAinda não há avaliações
- Fuerzas IntermolecularesDocumento38 páginasFuerzas IntermolecularesTomas YarangaAinda não há avaliações
- Covintec Manual de Diseño Covintec CARGAZ Version A 2014Documento14 páginasCovintec Manual de Diseño Covintec CARGAZ Version A 2014herman reyesAinda não há avaliações
- S5 - Ejemplos y Ejercicios Resueltos - 5ta SemanaDocumento13 páginasS5 - Ejemplos y Ejercicios Resueltos - 5ta Semanapatricio diaz contrerasAinda não há avaliações
- Teoria-Quimica-Examen FinalDocumento16 páginasTeoria-Quimica-Examen FinalDiegoAinda não há avaliações
- Enlace Quimico IIIDocumento36 páginasEnlace Quimico IIIFranchesca SotomayorAinda não há avaliações
- Clase N2Documento8 páginasClase N2Rafael Rodriguez FalconAinda não há avaliações
- Clase 1 Estructura Atomica y Enlace QuímicoDocumento19 páginasClase 1 Estructura Atomica y Enlace QuímicoSofia GómezAinda não há avaliações
- Enlaces IntermolecularesDocumento7 páginasEnlaces IntermolecularesBrunoGabrielAragónAinda não há avaliações
- Fuerzas Intermoleculares - Estados de Agregacion 2020Documento58 páginasFuerzas Intermoleculares - Estados de Agregacion 2020alexis lepreAinda não há avaliações
- Guía Fuerzas Intermoleculares PDFDocumento12 páginasGuía Fuerzas Intermoleculares PDFpalomaAinda não há avaliações
- Enlaces IntermolecularesDocumento18 páginasEnlaces IntermolecularesLoren Paredes Garay100% (1)
- Facultad de Ingeniería Química y Textil: Ciclo Académico 2022-1Documento26 páginasFacultad de Ingeniería Química y Textil: Ciclo Académico 2022-1Alfaro Barrientos Diego MaximilianoAinda não há avaliações
- Teoria 1 Parte 3Documento33 páginasTeoria 1 Parte 3AndreaLopezAinda não há avaliações
- 2 Enlace y Fuerzas IntermolecularesDocumento64 páginas2 Enlace y Fuerzas IntermolecularesElmer QuispeAinda não há avaliações
- 01 Clase Introducción Interacciones MolecularesDocumento39 páginas01 Clase Introducción Interacciones MolecularesJHONJAYRO MARCOS SAAVEDRA VENTURAAinda não há avaliações
- Consult y Ejercicios Deber 1Documento6 páginasConsult y Ejercicios Deber 1Kevincito PapitoAinda não há avaliações
- FUERZAS IntermolecularesDocumento15 páginasFUERZAS Intermolecularesdannaeh gomez cortesAinda não há avaliações
- 07 - Fuerzas IntermolecularesDocumento17 páginas07 - Fuerzas IntermolecularesAriana Ansherly Salazar AriasAinda não há avaliações
- Presentación Unidad 4 - Fuerzas IntermolecularesDocumento21 páginasPresentación Unidad 4 - Fuerzas IntermolecularesLucas SabchezAinda não há avaliações
- 7 Fuerzas IntermolecularesDocumento25 páginas7 Fuerzas IntermolecularesLara MartinezAinda não há avaliações
- Sesión 4.-ENLACE - QUIMICO Clase 7 y 8 R.Cardenas O. 2013Documento26 páginasSesión 4.-ENLACE - QUIMICO Clase 7 y 8 R.Cardenas O. 2013Ana Reyna Rueda0% (1)
- Guía Teórica TP 1 y 2 2019Documento35 páginasGuía Teórica TP 1 y 2 2019Flor OtoneloAinda não há avaliações
- 1.2-Fuerzas Intermoleculares y SólidosfinalDocumento18 páginas1.2-Fuerzas Intermoleculares y SólidosfinalGustavo CabralAinda não há avaliações
- Guía Fuerzas IntermolecularesDocumento12 páginasGuía Fuerzas IntermolecularesPaulina Constenla SaideAinda não há avaliações
- Taller de QuimicaDocumento6 páginasTaller de QuimicaLuis MarinoAinda não há avaliações
- SIDWEB Fuerzas IntermolecularesDocumento71 páginasSIDWEB Fuerzas IntermolecularesAndrea MatamorosAinda não há avaliações
- Fuerzas IntermolecularesDocumento15 páginasFuerzas IntermolecularesLeo SAinda não há avaliações
- Fuerzas IntermolecularesDocumento5 páginasFuerzas IntermolecularesKariEspinozaAinda não há avaliações
- Soluciones IIDocumento44 páginasSoluciones IIjuansAinda não há avaliações
- Tensoactivos y EmulsionesDocumento37 páginasTensoactivos y EmulsionesGestión HumanaAinda não há avaliações
- Actividad Unione Químicas FinalDocumento3 páginasActividad Unione Químicas FinalAilin GamarraAinda não há avaliações
- Semana 7 LLDocumento18 páginasSemana 7 LLCESAR EDUARDO CARBONEL ESCOBEDOAinda não há avaliações
- Tema 2 Enlace QuimicoDocumento21 páginasTema 2 Enlace QuimicoDavid DeelavillaAinda não há avaliações
- 01.2 Estructura y Enlace Parte 2Documento12 páginas01.2 Estructura y Enlace Parte 2Luis Angel Caceres SoteloAinda não há avaliações
- Dec - Fq.edu - Uy Catedra Inorganica Inorganica Practica11Documento10 páginasDec - Fq.edu - Uy Catedra Inorganica Inorganica Practica11Daniel CabreraAinda não há avaliações
- Enlaces Clase 5 CivilDocumento30 páginasEnlaces Clase 5 CivilAlberto MalhaberAinda não há avaliações
- Cuestionario 2 de Bases Neurobio de La ConductaDocumento18 páginasCuestionario 2 de Bases Neurobio de La ConductaKarodeily ThomasAinda não há avaliações
- Solemne 1 Química General y OrgánicaDocumento11 páginasSolemne 1 Química General y Orgánicagustavo vargas diazAinda não há avaliações
- Interacciones Interparticulares: Fuerzas de London (O Fuerzas de Dispersión)Documento4 páginasInteracciones Interparticulares: Fuerzas de London (O Fuerzas de Dispersión)Agustin Rivera tapiAinda não há avaliações
- T.4 Estados de Agregacion DisolucionesDocumento8 páginasT.4 Estados de Agregacion Disolucionesanucissu15Ainda não há avaliações
- QUIMICA GENERAL U5 VirtualDocumento29 páginasQUIMICA GENERAL U5 VirtualDaniela CasanovaAinda não há avaliações
- Tema 1 Conceptos BasicosDocumento58 páginasTema 1 Conceptos BasicosRei ContrerasAinda não há avaliações
- Enlace Quimico 4Documento31 páginasEnlace Quimico 4sheyla ayelin jaramillo castroAinda não há avaliações
- Informe #4 QuimicaDocumento30 páginasInforme #4 Quimica23 33100% (1)
- Quimica BasicaDocumento33 páginasQuimica BasicaHiram M. ArispuroAinda não há avaliações
- Taller 1 Elementos y Compuestos QuímicosDocumento7 páginasTaller 1 Elementos y Compuestos QuímicosJULIAN OSWALDO TRIANA SANGUÑAAinda não há avaliações
- Bioquimica 1Documento116 páginasBioquimica 1Jamon Hernandez MartinezAinda não há avaliações
- Actividad Integradora Etapa 4 QUIMICA 1Documento6 páginasActividad Integradora Etapa 4 QUIMICA 1Kevin VS50% (2)
- Química t2 David RodriguezDocumento25 páginasQuímica t2 David RodriguezDavid RodriguezAinda não há avaliações
- El Enlace MetaticoDocumento3 páginasEl Enlace MetaticoMarcos LChAinda não há avaliações
- Compuestos IónicosDocumento33 páginasCompuestos Iónicossantosed100% (1)
- Clase 12. EL ENLACE QUÍMICODocumento31 páginasClase 12. EL ENLACE QUÍMICOAndres Felipe Prieto AlarconAinda não há avaliações
- Fuerzas IntermolecularesDocumento21 páginasFuerzas IntermolecularesRaedbeflo14Ainda não há avaliações
- 12 - Fuerzas Intermoleculares, SILBERBERGDocumento65 páginas12 - Fuerzas Intermoleculares, SILBERBERGBrayan ChopraAinda não há avaliações
- Informe Enlace QuímicoDocumento11 páginasInforme Enlace Químiconicole osesAinda não há avaliações
- Puentes de Hidrogenos y Enlaces de VanderwallsDocumento16 páginasPuentes de Hidrogenos y Enlaces de VanderwallsLucy KathAinda não há avaliações
- Fisicoquimica II 2012Documento366 páginasFisicoquimica II 2012Stiven AndrésAinda não há avaliações
- Estudio de FactibilidadDocumento2 páginasEstudio de FactibilidadAle ChiapperoAinda não há avaliações
- Cap 5 Chialvo PDFDocumento35 páginasCap 5 Chialvo PDFAle ChiapperoAinda não há avaliações
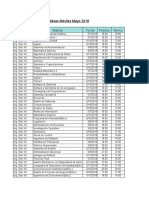
- Mesas Especiales - Abril 2018Documento1 páginaMesas Especiales - Abril 2018Ale ChiapperoAinda não há avaliações
- Planificación INTEGRACION IDocumento6 páginasPlanificación INTEGRACION IAle ChiapperoAinda não há avaliações
- Especialización en Ingenieria AmbientalDocumento23 páginasEspecialización en Ingenieria AmbientalAle ChiapperoAinda não há avaliações
- c1 Proyecciones Prov 2010 2040Documento25 páginasc1 Proyecciones Prov 2010 2040Ale ChiapperoAinda não há avaliações
- Mesas Móviles Mayo-2018Documento6 páginasMesas Móviles Mayo-2018Ale ChiapperoAinda não há avaliações
- Ejercicios Acido BaseDocumento3 páginasEjercicios Acido BaseAle Chiappero0% (1)
- Inscriptos Quimica - Examen FinalDocumento4 páginasInscriptos Quimica - Examen FinalAle ChiapperoAinda não há avaliações
- Reflex I Ones Poesia SDocumento25 páginasReflex I Ones Poesia Smiguelito55Ainda não há avaliações
- Mesa EspecialDocumento1 páginaMesa EspecialAle ChiapperoAinda não há avaliações
- TP Aceitesygrasas2012Documento7 páginasTP Aceitesygrasas2012Joser MoralesAinda não há avaliações
- TP Aceitesygrasas2012Documento7 páginasTP Aceitesygrasas2012Joser MoralesAinda não há avaliações
- Horario 2014: Ingeniería Química Primer CuatrimestreDocumento4 páginasHorario 2014: Ingeniería Química Primer CuatrimestreAle ChiapperoAinda não há avaliações
- Análisis Matemático II UTN FRBA V.6Documento105 páginasAnálisis Matemático II UTN FRBA V.6pcgamer1Ainda não há avaliações
- ColeraaaaDocumento20 páginasColeraaaaAle ChiapperoAinda não há avaliações
- Calculos Eslectricos PDFDocumento131 páginasCalculos Eslectricos PDFEnrique CoronelAinda não há avaliações
- File7038 Decreto4238 Cap - XV PDFDocumento2 páginasFile7038 Decreto4238 Cap - XV PDFAle ChiapperoAinda não há avaliações
- Guerra FríaDocumento12 páginasGuerra FríaAle ChiapperoAinda não há avaliações
- Agua-Recuento Placa FluidaDocumento4 páginasAgua-Recuento Placa FluidaAle ChiapperoAinda não há avaliações
- Análisis Matemático II UTN FRBA V.6Documento105 páginasAnálisis Matemático II UTN FRBA V.6pcgamer1Ainda não há avaliações
- AMII Martini (2013) Guia CompletaDocumento81 páginasAMII Martini (2013) Guia CompletaAle ChiapperoAinda não há avaliações
- Memoria de Cálculo Tarea 4 DUOCDocumento11 páginasMemoria de Cálculo Tarea 4 DUOCjav.sepulvedaAinda não há avaliações
- Mapa Conceptual ElectrotecniaDocumento1 páginaMapa Conceptual Electrotecniadamaris quirozAinda não há avaliações
- Doblez de LáminaDocumento5 páginasDoblez de LáminafelipeAinda não há avaliações
- Ejercicios1 FisicaSemiconductoresDocumento6 páginasEjercicios1 FisicaSemiconductoresArnold Giovanny hernandez carvajalAinda não há avaliações
- Análisis de Fluidos Unidad 2Documento106 páginasAnálisis de Fluidos Unidad 2Alejandro Medina BalderasAinda não há avaliações
- Lab 2 Fisica de FluidosDocumento13 páginasLab 2 Fisica de FluidosEna EncisoAinda não há avaliações
- Termodinamica - Modulo 3 - PARTE 1Documento37 páginasTermodinamica - Modulo 3 - PARTE 1Ety Viloria CastilloAinda não há avaliações
- Laboratorio 2 - Sistemas CristalinosDocumento7 páginasLaboratorio 2 - Sistemas CristalinosFabian Andre Maquera AlcahuamanAinda não há avaliações
- Factores de Conversion de UnidadesDocumento6 páginasFactores de Conversion de UnidadesMel LunaAinda não há avaliações
- Procesos de MNFCDocumento8 páginasProcesos de MNFCRafa EspiridionAinda não há avaliações
- Traccion InformeDocumento22 páginasTraccion InformeDalian Canaviri CardenasAinda não há avaliações
- Qad Bocatoma ADocumento8 páginasQad Bocatoma AJOSE HEREDIA PEREZAinda não há avaliações
- Evaluacion de Esutructuras de Concreto Sometidas A Carbonatacion y CorrosionDocumento111 páginasEvaluacion de Esutructuras de Concreto Sometidas A Carbonatacion y CorrosionMauricio MuñozAinda não há avaliações
- TERMODINAMICA. GNDocumento21 páginasTERMODINAMICA. GNlily_x1263822Ainda não há avaliações
- FormularioFQ1 1Documento6 páginasFormularioFQ1 1Emma CastellanosAinda não há avaliações
- Cronograma SMDocumento1 páginaCronograma SMmonicamonserrattorrespuenteAinda não há avaliações
- Schneider Electric - Zelio-Control - RM22TR33Documento5 páginasSchneider Electric - Zelio-Control - RM22TR33Ricardo AguileraAinda não há avaliações
- Tension Superficial Falta Todo Calculos y Discusion de Resultados.Documento7 páginasTension Superficial Falta Todo Calculos y Discusion de Resultados.sergiosanuelmp0% (1)
- Modelo VSPRDocumento14 páginasModelo VSPRErika PèrezAinda não há avaliações
- Guia de Aprendizaje Sem 3.actualizadoDocumento4 páginasGuia de Aprendizaje Sem 3.actualizadoJhord'y RiiveraAinda não há avaliações
- Fundamentos de FlexionDocumento17 páginasFundamentos de FlexionDavid GomezAinda não há avaliações
- MC-04 Puntos de Amarre AkerDocumento9 páginasMC-04 Puntos de Amarre AkerAntonio VizaAinda não há avaliações
- 000872692PYDocumento62 páginas000872692PYEDWAR ERNESTO PACHAS MONTOYAAinda não há avaliações
- GUÍA NO 4 y 5 PDFDocumento7 páginasGUÍA NO 4 y 5 PDFAlison ForeroAinda não há avaliações
- Análisis de FallasDocumento19 páginasAnálisis de FallasDavid Gustavo Montalvo SerranoAinda não há avaliações
- Relé SFKDocumento3 páginasRelé SFKNicolas Forero PabonAinda não há avaliações
- Conceptos Básicos de Circuitos Eléctricos - 182069Documento6 páginasConceptos Básicos de Circuitos Eléctricos - 182069LUIS ERNESTO BERMUDEZ VAZQUEZAinda não há avaliações