Escolar Documentos
Profissional Documentos
Cultura Documentos
Cinetica Final-1 PDF
Enviado por
Mary Cabral SalazarTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Cinetica Final-1 PDF
Enviado por
Mary Cabral SalazarDireitos autorais:
Formatos disponíveis
Objetivo
Determinar la constante de equilibrio de la reaccin de esterificacin del cido
actico con etanol mediante anlisis qumico de la mezcla.
CH
3
COOH + C
2
H
5
OH CH
3
COOC
2
H
5
+ H
2
O
Con los conocimientos adquiridos en clase desarrollar y aplicarlos para lo que se
refiere al equilibrio qumico y a su determinacin.
Fijar el concepto de equilibrio qumico mediante el estudio experimental de distintas
mezclas de reaccin.
Introduccin
En trminos generales, toda reaccin qumica tiene dos caractersticas de
considerable importancia: la posicin de equilibrio y la velocidad de reaccin. El
concepto de velocidad de reaccin se abord durante la prctica pasada, por lo que
en el siguiente espacio, se tratar ms extensamente acerca del concepto de
equilibrio qumico.
Cuando se habla de equilibrio, lo que interesa conocer es la estabilidad relativa,
tanto de los reactivos como de los productos y cuales son las concentraciones de
cada uno en el mismo. El equilibrio qumico tambin lleva a considerar el trmino de
reacciones irreversibles, denominado as debido a que se pueden desarrollar en
ambos sentidos de la reaccin, es decir, de reactivos a productos y viceversa.
El equilibrio qumico es el estado en el que las actividades qumicas de las
concentraciones de los reactivos y productos no tienen ningn cambio neto en el
tiempo. Normalmente ste sera el estado que se produce cuando el proceso
qumico evoluciona hacia adelante en la misma proporcin que su reaccin inversa.
A su vez, gran parte de su estudio se basa en lo que se conoce como ley de accin
de masas, y en la determinacin del valor de la constante de equilibrio, lo cual es
de gran importancia y utilidad para conocer el desempeo de los procesos qumicos.
(Martnez, 2011)
El equilibrio qumico es el estado en el que las actividades qumicas de las
concentraciones de los reactivos y productos no tienen ningn cambio neto en el
tiempo. Normalmente ste sera el estado que se produce cuando el proceso
qumico evoluciona hacia adelante en la misma proporcin que su reaccin inversa.
La velocidad de reaccin de las reacciones directa e inversa por lo general no son
cero, sin embargo, son iguales, no hay cambios netos en cualquiera de las
concentraciones de los reactivos o productos. Este proceso se denomina equilibrio
dinmico. El concepto de equilibrio qumico fue desarrollado despus de que
Bertholle (1803) encontrase que algunas reacciones qumicas son reversibles. Para
que una reaccin, tal como:
pueda estar en equilibrio, las velocidades de reaccin directa e inversa tiene que
ser iguales. Esta ecuacin qumica con flechas apuntando en ambas direccione es
para indicar el equilibrio, A y B son las especies qumicas que reaccionan, S y T son
los productos y , , y son los coeficientes estequiomtricos de los reactivos y
los productos.
http://practicaslaboratorio08.blogspot.mx/2013/03/practica-3-cinetica-y-
equilibrio.html
Marco Terico
-Material y equipo necesario.
Frascos con tapa o tubos de ensayo con tapa (7)
Bureta de 25mL (1)
Matraz Erlenmeyer de 125mL (2)
Matraz volumtrico 250mL (1), 50mL (1)
Pipeta de 5mL (4)
Hidrxido de sodio 0.5M
cido clorhdrico 3M
cido actico
Alcohol etlico
Acetato de etilo
-Procedimiento
Para determinar el valor de la constante de equilibrio por anlisis qumico se
preparan una serie de mezclas de reaccin que contienen distintas cantidades de
los reactivos y productos, algunas con exceso de reactivos, otras con exceso de
productos. De este modo, la reaccin se desplazar hacia uno u otro lado para
alcanzar el equilibrio. En la mezcla de reaccin se aadir tambin una cantidad
conocida de cido clorhdrico, que acta como catalizador y reduce el tiempo
necesario para que se establezca el equilibrio.
En la Tabla 1 se sugiere un conjunto de mezclas para la realizacin del estudio.
Tabla 1. Mezclas de ensayo
Muestra mL
HCl 3M
mL
cido actico
mL
etanol
mL
ster
mL
agua
1 5 0 0 5 0
2 5 0 0 3 2
3 5 0 0 2 3
4 5 1 4 0 0
5 5 2 3 0 0
6 5 3 2 0 0
7 5 4 1 0 0
-Preparacin de mezclas
1. Pipetear las cantidades indicadas e introducirlas en frascos o tubos provistos
de tapn. Tapar los frascos inmediatamente, asegurndose de que cierran
bien.
2. Determinar el nmero de moles de cada sustancia contenida en cada frasco.
Para ello debe tenerse en cuenta que:
3. El nmero de moles de cido actico, etanol y ster se calculan empleando
las densidades de las sustancias facilitadas en el laboratorio.
4. El nmero de moles de agua se calcula suponiendo que la densidad del agua
es 1g/mL.
5. El nmero de moles de cido clorhdrico se calcula a partir de la
concentracin de la disolucin.
6. El nmero de moles de agua aadidos con la disolucin de cido clorhdrico
se calcula a partir de la concentracin del cido, suponiendo que la densidad
de la disolucin es 1g/mL.
7. Dejar los frascos a temperatura ambiente, agitando de vez en cuando,
durante una semana.
8. Valorar las mezclas en equilibrio utilizando una disolucin de NaOH 0.5 M.
RESULTADOS
Moles inciales
Tubo 1
= = (3
) (5 ) = 0.015
=
=
(1
)(5 )
(18
)
= 0.2777
=
=
(0.897
)(5 )
(88
)
= 0.05096
Tubo 2
= = (3
) (5 ) = 0.015
=
= 0.2777 +
(1
)(2 )
(18
)
= 0.3888
=
=
(0.897
)(3 )
(88
)
= 0.03057
Tubo 3
= = (3
) (5 ) = 0.015
=
= 0.2777 +
(1
)(3 )
(18
)
= 0.4444
=
=
(0.897
) (2 )
(88
)
= 0.020386
Tubo 4
= = (3
) (5 ) = 0.015
=
=
(1
)(5 )
(18
)
= 0.2777
=
=
(1.05
)(1 )
(60
)
= 0.0175
=
=
(0.789
)(4 )
(46
)
= 0.068608
Tubo 5
= = (3
) (5 ) = 0.015
=
=
(1
)(5 )
(18
)
= 0.2777
=
=
(1.05
)(2 )
(60
)
= 0.035
=
=
(0.789
)(3 )
(46
)
= 0.051456
Tubo 6
= = (3
) (5 ) = 0.015
=
=
(1
)(5 )
(18
)
= 0.2777
=
=
(1.05
)(3 )
(60
)
= 0.0525
=
=
(0.789
)(2 )
(46
)
= 0.034304
Tubo 7
= = (3
)(5 ) = 0.015
=
(1
)(5 )
(18
)
= 0.2777
=
(1.05
)(4 )
(60
)
= 0.07
=
(0.789
)(1 )
(46
)
= 0.01715
Para la neutralizacin del cido clorhdrico se necesito un volumen de NaOH
determinado por
=
( )( )
=
(
3
)(0.1 )
0.5
= 0.6
Anlisis
-Tubo 1
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
cidoAcetico 0 0.006 0 0.006
Etanol 0 0.006 0 0.006
ster 0.0509 0 0.006 0.0449
Agua 0.2777 0 0.006 0.2717
-Tubo 2
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
cidoAcetico 0 0.0135 0 0.0135
Etanol 0 0.0135 0 0.0135
ster 0.0305 0 0.0135 0.017
Agua 0.3888 0 0.0135 0.3753
-Tubo 3
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
Tubos Volumen
NaOH en
titulacin
Vol. NaOH
neutralizacin
HCl (mL)
Vol. NaOH para
neutralizacin
del a.acetico
Concentracin
a.acetico
(mol/mL)
Moles
a.acetico
(mol)
1 1.8 0.6 1.2 0.006 0.03
2 3.3 0.6 2.7 0.0135 0.0675
3 1.2 0.6 0.6 0.003 0.015
4 1.4 0.6 0.8 0.004 0.02
5 1.0 0.6 0.4 0.002 0.01
6 4.3 0.6 3.7 0.0185 0.0925
7 3.4 0.6 2.8 0.014 0.007
cidoAcetico 0 0.003 0 0.003
Etanol 0 0.003 0 0.003
ster 0.0203 0 0.003 0.0173
Agua 0.4444 0 0.003 0.4414
-Tubo 4
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
cidoAcetico 0.0175 0 0.004 0.0135
Etanol 0.0686 0 0.004 0.0646
ster 0 0.004 0 0.004
Agua 0.2777 0.004 0 0.2817
-Tubo 5
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
cidoAcetico 0.035 0 0.002 0.033
Etanol 0.05145 0 0.002 0.04945
ster 0 0.002 0 0.002
Agua 0.2777 0.002 0 0.2797
-Tubo 6
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
cidoAcetico 0.0525 0 0.0185 0.034
Etanol 0.0343 0 0.0185 0.0158
ster 0 0.0185 0 0.0185
Agua 0.2777 0.0185 0 0.2962
-Tubo 7
Especie Inicio (mol) Producidos
(mol)
Consumidos
(mol)
Final (mol)
cidoAcetico 0.07 0 0.014 0.056
Etanol 0.0171 0 0.014 0.0031
ster 0 0.014 0 0.014
Agua 0.2777 0.014 0 0.2917
Constantes de Equilibrio
Tubo 1
=
(0.0449)(0.2717 )
(0.006)(0.006
= 338.87
Tubo 2
=
(0.017 )(0.3753 )
(0.0135 )(0.0135)
= 35.007
Tubo 3
=
(0.0173 )(0.4414 )
(0.003 )(0.003)
= 848.46
Tubo 4
=
(0.004)(0.2817 )
(0.0135 )(0.0646 )
= 1.2920
Tubo 5
=
(0.002 )(0.2797 )
(0.033 )(0.04945 )
= 0.3428
Tubo 6
=
(0.0185 )(0.2962)
(0.034 )(0.0158 )
= 10.2004
Tubo 7
=
(0.014 )(0.2917 )
(0.056 )(0.0031 )
= 23.52
CONCLUSIONES
A lo largo de la realizacin de la practica vimos el sumo cuidado que se debe de
tener al momento de manejar las sustancias, para que al hacer las mezclas y la
titulacin de estas cumplan con las necesidades requeridas por la prctica, as como
se usaron los conceptos obtenidos en clase como equilibrio qumico, principio de Le
Chatelier, etc. Con lo que todo lo realizado a lo largo de la prctica se relaciona
ntimamente con los conceptos y ejercicios que practicamos en clase. Maria
Fernanda Fierro Lagos
En la elaboracin de esta practica pudimos determinar la cantidad de hidrxido de
sodio necesario para poder neutralizar el acido. A partir de esto se logro determinar
las constantes de equilibrio y comprender mejor el principio de Lechatelier. Mara
Graciela Cabral Salazar.
La prctica refleja de manera sencilla los problemas vistos en clase, moles iniciales,
moles consumidos, moles totales, moles finales, equilibrio qumico etc. Por lo que
de esta manera uno entiende de mejor manera lo que est pasando en las
reacciones y sus mezclas resultantes.
Luis Francisco Vzquez Castillo
En la prctica se observa como se comportan las reacciones, en este caso la
reaccin de neutralizacin, para lo cual se llev a cabo la titulacin, donde en
algunos casos se pudo observar que con una diferencia mnima, el indicador
tomaba una coloracin muy diferente de la deseada, lo cual puede deberse a una
concentracin de acido mayor o menor, lo que prueba que la constante de
equilibrio se relaciona con las concentraciones
Iaki Gamero Barraza
BIBLIOGRAFIA
http://www.mcgraw-hill.es/bcv/guide/capitulo/84481696X.pdf
(Martnez, 2011)
http://practicaslaboratorio08.blogspot.mx/2013/03/practica-3-cinetica-y-
equilibrio.html
Você também pode gostar
- Preparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaNo EverandPreparar y acondicionar elementos y máquinas de la planta química. QUIE0108: Operaciones básicas en planta químicaNota: 3 de 5 estrelas3/5 (2)
- Equilibrio QuimicoDocumento13 páginasEquilibrio QuimicoSebastianNavarroJuarezAinda não há avaliações
- Practica-4-Termo4 (1) ESIQIEDocumento13 páginasPractica-4-Termo4 (1) ESIQIEJesus Vazquez100% (1)
- Determinacion de La Constante de Equilibrio QuimicoDocumento9 páginasDeterminacion de La Constante de Equilibrio QuimicoAlejandro Ramirez AlpizarAinda não há avaliações
- Practica 4 Termo 4Documento9 páginasPractica 4 Termo 4Ariana CastroAinda não há avaliações
- Determinacion de La Constante de Equilibrio QuimicoDocumento8 páginasDeterminacion de La Constante de Equilibrio QuimicomyratrespalaciosAinda não há avaliações
- Practica-7 - LII (EQUIPO 3)Documento24 páginasPractica-7 - LII (EQUIPO 3)jaquelineAinda não há avaliações
- Practica 4 Termo4 1 ESIQIEDocumento14 páginasPractica 4 Termo4 1 ESIQIEJosue CarmonaAinda não há avaliações
- p5 QuimicaDocumento11 páginasp5 QuimicaBrandon Daniel Bobadilla LopezAinda não há avaliações
- Determinación de La Constante de Equilibrio QuímicoDocumento8 páginasDeterminación de La Constante de Equilibrio QuímicoMarlon AlarconAinda não há avaliações
- Equilibrio Quimico LabDocumento6 páginasEquilibrio Quimico LabJose Fernandez100% (1)
- 2.3 Metodos para La Determinación de La Velocidad de ReacciónDocumento20 páginas2.3 Metodos para La Determinación de La Velocidad de ReacciónJORDIAinda não há avaliações
- Practica 2 Termo 4Documento10 páginasPractica 2 Termo 4Diana JulietaAinda não há avaliações
- Practica 5Documento12 páginasPractica 5JesusOswaldoHolguinFloresAinda não há avaliações
- Practica 08a Determinacion de La Constante de EquilibrioDocumento4 páginasPractica 08a Determinacion de La Constante de EquilibrioJesus AguillonAinda não há avaliações
- Constante de EquilibrioDocumento8 páginasConstante de EquilibrioMaggyBalcazarAinda não há avaliações
- Cinetica de SaponificacionDocumento19 páginasCinetica de SaponificacionZulema Diana Rodríguez PadillaAinda não há avaliações
- Práctica 13 Equilibrio QuímicoDocumento4 páginasPráctica 13 Equilibrio QuímicoCarlos “Charly” Gómez LópezAinda não há avaliações
- PRÁCTICA 6. Determinación de La Constante de Equilibrio.Documento6 páginasPRÁCTICA 6. Determinación de La Constante de Equilibrio.MartinDuarte100% (2)
- Informe de Laboratorio 3Documento6 páginasInforme de Laboratorio 3Geraldine ReyesAinda não há avaliações
- Práctica #5 - Equipo 4Documento11 páginasPráctica #5 - Equipo 4Renata Beatríz Castillo RuizAinda não há avaliações
- Determinación de La Constante de Equilibrio QuímicoDocumento8 páginasDeterminación de La Constante de Equilibrio QuímicoMarlon Alarcon50% (2)
- PRÁCTICA 8 - Reacciones de Derivados de Ácidos CarboxílicosDocumento5 páginasPRÁCTICA 8 - Reacciones de Derivados de Ácidos CarboxílicosVanya MenesesAinda não há avaliações
- Informe Organica II Sintesis de CiclohexenoDocumento14 páginasInforme Organica II Sintesis de CiclohexenoOlivia López CarrielAinda não há avaliações
- Informe 7 TerminadoDocumento13 páginasInforme 7 TerminadoMelanie Montecinos PeñaAinda não há avaliações
- Guion PracticasDocumento7 páginasGuion PracticasMarcosAinda não há avaliações
- Práctica 2. Constante de Equilibrio KCDocumento16 páginasPráctica 2. Constante de Equilibrio KCKaren AyalaAinda não há avaliações
- Sintesis de Acetato de EtiloDocumento6 páginasSintesis de Acetato de EtiloMaria J AncoAinda não há avaliações
- Practica 5 - Funcionamiento de Un Reactor Mezcla Completa - T.A.C. - en Estado EstacionarioDocumento8 páginasPractica 5 - Funcionamiento de Un Reactor Mezcla Completa - T.A.C. - en Estado EstacionarioPriscila Saavedra0% (1)
- Fico 2Documento20 páginasFico 2Adrian Quispe100% (1)
- Yodación de AcetonaDocumento9 páginasYodación de AcetonaFernanda GómezAinda não há avaliações
- Cuestionario ChidoDocumento4 páginasCuestionario ChidoSergioAinda não há avaliações
- Informe - 5 Lab Reactores UMSSDocumento8 páginasInforme - 5 Lab Reactores UMSScristianAinda não há avaliações
- P7 Cinetica Oxidacion de Etanol Por CrVIDocumento9 páginasP7 Cinetica Oxidacion de Etanol Por CrVIDani FPAinda não há avaliações
- Informe Laboratorio QuimicaDocumento6 páginasInforme Laboratorio QuimicafacuszimerAinda não há avaliações
- Guia de Laboratorio 12-QuimicaDocumento16 páginasGuia de Laboratorio 12-QuimicaGianella Miranda0% (1)
- Presentacion 3: Reacciones ReversiblesDocumento13 páginasPresentacion 3: Reacciones Reversiblesquimica100% (1)
- P2R - Trejo Ortiz Jose AntonioDocumento9 páginasP2R - Trejo Ortiz Jose AntonioAlan ZamudioAinda não há avaliações
- Informe 5 Grupo 6 MiercolesDocumento10 páginasInforme 5 Grupo 6 MiercolesDaniela Orellana ArnezAinda não há avaliações
- Laboratorio 5 Q IIDocumento3 páginasLaboratorio 5 Q IIBrayan Velez0% (1)
- Equilibrio Liquido LiquidoDocumento17 páginasEquilibrio Liquido LiquidoDisco17Ainda não há avaliações
- Equilibrio Quimico Homogeneo en La Fase LiquidaDocumento9 páginasEquilibrio Quimico Homogeneo en La Fase LiquidaMelissa RivaAinda não há avaliações
- Practica No. 4 SaponificacionDocumento8 páginasPractica No. 4 SaponificacionRocíoVerásteguiParedesAinda não há avaliações
- 6 Cinetica - Iodo AcetonaDocumento9 páginas6 Cinetica - Iodo AcetonaPaula Montes de OcaAinda não há avaliações
- 2.1 Constante de Equilibrio Quimico en Sistemas HomogeneosDocumento15 páginas2.1 Constante de Equilibrio Quimico en Sistemas HomogeneosJORDIAinda não há avaliações
- Equilibrio Químico Homogéneo en La Fase LíquidaDocumento10 páginasEquilibrio Químico Homogéneo en La Fase LíquidaJUNIORAinda não há avaliações
- Practica 11Documento11 páginasPractica 11diego muñoz arellanoAinda não há avaliações
- Analitica 3Documento3 páginasAnalitica 3Alex CastañedaAinda não há avaliações
- MP Química OrgánicaDocumento18 páginasMP Química Orgánicajasguapo10Ainda não há avaliações
- Manual de Practicas Lab - Qa1 Iq 2023Documento40 páginasManual de Practicas Lab - Qa1 Iq 2023Luis Fernando Morales CastañedaAinda não há avaliações
- Practica Nº4 Equilibrio QuimicoDocumento6 páginasPractica Nº4 Equilibrio QuimicoQUÍMICAAinda não há avaliações
- Equilibrio Quimico y Velocidad de ReaccionDocumento7 páginasEquilibrio Quimico y Velocidad de Reaccionnestor chambi100% (3)
- Practica9 Reactor Estado No EstacionarioDocumento13 páginasPractica9 Reactor Estado No EstacionarioGonzalo FloresAinda não há avaliações
- 1.introducción: Funcionamiento de Un Reactor Mezcla Completa T.A.C en Estado EstacionarioDocumento9 páginas1.introducción: Funcionamiento de Un Reactor Mezcla Completa T.A.C en Estado EstacionarioJacqui Villarroel CocaAinda não há avaliações
- Estatus ácido-base: Conceptos, desequilibrios e interpretaciónNo EverandEstatus ácido-base: Conceptos, desequilibrios e interpretaciónAinda não há avaliações
- Psicometría. Principios básicos y protocolos experimentales diversosNo EverandPsicometría. Principios básicos y protocolos experimentales diversosAinda não há avaliações
- Técnicas analíticas básicas: En el control de la calidad del agua según normatividadNo EverandTécnicas analíticas básicas: En el control de la calidad del agua según normatividadAinda não há avaliações
- Equipos AmbientalDocumento3 páginasEquipos AmbientalMary Cabral SalazarAinda não há avaliações
- Absorcion AlimentosDocumento2 páginasAbsorcion AlimentosMary Cabral SalazarAinda não há avaliações
- Columna de DestilaciónDocumento4 páginasColumna de DestilaciónMary Cabral SalazarAinda não há avaliações
- Columna de DestilaciónDocumento4 páginasColumna de DestilaciónMary Cabral SalazarAinda não há avaliações
- Trabajo ElectroforesisDocumento9 páginasTrabajo ElectroforesisMary Cabral SalazarAinda não há avaliações
- 06 - Apunte Molienda SAG AGDocumento25 páginas06 - Apunte Molienda SAG AGOmar Ortiz ConchaAinda não há avaliações
- Arte y Sus ManifestacionesDocumento12 páginasArte y Sus ManifestacionesMary Cabral SalazarAinda não há avaliações
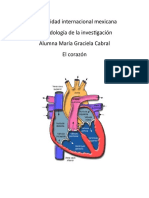
- CORAZÓNDocumento13 páginasCORAZÓNMary Cabral SalazarAinda não há avaliações
- Campo Magnetico Iman Cilindrico 2014Documento13 páginasCampo Magnetico Iman Cilindrico 2014Fernando NavarroAinda não há avaliações
- Semikon TE006D TreadmillDocumento24 páginasSemikon TE006D TreadmillNector Rodrigo PinillaAinda não há avaliações
- EURAMET Cg-18 v04 Traducción Rev FinalDocumento144 páginasEURAMET Cg-18 v04 Traducción Rev Finallp2508gcAinda não há avaliações
- 82859875735Documento3 páginas82859875735AlejandroAinda não há avaliações
- Antenas FractalesDocumento10 páginasAntenas FractalesBrayan Berthin Zegarra AranaAinda não há avaliações
- Curvas VerticalesDocumento13 páginasCurvas VerticalesmathsroAinda não há avaliações
- Result Ante de Fuerzas Colineales MiaDocumento12 páginasResult Ante de Fuerzas Colineales Miaaleja72Ainda não há avaliações
- Mecanismos y EstructurasDocumento5 páginasMecanismos y EstructurasAlan Herrera SerraldeAinda não há avaliações
- 2022 08 19 17 24 56Documento4 páginas2022 08 19 17 24 56Emma Elizabeth Ruiz GarciaAinda não há avaliações
- Vale de ExplosivoDocumento4 páginasVale de Explosivolols122Ainda não há avaliações
- Analisis de Trabajo Seguro TrabajoDocumento1 páginaAnalisis de Trabajo Seguro TrabajoMiller Aponte100% (1)
- Problemas de FisicaDocumento8 páginasProblemas de FisicaJuan Carlos Huanaco AguirreAinda não há avaliações
- Ebmop U1 A1 EnmrDocumento6 páginasEbmop U1 A1 EnmrEnrique Martinez Rodriguez100% (1)
- Ecuaciones Diferenciales Pee 2 UsachDocumento7 páginasEcuaciones Diferenciales Pee 2 UsachDavid StoreChileAinda não há avaliações
- Lista de Ejercicios 2 - 2017-IDocumento2 páginasLista de Ejercicios 2 - 2017-ICristhian Bello MedinaAinda não há avaliações
- ASTM D698-78 Método de Ensayo Estándar para Determinar La Relacion Humedad-Densidad de Suelos y Mezclas de Suelo-Agregado Usando Un Martilo de 2.49 KDocumento9 páginasASTM D698-78 Método de Ensayo Estándar para Determinar La Relacion Humedad-Densidad de Suelos y Mezclas de Suelo-Agregado Usando Un Martilo de 2.49 KDagoberto VergaraAinda não há avaliações
- Antología Poética - Eduardo JonquièresDocumento38 páginasAntología Poética - Eduardo JonquièresJulián D'AlessandroAinda não há avaliações
- Motorizacion Conmutador Seccionador TelergonDocumento1 páginaMotorizacion Conmutador Seccionador TelergonAnonymous DefbSuwiAinda não há avaliações
- Notas de Relatividad GeenralDocumento248 páginasNotas de Relatividad GeenralbrunoespinAinda não há avaliações
- Anexo 1 Valvula Shut DownDocumento16 páginasAnexo 1 Valvula Shut DownJosé Torres Ramírez100% (1)
- Guia de Estudio para ENAT 2014-1Documento5 páginasGuia de Estudio para ENAT 2014-1Felipe Oyarzo GonzalezAinda não há avaliações
- Informe de Asistencia Tecnica de Verificación de Contenido Neto (Venezuela)Documento4 páginasInforme de Asistencia Tecnica de Verificación de Contenido Neto (Venezuela)Edlander CarmonaAinda não há avaliações
- Propuestas de Estaciones de Calistenia en Distintos Puntos de La CuidadDocumento11 páginasPropuestas de Estaciones de Calistenia en Distintos Puntos de La CuidadJuan Andrés GrañaAinda não há avaliações
- Guia Gratis Inmortal Brazo de 45Documento4 páginasGuia Gratis Inmortal Brazo de 45Rodrigo A. ManzeraAinda não há avaliações
- Curl de Biceps PDFDocumento7 páginasCurl de Biceps PDFMärtïn väldësAinda não há avaliações
- Orient AdoresDocumento7 páginasOrient AdoresSandra KarenAinda não há avaliações
- Estiramiento y Su Inportancia 2Documento3 páginasEstiramiento y Su Inportancia 2Anonymous VtbMRLAinda não há avaliações
- Ejercicios para Un Cuerpo Flexible y Tonificado: Lydie RaisinDocumento6 páginasEjercicios para Un Cuerpo Flexible y Tonificado: Lydie Raisinjose cruz aAinda não há avaliações
- Mesociclo de Entrenamiento N3Documento1 páginaMesociclo de Entrenamiento N3robertAinda não há avaliações
- Problema de TornoDocumento4 páginasProblema de TornoElias Zavaleta Ibañez33% (3)