Escolar Documentos
Profissional Documentos
Cultura Documentos
Ley de Rault
Enviado por
Franklin SalasDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ley de Rault
Enviado por
Franklin SalasDireitos autorais:
Formatos disponíveis
Ley de Rault.
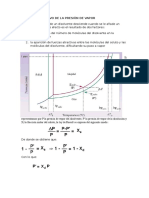
Es una ley aproximada que corresponde a la visin simplificada a una
disolucin.
Generalidades
Una de las caractersticas coligativas de las disoluciones es la
Soluto y disolvente en una disolucin ideal
disminucin de la presin de vapor que ocurre cuando se agrega soluto a un disolvente
puro.
En 1886 Franois Marie Raoult realiz numerosos experimentos en los que estableci
en la determinacin de pesos moleculares de diferentes disolventes, que el descenso
relativo de la presin de vapor por la accin de un soluto no voltil era proporcional a la
concentracin del soluto, lo cual concreta en la expresin aplicada a descensos de la
presin de vapor f-f, en ter.
Al ao siguiente lo aplica a otros disolventes distintos, formulando la ley que publica en
Comptes rendus: Una molcula de una sustancia no salina disuelta en 100 molculas
de un lquido voltil, disminuye la presin de vapor de este lquido en una fraccin
constante, aproximadamente 0,0105. [1]
Raoult encontr que cuando se agregaba soluto a un disolvente puro disminua la
presin de vapor del disolvente. Entre ms se agrega ms disminuye la presin de
vapor. Este estatuto llego a ser conocido como ley de Rault, fue elaborada por Franois
Marie Raoult, basndose en experimentos que llev a cabo en 1886, a finales del
siglo XIX.
Establece como conclusin: En una disolucin ideal, las presiones parciales de cada
componente en el vapor, son directamente proporcionales a sus respectivas fracciones
molares en la disolucin. [2].
Expresadas simblicamente estas leyes adoptan la forma:
Pvi=Pvoi. Xi
Donde:
Pvi= Presin de vapor del componente i en la mezcla.
Pvoi = Presin de vapor del componente i puro. (este valor depende de la
temperatura de trabajo).
Xi= Fraccin molar del componente en la disolucin
Es decir que la presin de vapor del soluto crece linealmente con su fraccin molar.
Consecuentemente a medida que el nmero de componentes gaseosos va creciendo
en la disolucin, la presin de los componentes individuales decrece, as como la
fraccin molar de cada uno de ellos que va decreciendo igualmente con la adicin de
nuevos componentes. Si se tuviera un soluto puro, se alcanzara el valor nulo de
presin de vapor (es decir el cuerpo no se evaporara). En este caso la presin de
vapor de la disolucin sera igual a la suma de las presiones parciales de cada
componente (Ley de Dalton).
La ley de Rault se cumple de forma cuantitativa nicamente para disoluciones ideales.
A medida que nos alejamos de la idealidad, nos alejamos de los resultados exactos.
Por consiguiente se puede plantear que una disolucin es ideal cuando cumple con la
ley de Roult. Es obvio que estas no son ms que un modelo fsico que refleja
simplificadamente la realidad objetiva.
Disoluciones ideales
Es aquella en la que cada molcula de los componentes en la mezcla
Las mezclas que presentan un grfico similar al de la figura se denominan mezclas ideales
es afectada por las mismas fuerzas, como si estuviesen en estado puro.
En las disoluciones ideales ha de cumplirse que:
1. Sus componentes pueden mezclarse entre s en cualquier proporcin, o sea,
que la solubilidad de cada uno de ellos en el otro es ilimitada.
2. No se consume ni libera energa al formar la disolucin partiendo de sus
componentes (sin variacin trmica).
3. No hay cambio de volumen al formar la mezcla (sin variacin de volumen).
4. La naturaleza qumica de ambos lquidos deben ser muy semejantes.
En la prctica las disoluciones muy diluidas se comportan como disoluciones ideales.
Ejemplo de esto son las disoluciones formadas por los componentes:
benceno-tolueno
benceno xileno
n. hexano- n heptano (30 oC)
bromuro de etilo-yoduro de etilo
cloruro de n-butilo bromuro de n-butilo (50 oC)
Cuya analoga es evidenteo
Desviaciones de la ley de Rault
Cuando existen interacciones entre las molculas de A y B de una mezcla, la presencia
de una de ellas afectar a la tendencia al escape de la otra.
Si B presenta fuerzas intermoleculares entre s mayores que las de
Desviacin positiva y negativa de la ley de Raoult
A entre s, el efecto que producir agregar molculas de B al lquido A ser aumentar la
tendencia al escape de este ltimo; por lo tanto la presin de vapor de A ser mayor a
la del lquido puro. Este comportamiento se denomina desviacin positiva de la ley de
Raoult.
En cambio, si las molculas de A interaccionan ms fuertemente con las molculas de
B que consigo mismas, la presin de vapor de A ser menor que la del lquido puro.
Este tipo de comportamiento se conoce con el nombre de desviacin negativa de la ley
de Raoult.
Aplicacin
La teora de la destilacin es una de las aplicaciones de la ley de
Aparato de destilacin
Raoult.
Se emplea con el objetivo de separar los componentes puros. Si estos
poseen temperatura de ebullicin muy diferentes se separan por destilacin simple y si
poseen temperatura de ebullicin muy prximos por destilacin fraccionada.
Você também pode gostar
- Psicometría. Principios básicos y protocolos experimentales diversosNo EverandPsicometría. Principios básicos y protocolos experimentales diversosAinda não há avaliações
- Ley de RaoultDocumento2 páginasLey de RaoultRodrigoAinda não há avaliações
- Teoría Del Gas Real: La Relación Exacta Para Gases RealesNo EverandTeoría Del Gas Real: La Relación Exacta Para Gases RealesAinda não há avaliações
- Ley de Raoult y HenryDocumento4 páginasLey de Raoult y HenrySofia Cabarcas100% (1)
- Ley de Raoult y HenryDocumento4 páginasLey de Raoult y HenryLuis BuelvasAinda não há avaliações
- Soluciones IdealesDocumento4 páginasSoluciones Idealesvicente alfonsoAinda não há avaliações
- El ambiente acuoso para el tratamiento de obras polìcromasNo EverandEl ambiente acuoso para el tratamiento de obras polìcromasAinda não há avaliações
- Ley de RaoultDocumento3 páginasLey de Raoultloah_123Ainda não há avaliações
- Ley de HenrryDocumento7 páginasLey de HenrryJhon ChavezAinda não há avaliações
- Disoluciones IdealesDocumento8 páginasDisoluciones IdealesMarjhory AylingAinda não há avaliações
- La FugacidadDocumento5 páginasLa FugacidadMaria Alejandra Narvaez Izaguirre83% (6)
- Ley de RaoultDocumento6 páginasLey de RaoultCarlos ValdezAinda não há avaliações
- Soluciones IdealesDocumento10 páginasSoluciones IdealesJazz OramasAinda não há avaliações
- Disoluciones IdealesDocumento9 páginasDisoluciones IdealesSteven Hicks100% (2)
- Disoluciones IdealesDocumento10 páginasDisoluciones IdealesCesar Augusto Torres LinaresAinda não há avaliações
- TermonoDocumento7 páginasTermonoKoki atencioAinda não há avaliações
- Rault y HenryDocumento4 páginasRault y HenryAlex CoquisAinda não há avaliações
- Disminución de La Presión de Vapor HaydeDocumento4 páginasDisminución de La Presión de Vapor HaydeHeidi MauAinda não há avaliações
- Ley de RaoultDocumento19 páginasLey de RaoultVictor NievesAinda não há avaliações
- Ley de RaoultDocumento16 páginasLey de RaoultMara ArellanoAinda não há avaliações
- Fisico Soluciones RealesDocumento26 páginasFisico Soluciones RealesAhilton SCAinda não há avaliações
- Conceptos de Propiedades de GasesDocumento7 páginasConceptos de Propiedades de GasesYariela CedeñoAinda não há avaliações
- Raoult RecopilacionDocumento22 páginasRaoult RecopilacionMaría Argomedo Reyes100% (1)
- Las Disoluciones Se Forman Cuando Las Fuerzas de Atracción Entre Las PartículasDocumento2 páginasLas Disoluciones Se Forman Cuando Las Fuerzas de Atracción Entre Las PartículasDiego MuñozAinda não há avaliações
- Previo PROPIEDADES COLIGATIVASDocumento6 páginasPrevio PROPIEDADES COLIGATIVASIván Gerardo López VenturaAinda não há avaliações
- Clase de Propiedades ColigativasDocumento20 páginasClase de Propiedades ColigativasAngelica CuadradoAinda não há avaliações
- GABINETE Nº 3 - Soluciones IdealesDocumento5 páginasGABINETE Nº 3 - Soluciones IdealesCamila HurtAinda não há avaliações
- Unidad 5Documento28 páginasUnidad 5Geozac Gamboa HoyosAinda não há avaliações
- Propiedades ColigativasDocumento20 páginasPropiedades ColigativasPatricia BusteloAinda não há avaliações
- Se Llaman Propiedades Coligativas A Aquellas Propiedades de Una Disolución Que Dependen Únicamente de La ConcentraciónDocumento4 páginasSe Llaman Propiedades Coligativas A Aquellas Propiedades de Una Disolución Que Dependen Únicamente de La ConcentraciónRoss Castiliansk MoralskeAinda não há avaliações
- Resumen Propiedades Coligativas de Las SolucionesDocumento9 páginasResumen Propiedades Coligativas de Las Solucionesarchivo_lcAinda não há avaliações
- Ley de Henry & Ley de RaoultDocumento10 páginasLey de Henry & Ley de RaoultAnonymous 6meMTlAinda não há avaliações
- Guia PcoligativasDocumento12 páginasGuia PcoligativasCamilo SilvaAinda não há avaliações
- Osmosis QuimicaDocumento11 páginasOsmosis Quimicapedrochuchu123Ainda não há avaliações
- Propiedades ColigativasDocumento12 páginasPropiedades ColigativasDenesis TejedaAinda não há avaliações
- Descenso Relativo de La Presión de Vapor FisicoDocumento2 páginasDescenso Relativo de La Presión de Vapor FisicomauriceAinda não há avaliações
- Propiedades Coligativas YetliDocumento9 páginasPropiedades Coligativas YetliTrujillo IlteyAinda não há avaliações
- Informe de FugacidadDocumento9 páginasInforme de FugacidadLuis MoreyAinda não há avaliações
- Propiedades Coligativas de Las SolucionesDocumento10 páginasPropiedades Coligativas de Las SolucionesxnixenAinda não há avaliações
- Destilacion FraccionadaDocumento6 páginasDestilacion FraccionadaDulce Wendolyn BollásAinda não há avaliações
- QUIMICA-UNIDAD 6 (Soluciones - SolubilidadDocumento18 páginasQUIMICA-UNIDAD 6 (Soluciones - SolubilidadAaron AlanizAinda não há avaliações
- Propiedades ColigativasDocumento19 páginasPropiedades ColigativasalorenarAinda não há avaliações
- Disoluciones y Sus PropiedadesDocumento13 páginasDisoluciones y Sus PropiedadesChristian Roldan PalaciosAinda não há avaliações
- Propiedades ColigativasDocumento10 páginasPropiedades ColigativasIvan ViteAinda não há avaliações
- Fugacidad y ActividadDocumento15 páginasFugacidad y ActividadOmar Diego ParraAinda não há avaliações
- Propiedades Coligativas de Las SolucionesDocumento5 páginasPropiedades Coligativas de Las SolucionesJaner Urango AnayaAinda não há avaliações
- Soluciones IdealesDocumento15 páginasSoluciones IdealesYeituko MendozaAinda não há avaliações
- Tema 6Documento61 páginasTema 6MARCOS SIMÓN RODRÍGUEZAinda não há avaliações
- Variación de La Presión de VaporDocumento13 páginasVariación de La Presión de VaporFannyEspinozaGiraldezAinda não há avaliações
- Propiedades ColigativasDocumento6 páginasPropiedades ColigativasTatiana LópezAinda não há avaliações
- Soluciones Ideales y No IdealesDocumento6 páginasSoluciones Ideales y No IdealesCristy López Rivas0% (1)
- Propiedad ColigativaDocumento1 páginaPropiedad ColigativaAna Sofia GarciaAinda não há avaliações
- La Ley de Raoult y HenryDocumento11 páginasLa Ley de Raoult y HenryCarlos SamaniegoAinda não há avaliações
- Termo 2 ExpoDocumento12 páginasTermo 2 ExpoADOLFO LOPEZ HERNANDEZAinda não há avaliações
- Cuestionario Equilibrio Liquido-GasDocumento3 páginasCuestionario Equilibrio Liquido-GasluisAinda não há avaliações
- Osmolaridad, Práctica Lab de FisiologíaDocumento3 páginasOsmolaridad, Práctica Lab de FisiologíaJaydy MestizoAinda não há avaliações
- Punto de Ebullición de Las SolucionesDocumento20 páginasPunto de Ebullición de Las SolucionesJacinto Hernández Cruz0% (1)
- Glosario N°5SolucionesDocumento13 páginasGlosario N°5SolucionesBoris Milton Mamani IchutaAinda não há avaliações
- Modelo de Examen - Gestion de CalidadDocumento18 páginasModelo de Examen - Gestion de CalidadFranklin SalasAinda não há avaliações
- Modelo de Examen - Gestion de ComunicacionDocumento22 páginasModelo de Examen - Gestion de ComunicacionFranklin Salas33% (3)
- Metodo de Ruta Critica - Ejemplo ADocumento11 páginasMetodo de Ruta Critica - Ejemplo AFranklin SalasAinda não há avaliações
- 4 Analisis TecnicoDocumento24 páginas4 Analisis TecnicoFranklin SalasAinda não há avaliações
- Acta de Constitución Del Proyecto (Urbe)Documento9 páginasActa de Constitución Del Proyecto (Urbe)Franklin SalasAinda não há avaliações
- Resumen Curriculum Vitae ActualizadoDocumento7 páginasResumen Curriculum Vitae ActualizadoFranklin SalasAinda não há avaliações
- Tipo de VálvulasDocumento10 páginasTipo de VálvulasFranklin SalasAinda não há avaliações
- Guia Tema 1 de Fermentacion en Estado SolidoDocumento23 páginasGuia Tema 1 de Fermentacion en Estado SolidoFranklin SalasAinda não há avaliações
- Empresas Que Producen Sal en VenezuelaDocumento6 páginasEmpresas Que Producen Sal en VenezuelaFranklin SalasAinda não há avaliações
- EQUILIBRIO QUÍMICO - CaicedoDocumento143 páginasEQUILIBRIO QUÍMICO - CaicedoYuri Jesus V.67% (12)
- Practica 1 INTRODUCCIÓN Y NORMAS GENERALES DEL LABORATORIO DE MICROBIOLOGIA GENERALDocumento4 páginasPractica 1 INTRODUCCIÓN Y NORMAS GENERALES DEL LABORATORIO DE MICROBIOLOGIA GENERALFranklin Salas100% (1)
- DIseno Del Programa de Dolor 20014Documento51 páginasDIseno Del Programa de Dolor 20014Franklin Salas0% (1)
- CARBOHIDRATOSDocumento4 páginasCARBOHIDRATOSFranklin SalasAinda não há avaliações
- Tecnología QuímicaDocumento6 páginasTecnología QuímicaFranklin SalasAinda não há avaliações
- Tema 5 Estado Metalico - Aleaciones - Metalurgia General (Documento)Documento10 páginasTema 5 Estado Metalico - Aleaciones - Metalurgia General (Documento)Franklin SalasAinda não há avaliações
- Tema 12 Ingenieria de Residuos SolidosDocumento28 páginasTema 12 Ingenieria de Residuos SolidosFranklin SalasAinda não há avaliações
- Tema 3 La Urea y Compuestos de Sodio y PotasioDocumento39 páginasTema 3 La Urea y Compuestos de Sodio y PotasioFranklin Salas100% (1)
- Hormigon 03. Materias PrimasDocumento15 páginasHormigon 03. Materias PrimasGino PascualliAinda não há avaliações
- Materiales de Laboratorio Rm09Documento24 páginasMateriales de Laboratorio Rm09danielAinda não há avaliações
- Cristalización 2018 ApunteDocumento22 páginasCristalización 2018 ApunteAntoAinda não há avaliações
- Tecnología IndustrialDocumento36 páginasTecnología IndustrialsamuelAinda não há avaliações
- El Átomo y Su EstructuraDocumento2 páginasEl Átomo y Su EstructuraJhoselin Zarela Zegarra PonteAinda não há avaliações
- 1 - Clase - Introducción A La ElectricidadDocumento18 páginas1 - Clase - Introducción A La ElectricidadAlex LopezAinda não há avaliações
- Gliceraldehído 3-FosfatoDocumento4 páginasGliceraldehído 3-FosfatoRonal Rojas PacherresAinda não há avaliações
- Manual Filtracin AnillasDocumento58 páginasManual Filtracin AnillasJJ CrAinda não há avaliações
- 33287089Documento0 página33287089richardruiz0391Ainda não há avaliações
- Fluidos Newtonianos y No NewtonianosDocumento20 páginasFluidos Newtonianos y No NewtonianosAlex Junior Durand OrdoñezAinda não há avaliações
- Actividad2 DavidMorales NRC6131.Documento8 páginasActividad2 DavidMorales NRC6131.David MoralesAinda não há avaliações
- Ecuacion de Nernst 16698 PDFDocumento27 páginasEcuacion de Nernst 16698 PDFAna Peralta SuchilAinda não há avaliações
- Practica 7Documento24 páginasPractica 7LuisThomsonAinda não há avaliações
- Tema 1: BioelementosDocumento4 páginasTema 1: Bioelementosfayza elhamriAinda não há avaliações
- 1 - Fisiología y Bioquímica Del Ejercicio. Sistemas EnergíaDocumento27 páginas1 - Fisiología y Bioquímica Del Ejercicio. Sistemas Energíamariano leiva0% (1)
- BioreactoresDocumento9 páginasBioreactoresStefany ZacquerAinda não há avaliações
- Bifenilos Policlorados Eva 2.0 CotoDocumento41 páginasBifenilos Policlorados Eva 2.0 CotoJose Herrera HuertaAinda não há avaliações
- Tintas FerrogalotanicasDocumento17 páginasTintas Ferrogalotanicasbolanos324Ainda não há avaliações
- El Beneficio de Los MineralesDocumento22 páginasEl Beneficio de Los MineralesGiordan Roger QB0% (1)
- Alcali SiliceDocumento8 páginasAlcali SiliceAaron AlvaradoAinda não há avaliações
- Ruisil RJS-201 (1000cs) TDS en EsDocumento1 páginaRuisil RJS-201 (1000cs) TDS en EsChemtools ChemtoolsAinda não há avaliações
- Precipitado 1 (Cristales)Documento21 páginasPrecipitado 1 (Cristales)Miguel MunozAinda não há avaliações
- CP 1 de Quimica GeneralDocumento9 páginasCP 1 de Quimica GeneralGregory YunesAinda não há avaliações
- Informe CementoDocumento25 páginasInforme CementoLuis EscobedoAinda não há avaliações
- Pegamento VultecboomDocumento4 páginasPegamento VultecboomDAvid Alvarez CastilloAinda não há avaliações
- Pin TurasDocumento54 páginasPin TurasRodrigo MuñozAinda não há avaliações
- Proyecto 1er ParcialDocumento10 páginasProyecto 1er ParcialmarcelaAinda não há avaliações
- Consumibles en La Soldadura Mig-MagDocumento43 páginasConsumibles en La Soldadura Mig-MagAnonymous tI6cgOO7NA100% (1)