Escolar Documentos
Profissional Documentos
Cultura Documentos
Princípios de Química Analítica - Exercícios de Volumetria
Enviado por
Jackie JohnsonTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Princípios de Química Analítica - Exercícios de Volumetria
Enviado por
Jackie JohnsonDireitos autorais:
Formatos disponíveis
PRINCPIOS DE QUMICA ANALTICA
TURMA A
2 SEMESTRE DE 2014
Profa. Valria R. Bellotto
Exerccios sobre Volumetria de Neutralizao
1) Na titulao de 50 mL de soluo de HCl 0,1000 N empregou-se uma soluo de NaOH
0,1000n e amarelo de metila (faixa de viragem pH 2,9-4,0) como indicador. Calcular o
erro relativo percentual cometido na titulao se o pH no ponto final foi 4,0.
pH no P.E=7,0 e Veq= 50 mL
para pH =4,0 calculo o volume gasto de titulante e verifico a diferena com o valor
esperado (calculado) = 50 mL. A partir disto calculo o erro relativo.
[H30+] = 10-4
pH= 4,0
o indicador tem ponto de viragem antes do ponto de equivalncia, portanto para o
calculo do volume de titulante uso a equao :
Ca =
() ()
10-4 =
(+)
(0,150) (0,1)
(50+)
5 0,1
10-4 = (50+)
10-4 (50 +Vb) = 5- 0,1 Vb
Vb= 49,90mL
Diferena (erro): 49,9-50= -0,1 mL
erro relativo : 50 mL 100%
-0,10 mL - X
X =-0,2%
2) Na titulao de 25 mL de soluo de cido actico (Ka= 1,8 x 10-5) com soluo 0,100 N
de NaOH. Empregou-se como indicador a timolftalena (faixa de viragem pH 8,3-10,5),
gastando-se 28,3 ml da soluo alcalina para viragem do indicador. Deseja-se saber:
(a) Qual o valor do pH no ponto de equivalncia
[Na+]=
0,128,3
53,3
= 0,05309 M
pH=7 + (pKa + log [Na+]
pH = 7,0 +1/2 (4,7447 + log 0,05309) pH = 8,86
(b) Com uso de outro indicador e o volume gasto da soluo alcalina 20,0 mL, qual
seria o pH do ponto de viragem do indicador?
Neste caso, estamos considerando que a concentrao do cido no conhecida,
pois no foi dada. Ento, consideramos que os 20 mL gastos correspondem ao
volume equivalente e o pH deve ser calculado como o pH do ponto de
equivalncia.
1/2
Ka x Kw
[H3O+]=
[Na+]
[Na+]=
0,120
45
[Na+]= 0,04444 M
1/2
[H3O+]
1,8 105 1014
=
0,04444
[H3O+] = 2x 10-9 M
pH= 8,70
(c) Qual o erro percentual relativo no caso do item b?
20- 28,9= - 8,9
28,9 -100%
8,9 X
X= 30,8% de erro
3) Em uma titulao de 50 mL de cido frmico (HCOOH) 0,0500M com KOH 0,100 M, o
erro de titulao deve ser menor que 0,05 mL. Que indicador pode ser utilizado para
atingir esta meta?
Devemos calcular o pH no ponto de equivalncia para escolher o indicador adequado
pH= 7 + (pKa + log [K+])1/2
sendo Ka = 1,8 x 10-4
Calculamos o volume equivalente terico: Ca x Va = Cb x Veq para calcular [K+]
50 x 0,05=0,100 x Veq
Veq= 25 mL
[K+]=
0,1 25
75
= 0,0333
Aplicando a equao acima: pH= 7+ 1/2 (3,74-1,48) pH= 8,13 portanto, o indicador
recomendado prpura de cresol (7,2 9,2) cuja faixa de viragem a que mais se
aproxima do pH do ponto de equivalncia, minimizando assim o erro do indicador.
4) Na titulao de 50 mL de MES ( cido 2 (N-morfolino) etanossulfnico 0,020 M (pKa=
6,27) foram gastos 10 mL de NaOH 0,100M e o pH no ponto de equivalncia
9,25.Suponha que voc utilize a transio de amarelo para azul (faixa de viragem pH
8,0-9,6) do indicador azul de timol para encontrar o ponto final. O ltimo vestgio de
verde desaparece prximo ao pH 9,6.
(a) Que volume de base necessrio para atingir o pH 9,6?
O volume de base utilizado para atingir este pH est alm do ponto de
equivalncia, assim usamos a seguinte equao:
[H3O+] =
[Na+] -Ca
2,51x 10-10 =
1014
(0,1 ) (50 0,020
50+
Vb= 10,024 mL
(b) Qual o erro do indicador?
Erro do indicador = 10,024 10 = 0,024 mL
5) Um cido fraco HA(pKa=5,0) foi titulado com uma soluo de KOH 1,0M. A soluo do
cido tinha um volume de 100mL e uma molaridade de 0,100M. Determine o pH para
cada um dos volumes adicionados de base que so dados a seguir, e faa o grfico de
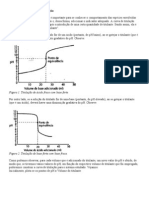
pH versus Vb. Vb= 0; 1; 5; 9; 9,9; 10; 10,1 e 12 mL.
pH = 3,0; 4,05; 5,00; 5,95; 7,00; 8,98; 10,96 e 12,25
Você também pode gostar
- Solução Tampão de Química AnalíticaDocumento3 páginasSolução Tampão de Química AnalíticaNeiliane Souza100% (1)
- Ficha de Avaliação BDocumento27 páginasFicha de Avaliação BSérgio Marques67% (3)
- Exerc+¡cio Resolvido (Dimesionamento)Documento5 páginasExerc+¡cio Resolvido (Dimesionamento)wevertonct80% (5)
- Cálculo do pH durante titulação de NaOH com HClDocumento23 páginasCálculo do pH durante titulação de NaOH com HClPassei Direto PDAinda não há avaliações
- Relatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoDocumento5 páginasRelatório Da Atividade Laboratorial 1.6 - Funcionamento de Um Sistema TampãoleonorAinda não há avaliações
- Exercícios de PortuguêsDocumento8 páginasExercícios de PortuguêsMarilene ShirasuAinda não há avaliações
- Autodepuração natural em cursos d'água: cálculos e curva (38Documento28 páginasAutodepuração natural em cursos d'água: cálculos e curva (38Tiago SantosAinda não há avaliações
- Tratamento de AguaDocumento9 páginasTratamento de AguaRodrigo Silva GonçalvesAinda não há avaliações
- Determinação do teor de NaOH em soda cáustica comercialDocumento6 páginasDeterminação do teor de NaOH em soda cáustica comercialSamuel AguiarAinda não há avaliações
- Rervisão 6° AnoDocumento2 páginasRervisão 6° AnoCemarDFAinda não há avaliações
- Lista de Exercà - Cios - Vol - Acido - BaseDocumento3 páginasLista de Exercà - Cios - Vol - Acido - BaseGEOVANA DE SOUZA ALMEIDAAinda não há avaliações
- Lista Química OrgânicaDocumento3 páginasLista Química OrgânicaWiliam ColenAinda não há avaliações
- QUI - 094 - Introdução à Análise QuímicaDocumento3 páginasQUI - 094 - Introdução à Análise QuímicaLaysa MaiaAinda não há avaliações
- QUI - 094 - Introdução à Análise QuímicaDocumento3 páginasQUI - 094 - Introdução à Análise QuímicaBruna FerreiraAinda não há avaliações
- Titulações Ácido-Base Texto 2023Documento14 páginasTitulações Ácido-Base Texto 2023Vinicius NogueiraAinda não há avaliações
- Lista de Exercà - Cios Volum ácido Base PDFDocumento6 páginasLista de Exercà - Cios Volum ácido Base PDFLaila QuaresmaAinda não há avaliações
- Padronização HCl Titulação Base ForteDocumento3 páginasPadronização HCl Titulação Base ForteBárbara Belchior MeloAinda não há avaliações
- Exercícios Química AnalíticaDocumento2 páginasExercícios Química AnalíticaglaAinda não há avaliações
- Lista 2 de Quimica Analitica Quantitativa I Quimica - Equilibrios e Titulacao de Neutralizacao 2023Documento3 páginasLista 2 de Quimica Analitica Quantitativa I Quimica - Equilibrios e Titulacao de Neutralizacao 2023paranziniAinda não há avaliações
- Titulação ácido-baseDocumento19 páginasTitulação ácido-baseEliana AlvarengaAinda não há avaliações
- Lista de Exercicios Volumetria Neutralizacao FINAL (1)Documento6 páginasLista de Exercicios Volumetria Neutralizacao FINAL (1)gabihsabaAinda não há avaliações
- Relatório de Química Analítica - Barbarah e ItaloDocumento7 páginasRelatório de Química Analítica - Barbarah e ItaloItalo SoaresAinda não há avaliações
- Curvas de titulação de ácidos e basesDocumento2 páginasCurvas de titulação de ácidos e basesRaul Cléverson50% (2)
- Exercícios de Química AnalíticaDocumento2 páginasExercícios de Química AnalíticaThiago DevilartAinda não há avaliações
- Exercícios de Química Analítica QuantitativaDocumento17 páginasExercícios de Química Analítica QuantitativaMaria Luísa M. Lira100% (1)
- Análises Quantitativas por Volumetria Ácido-BaseDocumento3 páginasAnálises Quantitativas por Volumetria Ácido-BasehugoAinda não há avaliações
- Determinação de cloreto em soroDocumento5 páginasDeterminação de cloreto em soroBruno Carvalho TulmannAinda não há avaliações
- UFRJ Química padronização HCl soluçãoDocumento6 páginasUFRJ Química padronização HCl soluçãoSamuel AguiarAinda não há avaliações
- Resolucao de Exercicios de Acido-BaseDocumento7 páginasResolucao de Exercicios de Acido-BaseviniciusmacielleiteAinda não há avaliações
- Resolucao de Exercicios de Acido-BaseDocumento7 páginasResolucao de Exercicios de Acido-BaseSara e JorgeAinda não há avaliações
- Exercícios Resolvidos Sobre TitulaçõesDocumento11 páginasExercícios Resolvidos Sobre TitulaçõesJosé Flávio Retkwa RetkwaAinda não há avaliações
- Analexp 2 - Experimento 4 - Ac. FosforicoDocumento6 páginasAnalexp 2 - Experimento 4 - Ac. FosforicoSamuel AguiarAinda não há avaliações
- Curva de Titulação de Ácido Forte Com Base ForteDocumento13 páginasCurva de Titulação de Ácido Forte Com Base ForteJulio GonçalvesAinda não há avaliações
- Exercicios de Quimica Analitica QuantitativaDocumento21 páginasExercicios de Quimica Analitica QuantitativaSabrina IsabelAinda não há avaliações
- Relatório Faculdade 28-06Documento6 páginasRelatório Faculdade 28-06Italo SoaresAinda não há avaliações
- Lista de Exercicios - 01 AnaliticaDocumento3 páginasLista de Exercicios - 01 AnaliticaVitorNoviicAinda não há avaliações
- Volumetria ácido-baseDocumento11 páginasVolumetria ácido-baseLourdes NascimentoAinda não há avaliações
- Exercícios de Química AnalíticaDocumento20 páginasExercícios de Química AnalíticaIsrael NarvastaAinda não há avaliações
- Titulometria Acido Base PDFDocumento20 páginasTitulometria Acido Base PDFRafaelAmorimAinda não há avaliações
- Volumetria ácido-base: exercícios de titulação e determinaçõesDocumento7 páginasVolumetria ácido-base: exercícios de titulação e determinaçõesPaulinha Paula PaulinoAinda não há avaliações
- Lista de QuimicaDocumento5 páginasLista de QuimicaLinniker Godoi0% (1)
- Química Analítica Qualitativa - ExercíciosDocumento3 páginasQuímica Analítica Qualitativa - ExercíciosAna Caroline FernandesAinda não há avaliações
- Lista de Analitca InternetDocumento4 páginasLista de Analitca InternetAbimael RodriguesAinda não há avaliações
- Construção Da Curva de TitulaçãoDocumento19 páginasConstrução Da Curva de TitulaçãoIgor Botelho De AlmeidaAinda não há avaliações
- Volumetria Acido-Base 16-04-2022Documento18 páginasVolumetria Acido-Base 16-04-2022Isadora Lima SilvaAinda não há avaliações
- Métodos e materiaisDocumento6 páginasMétodos e materiaisItalo SoaresAinda não há avaliações
- Potenciometria de NeutralizaçãoDocumento12 páginasPotenciometria de NeutralizaçãoFlavia MelloAinda não há avaliações
- Lista Exercícios Química AnalíticaDocumento1 páginaLista Exercícios Química AnalíticaliviasavignonAinda não há avaliações
- Lista de Exercicios 04 - Volumetria NeutralizaçãoDocumento2 páginasLista de Exercicios 04 - Volumetria NeutralizaçãoTed von EmmerichAinda não há avaliações
- Lista 01Documento2 páginasLista 01Adrielen Pereira RolinAinda não há avaliações
- Lista de Exercícios de Química Analítica IDocumento2 páginasLista de Exercícios de Química Analítica ICaroline BarrosoAinda não há avaliações
- Relatório AASDocumento9 páginasRelatório AASAna Luiza EmerencianoAinda não há avaliações
- Determinação do ácido acético em vinagre por titulometriaDocumento5 páginasDeterminação do ácido acético em vinagre por titulometriaCinthya Massene50% (2)
- Curvas de pH e determinação do ponto de neutralizaçãoDocumento15 páginasCurvas de pH e determinação do ponto de neutralizaçãoBruno ThomaziniAinda não há avaliações
- Lista - 4 - Titulacao Acido Base e PrecipitacaoDocumento8 páginasLista - 4 - Titulacao Acido Base e PrecipitacaoMaria Regina MagalhaesAinda não há avaliações
- Exercícios de Química Analítica para provaDocumento2 páginasExercícios de Química Analítica para provaIgor Rafael de OliveiraAinda não há avaliações
- Gama - Módulo 27 PDFDocumento22 páginasGama - Módulo 27 PDFThiago Magno Tavares MachadoAinda não há avaliações
- Lista de Exercícios - Análise Volumétrica - Farmácia (2017)Documento7 páginasLista de Exercícios - Análise Volumétrica - Farmácia (2017)Vitor ViegasAinda não há avaliações
- Projetos Com Esp8266 Programado Em Lua - Parte XxiNo EverandProjetos Com Esp8266 Programado Em Lua - Parte XxiAinda não há avaliações
- Enviando A Medição De Ph Para Monitoramento No Vc# Com A Stm8 Programada Em ArduinoNo EverandEnviando A Medição De Ph Para Monitoramento No Vc# Com A Stm8 Programada Em ArduinoAinda não há avaliações
- Enviando A Medição De Ph Para Monitoramento No Vb Com A Stm8 Programada Em ArduinoNo EverandEnviando A Medição De Ph Para Monitoramento No Vb Com A Stm8 Programada Em ArduinoAinda não há avaliações
- Sequestro de CarbonoDocumento10 páginasSequestro de CarbonojanicenoiteAinda não há avaliações
- Dimensionamento de sistema de esgotamento sanitário para alojamento provisório de 200 pessoas em Caeté-MGDocumento2 páginasDimensionamento de sistema de esgotamento sanitário para alojamento provisório de 200 pessoas em Caeté-MGPauloHenriqueAinda não há avaliações
- Aula4 NichoEcologicoDocumento30 páginasAula4 NichoEcologicoLucas ParzaniniAinda não há avaliações
- Manual para Formação e Capacitação de Grupos ComunitáriosDocumento50 páginasManual para Formação e Capacitação de Grupos ComunitáriosRaul JuniorAinda não há avaliações
- Catástrofes climáticas no Sistema Solar e evolução de MarteDocumento3 páginasCatástrofes climáticas no Sistema Solar e evolução de MarteSusana Lopes100% (1)
- Aula 1 Apresentação Disciplina MANEJO DE PLANTAS INVASORASDocumento16 páginasAula 1 Apresentação Disciplina MANEJO DE PLANTAS INVASORASAnny Karolyne Nonato100% (2)
- Exercícios Lixo EnemDocumento2 páginasExercícios Lixo EnemDaniella Galiza Gama LyraAinda não há avaliações
- Ebook Educação Ambiental Atividades PDFDocumento97 páginasEbook Educação Ambiental Atividades PDFDebora Navarrete100% (1)
- Cronograma de Execução de Reflorestamento Inajá 5Documento9 páginasCronograma de Execução de Reflorestamento Inajá 5Carlos Alberto Soares MonteiroAinda não há avaliações
- DEZ MUNICÍPIOS GAÚCHOS UNEM-SE PARA GESTÃO SUSTENTÁVEL DO LIXODocumento4 páginasDEZ MUNICÍPIOS GAÚCHOS UNEM-SE PARA GESTÃO SUSTENTÁVEL DO LIXOSuemi IseriAinda não há avaliações
- Resumo das 5 cartas de restauroDocumento2 páginasResumo das 5 cartas de restauroRicardo ParadaAinda não há avaliações
- NBR 9818 - 1987 - Projeto de Execucao de Piscina (Tanque E Area Circundante)Documento4 páginasNBR 9818 - 1987 - Projeto de Execucao de Piscina (Tanque E Area Circundante)rodrigo93_vgAinda não há avaliações
- Curso Engenharia Ambiental UVADocumento29 páginasCurso Engenharia Ambiental UVAThiago da Silva RibeiroAinda não há avaliações
- Impactos das mudanças climáticas na disponibilidade hídrica futura em bacia de abastecimento públicoDocumento9 páginasImpactos das mudanças climáticas na disponibilidade hídrica futura em bacia de abastecimento públicoKarinaAinda não há avaliações
- Lnec E471 2006 PDFDocumento7 páginasLnec E471 2006 PDFnmcarlosAinda não há avaliações
- ApresentacaoDocumento22 páginasApresentacaoSuzanaOliveiraAinda não há avaliações
- ExpPopMundialCresceSécXIXDocumento7 páginasExpPopMundialCresceSécXIXfilipe7553Ainda não há avaliações
- Aula 3 ETE Preliminar e ExercicioDocumento50 páginasAula 3 ETE Preliminar e ExercicioTony crossAinda não há avaliações
- Questionário Resíduos Sólidos 2012Documento5 páginasQuestionário Resíduos Sólidos 2012Daniel SoaresAinda não há avaliações
- Fossa Séptica e SumidouroDocumento5 páginasFossa Séptica e SumidouroRodrigo De Oliveira BicudoAinda não há avaliações
- APR Instalação de Linhas de 8 - Parte Elétrica - FinalDocumento13 páginasAPR Instalação de Linhas de 8 - Parte Elétrica - FinalAmauri MatosAinda não há avaliações
- Análise Hidrológica de Bacias e PrecipitaçãoDocumento4 páginasAnálise Hidrológica de Bacias e PrecipitaçãoEmanuely HoraAinda não há avaliações
- Modelo de Memorial Descritivo de EsgotoDocumento40 páginasModelo de Memorial Descritivo de EsgotoHudson SouzaAinda não há avaliações