Escolar Documentos
Profissional Documentos
Cultura Documentos
Estructura Del Supercomplejo de La Fosforilacion Oxidativa de La Mitocondria y Mecanismos para Su Estabilización
Enviado por
Javier Acuña0 notas0% acharam este documento útil (0 voto)
96 visualizações8 páginasbreve reseña del complejo de la fosforilación axidativa.
Título original
Estructura Del Supercomplejo de La Fosforilacion Oxidativa de La Mitocondria y Mecanismos Para Su Estabilización
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentobreve reseña del complejo de la fosforilación axidativa.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
96 visualizações8 páginasEstructura Del Supercomplejo de La Fosforilacion Oxidativa de La Mitocondria y Mecanismos para Su Estabilización
Enviado por
Javier Acuñabreve reseña del complejo de la fosforilación axidativa.
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 8
Estructura del supercomplejo de la fosforilacion oxidativa de la mitocondria y
mecanismos para su estabilizacin.
La fosforilacion oxidativa es la principal fuente de energa en clulas
eucariotas. Este proceso es realizado de manera q el electron se desliza entre
cuatro enzimas de las cuales tres son bombas de protones dentro de la
membrana interna mitocondrial. La energa acumulada en el gradiente de
protones dentro de la membrana es utilizado para la sntesis de ATP por la
fosforilacion oxidativa y sus cinco complejos de proteinas, ATP sintasa. Cuatro
de los complejos de protenas OXPHOS se asocian dentro de entes llamados
supercomplejo respiratorio. Esta revisin resume la via corriente de la cadena
de transporte de electrones en la cresta mitocondrial. El rol funcional de la
organizacin supramolecular del sistema OXPHOS y de los factores que
estabilizan aquella organizacin. Este articulo es parte de un numero especial
llamado Dinamica y ultraestructura de membranas bioenergticas y sus
componetes.
Introduccion.
La mitocondria juega un numero vital de roles en la celula eucariota, las mas
importante es la produccin de ATP durante la fosforilacion oxidativa. Las
membranas densas de la mitocondria llamadas crestas acomodan muchas
copias de los componentes de la cadena respiratoria o el complejo OXPHOS (IIV) juntos con la ATP sintasa (complejo V) q forman la maquinaria para la
produccio de ATP (la moneda de energa de la celula). Los complejos I-IV son
multisubunidades de enzimas que trabajan en conjunto para crear un gradiente
electroqumico de protones a travs de la membrana que es usado por F1F0
ATP sintasa que produce ATP en la via de la fosforilacion oxidativa, aunque el
complejo II no es directamente habilitado para expulsar protones.
El NADH o succinato generado durante la glicolisis, en la oxidacin de acidos
grasos y en el ciclo de acido ctrico forman el combustible para la cadena
respiratoria. Durante la catlisis hay transferencia de electrones entre el
complejo de proteinas mediado por dos pequeos componente: ubiquinona
(lposoluble) y citocromo c (hidrosoluble). Estos se difunden entre los
complejos de la respiracin I y III y entre III y IV respectivamente y luego los
toma para formar agua.
Para entender el nivel molecular de la fosforilacion oxidativa es importante
conocer los complejos proteicos individualmente.
Complejo I o NADH deshidrogenasa es la enzima mas larga de la cadena de
transporte de electrones se caracteriza por estar en forma (-L-) con una parte
extensiva envuelta en la bicapa lipdica y un brazo pequeo en la matriz
mitocondrial. Los estudios con rayos x sugiere que en el complejo I liga el
substrato de NADH al final del brazo hidrofillico y transfiere dos electrones uno
al tiempo, la via de la FMN y los grupos de siete enlaces Fe-S limitan la
ubiquinona en la interface entre dos brazos. La reduccin de ubiquinona induce
cambios conformacionales en el lado de la membrana dando como resultado
en la translocacin de cuatro protones a travs de la membrana en la via de
cuatro canales.
Complejo II o Succinato deshidrogenasa es el segundo punto de entrada de
electrones de la cadena respiratoria, oxida al succinato y transfiere electrones
mediante tres grupos Fe-S a la Ubiquinona . Este complejo no es una bomba de
protones y no contribuye directamente en la formacin de gradientes de
protones.
Complejo III o Citocromo c oxidoreductasa el cual es conocido q existe en la
membrana como un dimero, oxida la ubiquinona a ubiquinol y como resultado
puede empujar dos protones al espacio intermembranal de la mitocondria. Los
electrones del ubiquinol pasa al citocromo por la via del citocromo b y C1 del
complejo III.
Complejo IV o Citocromo c oxidasa, acepta electrones del citocromo c y los
entrega a la molecula de oxigeno para q se convierta en dos molculas de
agua. Cuatro protones son empujados al espacio intermembranal durante este
proceso.
Complejo V o ATP sintasa usa la energa almacenada en el gradiente de
protones para convertir ADP en ATP, este complejo esta formado por 15-18
subunidades. La parte hidrosoluble consiste en tres subunidades catalticas alfa
y tres beta
Organizacin supramolecular de la cadena respiratoria.
Hermann Schgger y colegas caracterizaron la organizacin del sistema de la
fosforilacion oxidativa con la electroforesis del gel azul-nativo poliacrilamida
(BN-PAGE), esta se basa en la moderada solubilizacin de membranas
mitocondriales con detergentes no inicos y se permite la separacin de los
largos y estables complejos de protenas que quede. Esta tcnica permitio la
separacin del supercomplejo respiratorio en geles y marco el inicio del
estudio en un alto nivel de la organizacin estructural de la fosforilacion
oxidativa. El anlisis de una simple particula provee la primera evidencia
estructural para el supercomplejo respiratorio, en las ultimas dos dcadas el
BN-PAGE y otras tcnicas bioqumicas han desencadenado un cambio en la
vista de la organizacin de la cadena de transporte de electrones en la
membrana mitocondrial. La idea de difusin al azar de los complejos en la
cresta fue dada en varios experimentos.
El supercomplejo respiratorio ha sido encontrado en organismos q pertencen a
diferentes reinos de eucariotas, a pesar de las distancias filogenticas de cada
uno todos ellos tienen en comn que su sistema de fosforilacion oxidativa tiene
una organizacin supramolecular. Basados en la composicin todos los
supercomplejos pueden ser divididos dentro de cuatro grupos principales . el
complejo I, III2 y IV fueron hallados para ensamblarse dentro de los complejos
I+III2, III2+IV1-2 o I+III2+IV1-4. La ATP sintasa forma dimeros los cuales
constituye cadenas oligomericas en las estas, el complejo II es la nica enzima
de la cadena respiratoria que no se asocia con otras proteinas del complejo
respiratorio. Aunque Acin-Perez reporta que el complejo II hace parte en la
respiracin del raton, y este complejo permite transferir electrones de
succinato aunque no tuv estudios q hicieren soporte a esta deduccin. El
succinato deshidrogenasa partcipa en el ciclo del acido ctrico, esto puede
explicar por qu el complejo II no se encuentra como parte del supercomplejo
respiratorio. Un estudio revela que el electron q fluye del sustrato FAD al
complejo III es independiente del camino del electron q se origina del NAD+ y
toma lugar dentro del complejo I+III2. Estos dos caminos usan dos diferentes
grupos de quinona.
La abundancia de los supercomplejos con diferentes composiciones varian de
organismo en organismo. Asi el supercomplejo con composicin I+III2+IV1-4 es
abundante en mamferos, I+III2 es abundante en plantas, III2+IVv en fungi.
Estudios estructurales de membranas mitocondriales revelan conjuntos de
sistemas de la fosforilacion oxidativa insitu, el microscopio electrnico provee
la primera demostracin de filas oligomericas de dimeros ATP sintasa en la
mitocondria de un paramecioen 1989. Este trabajo tambin sugiere que hay
conjuntos lineales ordenados del complejo I en las crestas. Con el surgimiento
de la tomografa de cryo-electrones se da un ascenso al estudio de la
organizacin supramolecular de la cadena de respiracin en las crestas y
mitocondria intacta sin usar ningn fijador que permite la visualizacin de
macromolculas individuales. Un numero amplio de cryo-electrones han
demostrado la existencia de cadenas oligomericas de ATP sintasa en la cresta
mitocondrial de varios organismos. Resultados de estos experimentos
sugierern diferentes soluciones a las enzimas respiratorias en mitocondrias
tubulares y laminares.
Filas ilogomericas de ATP sintasas fueron encontradas a lo largo de los bordes
de las crestas, mientras el complejo I-IV podran circular en la superficie de la
cresta. En contraste la cresta tubular de la alga verde esta completamente
cubierta de filas oligomericas de ATPsintasa, surgiriendo que las otras enzimas
de la fosforilacion pueden estar incluidas en el medio, pero esto no puede ser
visualizado por el ajustado enganche de la ATPsintasa, en otras especies como
los bovinos es muy difcil poder observar filas oligomericas de ATPsintasa.
Significado de el supercomplejo de la fosforilacion (OXPHOS).
El estudio estructural del supercomplejo del OXPHOS es de especial
importancia para entender la funcin de la cadena del complejo respiratorio,
enfermedades y desordenes mitocondriales como Parkinson o Alzheimer estn
asociado con genes que codifica proteinas para OXPHOS. En adicion la
disfuncion mitocondrial apunta ser un factor en la etiologa del cncer.
Mutaciones en el DNA mitocondrial o nuclear que afectan los componentes del
sistema mitocondrial OXPHOS resulta en especies aerobias promoviendon la
proliferacin de tumores celulares. Ademas modificaciones en los niveles del
reactivo de oxigeno de especies han estado ligadas a la resistencia del cncer
en la quimioterapia. Por lo tanto el sistema OXPHOS parece ser una atractiva
droga en el tratamiento del cncer y de las enfermedades asociadas al
cncer. Entendiendo la organizacin supramolecular del OXPHOS y de su rol en
el funcionamiento de la cadena respiratoria es esencial para el desarrollo de
dicho tratamiento.
Supercomplejo Respiratorio.
Complejo I, III2 y IV forman tres tipos de suprcomplejos , una copia del
complejo I puede asociarse con el complejo dimerico III de la forma
supercomplejo I+III2 el cual es principalmente enconrtrado en plantas. El
microscopio de electrones revela q el complejo III2 es lateralmente conectado a
la membrana en la porcin cncava del complejo I, en algunos organismos el
complejo III2 fue encontrado en asociacin con uno o dos copias del complejo
IV. La III2+IV1-2 es el mas estable en Saccharomyces cerevisiae, la cual carece
de NADH deshidrogenasa. En la solubilisacion con detergentes no se encuentra
complejo IV ni dimerico ni monomerico libre, con lo que se deduce que todo el
complejo IV hace parte del supercomplejo. El detallado anlisis del microscopio
electrnico revela que el complejo III2 esta adherido por ambos lados del
complejo monomrico IV, este estudio establece que el complejo Iv no es un
dimero funcional como previamente se propuso en los experimentos de
cristalizacin. Un modelo pseudo-atomico en 3D muestra que el citocromo c
oxidasa monomrico esta adjunto al succinato deshidrogenasa dimerico en dos
alternaticos lados con sus lados convexos dando cara al complejo III2.
El supercomplejo sistema de cadena respiratoria es dormado por I, III3 y cuatro
copias de IV, era llamado respirasoma porque creaba la masa de protones en la
presencia del citocromo c y de la quinona en una unidad. Recientemente la
estructura del respirasoma bovino fue determinado por dos mtodos diferentes
de Microscopio Electrnico el cryo-ET y el cryo-EM , ambos mtodos dan
estructuras compatibles y demuestran que el complejo III2 esta en el arco de la
membrana con el Complejo I, mientras que el complejo IV es adherido al
extremo de la NADH deshidrogenasa. Conexiones de rayos X muestra q
estructuras del complejo III2 y IV tienen sitios de interaccion de complejos III2
y IV difieren de S. cerevisiae pero en ambos (levaduras y bovinos) modelos del
complejo IV, la interfase de dimerizacin es libre. Las diferencias entre la
organizacin de los respirasomas bovinos y de levaduras puede ser explicado
en la necesidad del complejo III de interaccionar con los complejos I y IV en
mitocondria de mamferos. Sin embargo aunque se tome en cuenta la
interaccion entre los complejos I y III2 en bovinos, no hay un restriccin
espacial dentro de los respirasomas bovinos para el complejo III2 y IV de
interactuar en la misma via como en S. cerevisiae. Otra posible explicacin
puede ser la cadena de asociacin entre el complejo I+III2+IV y la via IV
hipotticamente de fragmentos de la cadena de respiracin resueltos en el gel
azul-nativo, recientes trabajos en el Paramecium sugiere de la posible
organizacin supramolecular de el complejo I pero esto se excluye en estudios
con cryo-ET.
Factores estabilizadores para el Respirasoma
En varios organismos los respirasomas aparentan ser muy estables porq estos
no pueden ser aislados como partculas totales sin una degradacin
significante, en los ltimos aos una mano de esfuerzos han sido puesta en
busca de factores q son responsables por adherir conjuntamente los
compomnentes del respirasome. La Cardiolipina es un fosfolpido anionico
formado por dos grupos fosfatidil unidos a un glicerol, es exclusivamente
encontrado en la membrana interna mitocondrial donde uno de sus mayores
acciones es la interaccion especifica con proteinas y modular sus funciones.
Los mapas cryo-EM de respirasomas de levaduras y de bovinos claramente
sealan que el complejo I, III2 y IV estn en alguna distancia dentro del
supercomplejo en la bicapa lipdica y los esapcios entre los complejos aparecen
con baja densidad material en los mapas en el microscopio electrnico. Asi que
este espacio por lo general es lleno de lpidos, como se mostr previamente
que la Cardiolipina es requerida para estabilizar los complejos III y IV y la
formacin estable del supercomplejo III2+IV2. Un contenido aproximado de 50
molculas de cardiolipinas por levadura fue determinado por un anlisis de
masa espectofometrico. Debido a largas distancias entre los complejos el
respirasoma bovino puede potencialmente acomodar varias veces molculas
de Cardiolipina.
Algunas veces los lpidos co-cristalizan con complejos de protena de
membrana, en la estructura del cristal del complejo IV de bovino una molecula
de Cardiolipina fue identificada como subunidad III, la cual es la interface con el
complejo III en el respirasoma del bovino en la estructura del microscopio
electrnico, pero no en el respirasoma de la levadura. Sin embargo fotos de
experimentos sugieren que la Cardiolipina fue adherida entre subunidades VIIa
y VIIc, la cual es bastante interactiv con el complejo III en el respirasoma de la
levadura. Varias molculas de lpidos fueron encontradas para ser asociadas
con el complejo III2 de la levadura. la Cardiolipina esta unida en una hendidura
hidrofbica en la superficie de contacto entre el citocromo b y el c1, estos
representan en la levadura el complemento IV, pero no en el respirasoma
bovino. Sin embargo la simulacin de las dinmicas moleculares identifican tres
sitios de ligandos adicionales para la Cardiolipina, los cuales pueden estar
implicados en la interaccion. Los autores sugieren que los complejos; primero
forman un encuentro de supercomplejo por la interaccion de la Cardiolipina
ligando sitios. Seguido de esto pequeos y despacios arreglos en la orientacin
relativa de estas proteinas puede ocurrir junto con la descarga de cardiolipinas
de los sitios de unin, por masas espectrofotomtricas se encontr ocho y dos
molculas de Cardiolipina asociadas con el complejo III y IV, respectivamente.
Ademas de los lpidos, la subunidad VIIa del citocromo c oxidasa y proteinas
ajenas a la cadena de respiracin fueron mostradas en la accin de la
estabilidad de los respirasomas. El polipptido de la subunidad VIIa del
citocromo c oxidasa (Cox7-a21) fue identificado en el respirasoma y en el
supercomplejo III2+IV del respirasoma de los fibroblastos enratones, pero no
en complejos libres III o IV. En la ausencia de Cox7-a21 el complejo IV no se
ensambla en los supercomplejos pensando q el electron fluy por substratos que
no lo afectan. Los electrones pasaran a traves de una simle piscina de
citocromo c a una simple piscina del complejo IV. La subunidad del citocromo c
oxidasa (COX7RP) fue tambin identificada como un factor q promueve el
ensamblaje del suplecomplejo.
La abundante isoforma de transportadores ADP/ATP (Aac2) el cual facilita el
intercambio de ADP y ATP a traves de la membrana interna mitocondrial fue
encontrado en asociacin con el complejo III2+IV1-2 y fue mostrado que este
requiere Cardiolipina para su propio funcionamiento. Dos novedosas y
pequeas proteinas ; Rcf1(respiratory supercomplex factor 1)y Rcf2
(respiratory supercomplex factor 2) asociadas separadamente con el
respirasoma y fue demostrado su importancia para la estabilidad del
respirasoma en levaduras. Rcf1 interacciona con sununidad Cox3 del complejo
IV y su requerimiento para el propio ensamble y funcionamiento del
supercomplejo, Rcf1 fue encontrada estando cerca a Aac2. Rcf2 puede ser
encontrada especficamente en levaduras, mientras Rcf1 tiene homologos
humanos RCF1a y RCF1b, amnas proteinas estn encontradas en asociacin
con el complej IV y Rcf1 juega un papel crucial en la estabilidad del
supercomplejo. Estructuras en alta resolucin de los respirasomas pueden
ayudar a asignar las posiciones de estos nuevos componentes en el
supercomplejo.
Un estudio reciente de la relacin entre la respiracin de la mitocondria y las
crestas ultraestructurales sugieren que la morfologa de la cresta juega un rol
en la estabilizacin para el supercomplejo respiratorio en monos.
Funcin de los respirasomas.
En la cadena respiratoria todas las enzimas estn unidas por el intercambio de
electrones. La ubiquinona fisiolgicamente interconectan el complejo I y III
aceptando electrones del primero y entregndoselos al siguiente. Es conocido
que el superoxido mitocondrial nocivo se origina en el complejo I y III. Estos
complejos estn ensamblados dentro del respirasoma tal q la ubiquinona liga
sitios en el rspirasoma bovino. Pequeos movimientos de ubiquinona hacen
sensibilizar no solo en aumentar la velocidad en la que se da la transferencia
de electrones sino q minimiza la duracin de la transferencia de electrones en
la produccin de radicales de oxigeno daosos. Otro punto crucial en la via
electrnica del OXPHOS es trasnpotando el citocromo c entre los complejos III y
IV el cual es variable en cada tipo de especie. Asi la formacin del respirasoma
trae estos sitios cerca a cada uno y es intentado el hacer transferencias mas
eficientes que si el complejo III y IV fueran distribuidos al azar en la membrana.
Sin embargo es cuestionable si la distancia entre los componentes de los
transportadores de electrones son la principal razn de la formacin del
supercomplejo.
Datos soportan la idea q los canales de sustrato no son la razn principal para
la formacin de los respirasomas, adems los canales de sustrato fueron
encontrados entre la via de la ubiquinona de los complejos I y III de los bovinos.
Un estudio reciente de flujo de electrones en el sistema OXPHOS apunta a
separar las vas en el ETC dependiente de la presencia del factor de
ensamblaje Cox7A21, el complejo IV puede recibir electrones de cualquiera de
los sustratos NADH y via del supercomplejo I+III2/I+III2+IV, de la via FAD del
complejo II, del nico complejo III2 y IV/III2 + IV o da ambos NADH y FAD. Dicha
organizacin de la cadena respiratoria puede ser esencial para optimizar la
oxidacin simultanea de multiples sustratos. En efecto el ratio entre electrones
venientes de NADH y FAD es alto cuando la glucosa es el principal sustrato
para la respiracin y es bajo cuando la oxidacin de acidos grasos ocupa este
lugar. Por lo tanto la dinmica de la organizacin supramolecular de el ETC
puede ser esencial para la oxidacin eficiente de sustratos disponibles.
Otra pregunta intrigante es como la presencia de cantidades significantes de
lpidos entre los complejos simples es consistente con la eficiencia general de
la transferencia de electrones. Sob los lpidos ltimamente requeridos para la
estabilidad del supercomplejo o es su presencia un prerrequisto para el cambio
de ubiquinona?. Basados en hallazgos del flujo de electrones del FAD al
complejo III es independiente de la via q usan los electrones del NAD+ dentro
del complejo I+III2/I + III2+IV. Se propone que el espacio limitado para lpidos
entre el complejo I y III puede servir como un microdominio de difusin para la
ubiquinona, confinndose en el supercomplejo I+III2/I + III2+IV. Un mecanismo
similar fue sugerido para la plastoquinona en los cloroplastos.
Entre otras posibles funciones el supercomplejo puede tener un rol en
ensamblaje de sus componentes. Mutaciones en subunidades del complejo III o
IV destabiliza el complejo I de clulas de raton y humano y el complejo I es
necesario para el ensamble completo del complejo III en clulas humanas.
ATP sintasa dimrica.
La primera evidencia bioqumica de la organizacin dimrica del ATP sintasa en
levaduras viene del BN-PAGE trabajado por Arnold y colegas, luego los dimeros
fueron encontrados en bovinos y otros organismos, la dimerizacin de las ATP
sintasas visualiza ser una caracterstica de la mitocondria, porque no hay
evidencia todava obtenidas que suponga la existencia de dmeros en
membranas bacteriales. Informacion estructural acerca del ATP sintasa
dimrico viene de una imagen obtenida del microscopio electrnico de
proteinas solubilizadas en detergentes. Los siguientes mtodos proveen
directamente una vista de la organizacin supramolecular de molculas de
membrana pero con resolucin baja de partculas simples reconstruidas. Bajas
resoluciones de estructuras de ATP sintasa dimrico fueron obtenido de amplia
variedad de eucariotas, ninguno de ellos comparte ultraestructuras similares
del ATP sintasa dimrico en sus mitocondrias.
Multiples estudios sugieren q el ATP sintasa dimrico esta estabilizado por
interacciones protena - protena. Bastante esfuerzo se puso en la identificacin
de las protenas envueltas en el monmero- monmero de la superficie dentro
del ATP sintasa monomrico de varios organismos.
Você também pode gostar
- A. Homeostasis Autocontrol BiofisicaDocumento45 páginasA. Homeostasis Autocontrol BiofisicaJavier AcuñaAinda não há avaliações
- Agosto 3, 2009 Lunes S - Ntesis de Prote - NasDocumento12 páginasAgosto 3, 2009 Lunes S - Ntesis de Prote - NasJavier AcuñaAinda não há avaliações
- Agricultura AsociativaDocumento7 páginasAgricultura AsociativaJavier AcuñaAinda não há avaliações
- Las Membranas Biológicas y TransporteDocumento33 páginasLas Membranas Biológicas y TransporteJavier AcuñaAinda não há avaliações
- 3 INFORME Producciones Ovina y BovinaDocumento11 páginas3 INFORME Producciones Ovina y BovinaJavier AcuñaAinda não há avaliações
- La Organización de Las CélulasDocumento15 páginasLa Organización de Las CélulasJavier AcuñaAinda não há avaliações
- Huevos de Gallina CriollosDocumento3 páginasHuevos de Gallina CriollosJavier AcuñaAinda não há avaliações
- GallinasDocumento61 páginasGallinasSergio Andres Aparicio GalvisAinda não há avaliações
- B8 A4 FD 01Documento62 páginasB8 A4 FD 01Marco Saez MurilloAinda não há avaliações
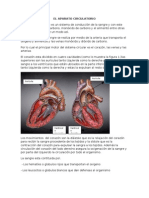
- El Aparato CirculatorioDocumento2 páginasEl Aparato CirculatorioJavier AcuñaAinda não há avaliações
- Guia 1 - Introduccion - pdfeXCELDocumento12 páginasGuia 1 - Introduccion - pdfeXCELSerena TaylorAinda não há avaliações
- Histologia Arterias Venas y CapilaresDocumento45 páginasHistologia Arterias Venas y CapilaresJorge Bautistad100% (3)
- Documento Teórico ... Ciclo de KrebsDocumento6 páginasDocumento Teórico ... Ciclo de KrebsandreinaAinda não há avaliações
- P 1 Presion USMP 2021Documento80 páginasP 1 Presion USMP 2021Erika Ruiz TorresAinda não há avaliações
- TAREA 02 SIST - CIRCULATORIO Sem 02Documento2 páginasTAREA 02 SIST - CIRCULATORIO Sem 02Milagros HidalgoAinda não há avaliações
- Ciclo KerbsDocumento3 páginasCiclo KerbsAllan Kun DamasAinda não há avaliações
- Actividad 1 y 2 de La Semana 12 - Gianfranco Talavera GutierrezDocumento5 páginasActividad 1 y 2 de La Semana 12 - Gianfranco Talavera GutierrezGIANFRANCO TALAVERA GUTIERREZAinda não há avaliações
- C - S - I - Son Nesesarias Las Plantas para VivirDocumento5 páginasC - S - I - Son Nesesarias Las Plantas para VivirFabiola Mena EspinozaAinda não há avaliações
- Cuadro ComparativoDocumento3 páginasCuadro ComparativoAstrid Ramirez OrozcoAinda não há avaliações
- Sistema CirculatorioDocumento71 páginasSistema CirculatorioNilLeninPalaciosCamacho100% (1)
- Sistema CirculatorioDocumento2 páginasSistema CirculatorioChristian LinaresAinda não há avaliações
- Cadena Transportadora de ElectronesDocumento5 páginasCadena Transportadora de ElectronesAmadaGarciaYepezAinda não há avaliações
- PRÁCTICA No 6. 06 - 2023 Procesos RespiratoriosDocumento17 páginasPRÁCTICA No 6. 06 - 2023 Procesos RespiratorioslpalacioscaAinda não há avaliações
- Mitocondrias y Respiracion CelualrDocumento31 páginasMitocondrias y Respiracion Celualrwilliams rolando huaraca pomaAinda não há avaliações
- Tarea BenryDocumento3 páginasTarea Benryhenry Miranda ArteagaAinda não há avaliações
- Ac17 MedulaDocumento18 páginasAc17 Medulajuan peres peresAinda não há avaliações
- Tema 15 Cadena Respiratoria. Autor Alexander Sanchez Lamas.Documento15 páginasTema 15 Cadena Respiratoria. Autor Alexander Sanchez Lamas.Alexander SanchezAinda não há avaliações
- Circulacion MenorDocumento1 páginaCirculacion MenorYeny LermaAinda não há avaliações
- Informe de Laboratorio 7Documento6 páginasInforme de Laboratorio 7SthefiiEnriquezAinda não há avaliações
- Informe de Laboratorio N°9Documento7 páginasInforme de Laboratorio N°9JuniorAinda não há avaliações
- 4 Biotransformacion de La EnergíaDocumento4 páginas4 Biotransformacion de La EnergíaErick Keyser Abanto VillarrealAinda não há avaliações
- Anatomia y Fisiologia Del CorazonDocumento26 páginasAnatomia y Fisiologia Del CorazonJonathan Andres Franco SánchezAinda não há avaliações
- Taller, BiologíaDocumento18 páginasTaller, BiologíaAdrian CorredorAinda não há avaliações
- Ciclo CardiacoDocumento3 páginasCiclo CardiacoFranliz ZambranoAinda não há avaliações
- Cadena Transportadora de ElectronesDocumento12 páginasCadena Transportadora de ElectronesReinaldo Bajo100% (1)
- Tema 17. CatabolismoDocumento80 páginasTema 17. CatabolismoPepito GrilloAinda não há avaliações
- 6 Sistema de Conducción Del CorazónDocumento2 páginas6 Sistema de Conducción Del CorazónMildred YamilethAinda não há avaliações
- Angela Herrera MDocumento6 páginasAngela Herrera MYubraska Marquez HurtadoAinda não há avaliações
- Continuum Energetico en NatacionDocumento22 páginasContinuum Energetico en NatacionMiguel Padilla100% (2)
- Aparato Cardiovascular para Cuarto de Primaria PDFDocumento4 páginasAparato Cardiovascular para Cuarto de Primaria PDFCindy Correa Rangel100% (1)
- Gluconeogenesis PDFDocumento26 páginasGluconeogenesis PDFVerónica PovedaAinda não há avaliações