Escolar Documentos
Profissional Documentos
Cultura Documentos
Thermo
Enviado por
YasseerRajDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Thermo
Enviado por
YasseerRajDireitos autorais:
Formatos disponíveis
Universit Paris 7- Denis Diderot
Licence Sciences et Applications
Niveau L3 / S5 Filires Chimie et SPE
Module de thermodynamique avance 34 U3 TH35
Anne Universitaire 2013-2014
CHIMIE
Travaux Dirigs
Srie n 3 : Grandeurs molaires partielles
CORRIG
I
(10-2011) Lorsquune mole d'eau est ajoute un gros excs de solution
[eau + mthanol ] de titre x1 = 0,4 en mthanol , le volume de la solution est
accru de 17,35 cm3. Lorsquune mole de mthanol est ajoute la mme
solution, le volume s'accrot de 39,00 cm3.
Rsum de l'nonc :
1 mol H2O
1 mol H2O
vide
+
V= 17,35 cm3
Grd vol de sln
x1(MeOH) = 0,4
x2(H2O) = 0,6
Grd vol de sln
x1(MeOH) = 0,4
x2(H2O) = 0,6
De mme avec une mole de mthanol : V : 39,00 cm3
Calculer le volume d'une solution renfermant 0,4 mole (12,82 g) de
mthanol et 0,6 mole (10,8 g) d'eau.
Rappel de la thorie : pour une solution : V = n
= nV ,
, , ,
Vm,i est le volume molaire partiel du constituant i
Dans notre cas : V = n Vm,eau + n
Vm,MeOH
o les Vm,i = f(xi)
Si 1 mole de solution au total : Vm,sln = x Vm,eau + x
Vm,MeOH
Pour la solution prpare : x
= 0,4
Avant mlange de l'eau et de l'alcool : le volume total des constituants spars
est gal : V = n V ,
+n
. V ,
Aprs mlange : volume de la solution :
V1 = n V , ,
V ,
, +n
,
,
Aprs l'ajout d'une mole de MeOH, volume de la solution :
V =n
+ (n
+ 1) V
Variation de volume :
3
V = V - V1 = 1 V ,
,
, = 39,00 cm
De mme si ajout d'une mole d'eau V1:
3
V = V! - V1 = 1 V , ,
, = 17,35 cm
On a donc les volumes molaires partiels des 2 constituants du systme binaire.
On va pouvoir dduire le volume demand, qui est en fait le volume molaire du
mlange puisque la somme des effectifs est gale 1:
Vm,sln = (x V , ,
V ,
, ) + (x
,
, )
= ( 0,6
17,35)
+
( 0,4
39,00)
= (10,41)
+
(15.6)
3
= 26,01 cm .(mol de sln si mlange)-1
Ce volume est le "volume du mlange"
valuer la contraction due au mlange (volumes molaires du mthanol et de
l'eau purs = 40,5 et 18,0 cm3.mol-1 respectivement).
Si les volumes molaires partiels avaient t gaux aux volumes des constituants
purs (sln idale), on aurait eu :
+n
. V ,
V = n V ,
Si au total une mole de constituants spars:
V = x V ,
+x
. V ,
= ( 0,6 18,0) + ( 0,4 40,5)
=
(10,8)
+
(16,2)
3
= 27,00 cm .(mol de liq non mlangs)-1
La variation est donc gale : V = Vm,sln - V = 26,01 27,00 = - 0,99 cm3
Il y a donc eu contraction de 0,99 cm3
c.a.d
= 4%
!"
Ce volume est le "volume de mlange"
Fin du TD n5
II
Un barman corrompu essaye de prparer pour ses clients 100 cm3 de
"vodka" en mlangeant 40 cm3 d'thanol et 60 cm3 d'eau.
1) Obtient-il le volume dsir ?
Donnes :
a) Masses molaires (en g.mol-1) : M $ = 18,0
M%& = 46,1
-3
b) Masse volumique (en g.cm ) :
= 1,00
%& = 0,785
$
c) Les volumes molaires de chacun des constituants mlangs(en cm3.mol-1)
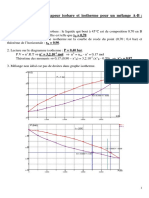
seront dtermins sur le diagramme '(,) = f(xi))
Le barman ignore que 40 cm3 d'EtOH + 60 cm3 d'eau ne donnent pas 100 cm3 de solution; il y
a un "volume de mlange", qui fait que le "volume du mlange" sera infrieur 100 cm3 .
Le volume d'un mlange de i constituants est modlis par la relation : V = n . V
Pour dterminer les volumes molaires partiels de chacun des constituants sur le graphe, il va
donc falloir dterminer les effectifs et en dduire les fractions molaires:
Dans 60 cm3 d'eau pure , il y a : n
Or : V ,
2 3
+$ ,
+ ,
$
+$ , -./0
1,+$ , -./0
= 18,0 cm3.mol-1
De mme dans 40 cm d'alcool pur, il y a : n%&
3
Or : V ,%&
Donc : n
2 3
9 :
4, 9 : ;<=>
56,+
56,+
7,
,"48
56,+ -./
1,56,+ -./
= 58,7 cm3.mol-1 (58,0 sur le diagr.)
n%&
et
= 3,333 mol
84,"
= 0,681 mol
Effectif total :
n&;& = n = 3,333 + 0,681 = 4,014 mol
On va pouvoir calculer les fractions molaire xi et se reporter sur le diagramme V , = f(xi)
C,CCC
+ ,
?H2O
= $ =
= 0,830
?%&
56,+
,74
,
= 0,170
En traant une verticale pour?%&
= 0,170 , on pourra
dterminer partir de chacune des courbes :
17,8
54,7
Vm(H2O, x%&
= 0,170 ) = 17,8 cm3.mol-1
et
Vm(EtOH, x%&
D'o le volume du mlange :
V = n . V = [n $ Vm(H2O, ?%&
= 0,170 ) = 54,7 cm3.mol-1
= 0,170 )] +[n%&
Vm(EtOH, ?%&
= 0,170 )]
= [3,333 17,8] + [0,681 54,7] = 59,33 + 37,25 = 96,58 cm3
Volume de mlange = 100,00 96,58 = 3,42 cm3
Sinon, quels volumes aurait-il d utiliser pour obtenir 100 cm3 d'un
mlange ayant peu prs la mme constitution ?
Le plus simple, c'est de faire une rgle de trois avec le facteur d'chelle
Nouveaux volumes prlever :
D7,84
V%&
,2 3
,2 3
= 60,0
D7,84
= 60,00 1,0354
= 62,12cm3
= 40,0
D7,84
= 40 1,0354
= 41,42 cm3
Contrle avec les volumes molaires partiels :
V&;& E & < G = V $ + V%&
= 62,12 + 41,42 = 103,54 cm3
V&;&
23I <
= n . V
= V i, ?EtOH = 0,170 ; vaudra t'il bien 100 mL ?
Aprs mlange, les molcules vont interagir et les volumes partiels de chacun des constituants
seront les mme que le lors du calcul prcdent; par contre les quantits de matire en moles
seront ajustes par un facteur correctif :
V'(H2O, ?%&
V'(EtOH, ?%&
= 0,170) = 59,33
D7,84
D7,84
= 0,170) = 37,25
= 59,33 1,0354 = 61,43 cm3
= 37,25 1,0354 = 38,57 cm3
D7,84
Vtot du nouveau mlange = V i, ?EtOH = 0,170
= V'(H2O, ?%&
= 0,170) + V'(EtOH, ?%&
= 0,170)
= 61,43 + 38,57 = 100,00 mL
Donc le flacon sera nouveau plein de "Vodka" de synthse
2) Soit une boisson alcoolise ayant une fraction molaire de 0,3 (en
alcool) ; trouver son titre en degrs alcooliques
Dfinition du titre en degrs alcoolique : =
RSTUVW X Y ZT[SST \U]
RSTUVW ^S^ZT
en %
Il va donc falloir dterminer le volume d'alcool pur dans un volume connu de cette boisson.
Sur le graphe, on va pouvoir dterminer le volume molaire de l'eau et de
l'alcool si xEtOH = 0,3. On pourra ensuite raisonner pour une mole de mlange.
Si _ `abc = 0,3 :
V (EtOH, ?%&
= 0,3) = 56,4 cm3
56,4
17,4
V (H2O, ?%&
= 0,3) = 17,4 cm3
0,3
Pour une mole de mlange; volume total :
V = x . V =[ x $ Vm(H2O, ?%&
= 0,3)] + [x%&
Vm(EtOH, ?%&
= (0,7 17,4) + ( 0,3 56,4) = 12,18 + 16,92 = 29,1 cm3
Or dans une mole de mlange, il y a 0,3 mol d'alcool pur :
Volume de 0,3 mol d'alcool pur :
3
V(EtOH pur) = 0,3 V ,%&
2 3 = 0,3 58,7 = 17,6 cm
Degr alcoolique =
RSTUVW X Y ZT[SST \U]
RSTUVW ^S^ZT
",7
!D,
100 = 60,5
= 0,3)]
III Le volume V d'une solution de m2 moles d'acide actique dans 1000 g
d'eau obit la formule :
V = 1002,935 + 51,832 m2+ 0,1394 (dd
Exprimer en fonction de m2 , les volumes molaires partiels de l'acide
actique et de l'eau.
Nous raisonnons pour 1000g de solvant; nous avons donc des informations en
molalit.
Si ni est la quantit de matire en moles pour 1000g de solvant :
Pour l'acide actique : n2 = m2 moles
Pour l'eau:
n1 =
= 55,55 moles
4
On peut dj exprimer le volume total en fonction des volumes partiels :
V = n . V = n $ V , $ + ne9e9 V ,e9e9
+ n2 V $
= n1 V >
= 55,55 V >
+ m2 V $
Puisque le volume total fourni dans l'nonc est fonction du nombre de moles
d'acide, on peut facilement dterminer le volume molaire partiel de l'acide
actique en fonction de la composition du systme:
V $=
=
=
( 1002,935 + 51,832 m2 + 0,1394 f!! )
V
= 51,832 + 0,2788.m2
De l'quation
V
>
=
=
=
=
, on peut dduire le volume molaire partiel de l'eau :
!,DC8 j 8 ,4C! 2 j , CD . $$ g $ 8 ,4C! j ,!"44. $
88,7
88,8
$
!,DC8 j 8 ,4C! 2 j , CD . $ j kg 8 ,4C! $ .g ,!"44. $$ l
R g V$ Ri$
!,DC8 j 2g , CD . $$
88,7
18,0528 0,0025. f!!
88,8
Contrle du bon rsultat de ces drivations partielles :
V = n . V = n $ V , $ + ne9e9 V ,e9e9
= 55,56
V , $
+ m! V ,e9e9
= 55,56 (18,0528 0,0025. f!! ) + m! (51,832 + 0,2788.m2 )
= 1002,97 - 0,1389. f!! + 51,832 m! + 0,2788. f!!
= 1002,97 + 51,832 m! + 0,1389. f!!
Qui est bien voisine de la relation de dpart :
V = 1002,935 + 51,832 m2 + 0,1394 m!!
Application numrique : m2 = 0 ; 1 ; 10 ; 100.
Si m2 = 0(eau pure)
V > = 18,0528 cm3.mol-1
qui est en accord avec 1 g.cm-3 et M(H2O) =18 g.mol-1
n
4,
Rappel : M = Vm
D'o : Vm = =
= 18,0 cm3.mol-1
Pas de '(d
Si m2 = 1(sln dilue)
V > = 18,0528 0,0025 1
V
V
$
$
= 18,0503 cm3.mol-1
= 51,832 + 0,2788 (1)
= 51,832 + 0,2788 = 52,1108 cm3.mol-1
Si m2 = 10(sln concentre)
V
V
>
V
V
>
= 18,0528 0,0025 10 !
= 18,0528 0,25 = 17, 8028 cm3.mol-1
= 51,832 + 0,2788 (10)
= 51,832 + 2,788 = 54,622 cm3.mol-1
Si m2 = 100(sln trs concentre)
V > = 18,0528 0,0025 100 ! = 17,80285 cm3.mol-1
V > = 18,0528 25 < 0 !!!
V $ = 51,832 + 0,2788 (100)
V $ = 51,832 + 27,88 = 79,71 cm3.mol-1
La valeur ngative de V > obtenue pour m2 = 100, prouve que la modlisation
n'est plus valable; on va calculer quelle composition cela correspond:
Calculer la concentration maximale de cet acide (en mol.L-1).
La densit de CH3COOH 20C tant gale 1,0492 ;
Masse molaire de CH3COOH : 60 g.mol-1
En calir, on demande la concentration de l'acide actique liquide pur en acide
actique; c'est ce que l'on a dj fait pour l'eau :
Molarit(H2O pure) : 55,56 mol H2O.L-1)
L'acide actique est liquide de 16 118C et il est un peu plus dense que l'eau.
e9e9
Rappel : d =
s'ils sont dans les mmes condition de tempraure et de
pression. Donc :
(AcAc) = 1,0492 1(g.cm-3) = 1,0492 g.cm-3 = 1049,2 g.dm-3 = 1049,2 g.L-1
De la masse volumique la molarit:
Molarit =
;<
< &3
Ri
Molarit(AcAc pur) =
VSTW
oST X Y UpW VSTW XW TqrUqXW
e9e9 G.t=>
II ;< 3 e9e9 G.
;<=>
n
D,!
= 17,48 molAcAc.L-1
Cette valeur est donc la concentration maximale de cet acide( si on
rajoute de l'eau, elle diminue)
Discuter.
La molalit est une concentration pour 1000g de solvant
m2 = 100, molalit qui pose problme, correspond un systme compos de 100
mol d'AcAc et de 1000g d'eau
7
Le volume molaire de AcAc pur = =
= 57,168 cm3.mol-1 = V $
D!
Donc 100 moles occupent donc un volume de 5717 cm3 = 5,717 L
Si m=100, le systme sera compos de 1 L d'eau et de 5,717 L d'acide
C'est une solution trs concentre, parfaitement ralisable et on est loin du
compos pur
Tableau bilan des volumes molaires partiels; m2 = 100 n'est pas mentionn
puisque la modlisation ne fonctionne plus:
m2
'(d
'(u
0
/
18,0528
1
52,11
18,0503
10
54,62
17,8028
AcAc pur
57,17
/
veau (cm3.mol-1)
veth. (cm3.mol-1)
58.0
thanol
18.0
56.0
eau
16.0
54.0
14.0
52.0
0.0
0.2
0.4
0.6
0.8
1.0
x ethanol
Volumes molaires partiels de leau de lthanol dans lthanol aqueux 25C
Você também pode gostar
- Les Nombres PremiersDocumento12 páginasLes Nombres PremiersKarl MalongaAinda não há avaliações
- Cours de PPMDocumento148 páginasCours de PPMKevin Tshimanga100% (2)
- Exercices Corrigés de L'optique GéométriqueDocumento23 páginasExercices Corrigés de L'optique GéométriqueETUSUP92% (12)
- Cours D'analyse de Structures Par La Methode Des Elements FinisDocumento58 páginasCours D'analyse de Structures Par La Methode Des Elements FinisJosué Fangu100% (1)
- Pouvoir Pensee - Annie BesantDocumento84 páginasPouvoir Pensee - Annie BesantA100% (1)
- Correction de La Serie Revision ThermocinetiqueDocumento18 páginasCorrection de La Serie Revision ThermocinetiqueManuel Arzola100% (2)
- DistillationDocumento5 páginasDistillationAghai MohamedAinda não há avaliações
- TD 2 Opu Skikda 2019-20Documento7 páginasTD 2 Opu Skikda 2019-20mahi mahiAinda não há avaliações
- Exo T6liqvapDocumento8 páginasExo T6liqvapجعدبندرهمAinda não há avaliações
- TDN 1Documento2 páginasTDN 1Oumayma FarhatAinda não há avaliações
- ThermodynamiqueDocumento37 páginasThermodynamiqueyounessmaAinda não há avaliações
- Série TD - 03 - OPU - Avec CorrigéDocumento4 páginasSérie TD - 03 - OPU - Avec Corrigéayoubhmdh 420% (1)
- Bibliographie DistllationDocumento12 páginasBibliographie DistllationBrave ZinebAinda não há avaliações
- Série de TD 2-DTS GCDocumento2 páginasSérie de TD 2-DTS GCSel Ma100% (1)
- Distillation Rectification CoursDocumento59 páginasDistillation Rectification CoursBENSLIMANEOTHMANEAinda não há avaliações
- Bilan Matiere 2PDocumento8 páginasBilan Matiere 2PMaël SounaAinda não há avaliações
- Génie Chimique Partie II-2Documento44 páginasGénie Chimique Partie II-2khaoula khaoulaAinda não há avaliações
- Chapitre - I - GC by Rachid MerouaniDocumento14 páginasChapitre - I - GC by Rachid MerouaniRA MIAinda não há avaliações
- Reacteur Catalytique M1GC M1GPE M1Gph Chapitre1Documento15 páginasReacteur Catalytique M1GC M1GPE M1Gph Chapitre1Hamdaoui douniaAinda não há avaliações
- Association Des Réacteurs IdéauxDocumento4 páginasAssociation Des Réacteurs Idéauxsoumia0% (1)
- La DistillationDocumento8 páginasLa DistillationMiliani Ahmed100% (1)
- 2012 Tutorat Diffusion CorrigéDocumento7 páginas2012 Tutorat Diffusion CorrigéDjanie SteedAinda não há avaliações
- Série TD N°2de Réacteurs HomogènesDocumento4 páginasSérie TD N°2de Réacteurs HomogènesFoot ixAinda não há avaliações
- Série de TD-GPDocumento4 páginasSérie de TD-GPManel 123Ainda não há avaliações
- Rapport TP Modelisation ThermodynamiqueDocumento25 páginasRapport TP Modelisation ThermodynamiqueDéborah LuiraAinda não há avaliações
- Exo DistillationDocumento1 páginaExo DistillationMeng HeangAinda não há avaliações
- TD 2 Bio IhnibiteursDocumento1 páginaTD 2 Bio IhnibiteursMohamed EL AmineAinda não há avaliações
- Serie 02 GCDocumento2 páginasSerie 02 GCSavana BellaAinda não há avaliações
- 1ère SérieDocumento3 páginas1ère SérieAbdallah abdellaouiAinda não há avaliações
- McCabe Thiele FrenchDocumento21 páginasMcCabe Thiele FrenchChokri Chakiir100% (1)
- Simulation Et Optimisation Des Procédés TechnologiquesDocumento11 páginasSimulation Et Optimisation Des Procédés TechnologiquesSamakitka Martina0% (1)
- Chapitre 2Documento9 páginasChapitre 2Saïda CHERIFAinda não há avaliações
- 01 EsterificationDocumento6 páginas01 EsterificationLeila ChimieAinda não há avaliações
- TP Chimie 2Documento16 páginasTP Chimie 2khraifi RimAinda não há avaliações
- Bilan Thermique PDFDocumento21 páginasBilan Thermique PDFElbachaAinda não há avaliações
- Chapitre III (Diagramme Binaire Liq Vap) 2015Documento46 páginasChapitre III (Diagramme Binaire Liq Vap) 2015ChaoukiAinda não há avaliações
- Serie 2Documento8 páginasSerie 2Mourad MatmourAinda não há avaliações
- Printing Calcul Humidité Et Enthalpie Massique D'un Air HumideDocumento2 páginasPrinting Calcul Humidité Et Enthalpie Massique D'un Air Humidefarah channaAinda não há avaliações
- Dist Chap2Documento12 páginasDist Chap2henryAinda não há avaliações
- Chapitre I - DTSDocumento30 páginasChapitre I - DTSSalma ADAIDAAinda não há avaliações
- Compt-Rendu Simulateur en Genie ProcédésDocumento5 páginasCompt-Rendu Simulateur en Genie ProcédésImad Eddine ChaichiAinda não há avaliações
- EMD M1 Bior+sol Juin 2018.TextMarkDocumento4 páginasEMD M1 Bior+sol Juin 2018.TextMarkAAinda não há avaliações
- Fiche TD AbsorptionDocumento1 páginaFiche TD AbsorptionBeicha100% (1)
- SM-BOUCHERDOUD - Ahmed-Chimie - Fondamentale-TP 3-Thermodynamique Et Cinétique Chimique - L2-S4Documento2 páginasSM-BOUCHERDOUD - Ahmed-Chimie - Fondamentale-TP 3-Thermodynamique Et Cinétique Chimique - L2-S4fatimazahraAinda não há avaliações
- Exercices DistillationDocumento2 páginasExercices Distillationawalou00 dala0% (1)
- Traitement Et Conditionnement Des Eaux de Process - 111438Documento33 páginasTraitement Et Conditionnement Des Eaux de Process - 111438Aisaoua BuobouAinda não há avaliações
- Orca Share Media1586856710132 PDFDocumento1 páginaOrca Share Media1586856710132 PDFAabed omairAinda não há avaliações
- Travaux Diriges de ThermodynamiqueDocumento8 páginasTravaux Diriges de ThermodynamiqueBhuvanAinda não há avaliações
- La Distillation - Partie 2-: Notes de Cours: Distillation - Mme BRAKCHIDocumento7 páginasLa Distillation - Partie 2-: Notes de Cours: Distillation - Mme BRAKCHIHanane KhettabiAinda não há avaliações
- Binaires 2Documento8 páginasBinaires 2محمد الفاتح100% (1)
- 1 THEORIEs DES SOLUTIONSDocumento12 páginas1 THEORIEs DES SOLUTIONSMira MslAinda não há avaliações
- TD2 Calculs Sur Les Réacteurs ChimiquesDocumento2 páginasTD2 Calculs Sur Les Réacteurs ChimiquesBALANAAinda não há avaliações
- Chapitre IIIDocumento6 páginasChapitre IIISavana BellaAinda não há avaliações
- Génie Chimique - BTS - Session 2011Documento7 páginasGénie Chimique - BTS - Session 2011Assef ZraouraAinda não há avaliações
- Cours Bilans MacroscopiquesDocumento12 páginasCours Bilans MacroscopiquesJojo Boub100% (1)
- Traveaux Pratique OPU: Variation de La Perte de Charge Sur Une Colonne de Distillation DiscontinnueDocumento9 páginasTraveaux Pratique OPU: Variation de La Perte de Charge Sur Une Colonne de Distillation Discontinnuenour nour100% (1)
- O2 - Binaires G2D CorrigeDocumento8 páginasO2 - Binaires G2D Corrigeoumayma afdhalAinda não há avaliações
- Emd Remplacement M2 2019+sol-1.TextMarkDocumento6 páginasEmd Remplacement M2 2019+sol-1.TextMarkA100% (1)
- 4ème Série Dist Disc MGCDocumento2 páginas4ème Série Dist Disc MGCAbdallah abdellaouiAinda não há avaliações
- TP 1ms3eDocumento16 páginasTP 1ms3eZakaria ChemichaAinda não há avaliações
- Compte RenduDocumento14 páginasCompte RenduJouini ZakariaAinda não há avaliações
- Dist Chap1Documento15 páginasDist Chap1henry0% (1)
- TD 1 - BMDocumento19 páginasTD 1 - BMyasser ouramdaneAinda não há avaliações
- Applications de la spectrophotomérie en phytochimie: sciencesNo EverandApplications de la spectrophotomérie en phytochimie: sciencesAinda não há avaliações
- Emploi Du Temps CIGP Automne 2015 2Documento1 páginaEmploi Du Temps CIGP Automne 2015 2YasseerRajAinda não há avaliações
- Nouveau Document Microsoft Office WordDocumento1 páginaNouveau Document Microsoft Office WordYasseerRajAinda não há avaliações
- Ma Première Visite A Tartarin de Tarascon Est Restée Dans Ma Vie Comme Une Date InoubliableDocumento1 páginaMa Première Visite A Tartarin de Tarascon Est Restée Dans Ma Vie Comme Une Date InoubliableYasseerRajAinda não há avaliações
- TP InformatiqueDocumento64 páginasTP InformatiqueYasseerRajAinda não há avaliações
- TP InterpolationDocumento2 páginasTP InterpolationRéda BerradaAinda não há avaliações
- ProbatdDocumento33 páginasProbatdensimagAinda não há avaliações
- Cahier de Charges de Travaux de BetonnageDocumento101 páginasCahier de Charges de Travaux de BetonnageMargaretAinda não há avaliações
- Guide BBC EffilogisDocumento11 páginasGuide BBC EffilogisFranche-Comté100% (2)
- Écoulement Réactif en Milieu Poreux PDFDocumento229 páginasÉcoulement Réactif en Milieu Poreux PDFait hssainAinda não há avaliações
- 2 m1 Me s2 Pcsc2 Structure MisDocumento33 páginas2 m1 Me s2 Pcsc2 Structure Misrano bousselaouiAinda não há avaliações
- Sujet U32Documento20 páginasSujet U32Triki BilelAinda não há avaliações
- A5 Isolement Acoustique PDFDocumento4 páginasA5 Isolement Acoustique PDFYounes OumaimounAinda não há avaliações
- Tdom3 PDFDocumento12 páginasTdom3 PDFgazzamnounouAinda não há avaliações
- Convertisseur BoostDocumento9 páginasConvertisseur BoostNaas DjeddaouiAinda não há avaliações
- 04 Composition Des Vitesses Et AccélérationsDocumento8 páginas04 Composition Des Vitesses Et AccélérationsNitos IncoAinda não há avaliações
- Chapitre 1 Les Tableaux Et Les EnregistrementsDocumento18 páginasChapitre 1 Les Tableaux Et Les EnregistrementsLinux CrafterAinda não há avaliações
- Comparaison Des Normes Euro Code 8Documento23 páginasComparaison Des Normes Euro Code 8Kara Mella50% (2)
- Comportement Générique Des OndesDocumento3 páginasComportement Générique Des Ondesla physique selon le programme FrançaisAinda não há avaliações
- Mémoire de Fin D'Études: Département de Génie Civil Et HydrauliqueDocumento122 páginasMémoire de Fin D'Études: Département de Génie Civil Et HydrauliqueCabrel FankamAinda não há avaliações
- Cristallographie Géométrique SMC S4 2021Documento30 páginasCristallographie Géométrique SMC S4 2021Said ElkhouAinda não há avaliações
- Statistique 3APICDocumento2 páginasStatistique 3APICMohamed AylalAinda não há avaliações
- Despre Suflare F BunDocumento56 páginasDespre Suflare F BunChivuAlexandruAinda não há avaliações
- ApplicationsDocumento14 páginasApplicationsAyoub HmimssaAinda não há avaliações
- TP Lignes D'InfluencesDocumento9 páginasTP Lignes D'Influenceslando de chanceAinda não há avaliações
- Transformation Ponctuelle Histogram MeDocumento42 páginasTransformation Ponctuelle Histogram MeVhdl FpgaAinda não há avaliações
- ELG2736 Chapitre 1 VariablesDocumento184 páginasELG2736 Chapitre 1 VariablesGedeon KayaAinda não há avaliações
- Serie D'exercices Corrigés - Math - Suites Réelles 1 - 4ème Math (2009-2010)Documento4 páginasSerie D'exercices Corrigés - Math - Suites Réelles 1 - 4ème Math (2009-2010)GastØn El GassAinda não há avaliações
- (PDF) Exercices - Topologie Des Espaces Vectoriels Normés - Corrigé - Othmane Rais - AcademiaDocumento9 páginas(PDF) Exercices - Topologie Des Espaces Vectoriels Normés - Corrigé - Othmane Rais - AcademiaNambinintsoa NomenjanaharyAinda não há avaliações
- Daniel Alibert - Cours Et Exercices Corrigés - Volume 4Documento140 páginasDaniel Alibert - Cours Et Exercices Corrigés - Volume 4walantaAinda não há avaliações