Escolar Documentos
Profissional Documentos
Cultura Documentos
El PH Es Una Medida de La Acidez o Basicidad de Una Solución
Enviado por
Kristel MagalyDescrição original:
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
El PH Es Una Medida de La Acidez o Basicidad de Una Solución
Enviado por
Kristel MagalyDireitos autorais:
Formatos disponíveis
El pH es una medida de la acidez o basicidad de una solucin.
El pH es la
concentracin de iones hidronio [H3O+] presentes en determinada
sustancia. La sigla significa "potencial de hidrgeno" (pondus Hydrogenii o
potentia Hydrogenii; del latn pondus, n. = peso; potentia, f. = potencia;
hydrogenium, n. = hidrgeno). Este trmino fue acuado por el qumico
dans Srensen, quien lo defini como el logaritmo negativo de base 10 de
la actividad de los iones hidrgeno. Esto es:
Desde entonces, el trmino "pH" se ha utilizado universalmente por lo
prctico que resulta para evitar el manejo de cifras largas y complejas. En
disoluciones diluidas, en lugar de utilizar la actividad del ion hidrgeno, se le
puede aproximar empleando la concentracin molar del ion hidrgeno.
Por ejemplo, una concentracin de [H3O+] = 1 107 M (0,0000001) es
simplemente un pH de 7 ya que: pH = log[107] = 7
El pH tpicamente va de 0 a 14 en disolucin acuosa, siendo cidas las
disoluciones con pH menores a 7 (el valor del exponente de la concentracin
es mayor, por que hay ms protones en la disolucin) , y bsicas las que
tienen pH mayores a 7. El pH = 7 indica la neutralidad de la disolucin
(donde el disolvente es agua).
Se considera que p es un operador logartmico sobre la concentracin de
una solucin: p = log[...] , tambin se define el pOH, que mide la
concentracin de iones OH.
Puesto que el agua est disociada en una pequea extensin en iones OH y
H3O+, tenemos que:
Kw = [H3O+][OH]=1014 en donde [H3O+] es la concentracin de iones
hidronio, [OH] la de iones hidroxilo, y Kw es una constante conocida como
producto inico del agua, que vale 1014.
Por lo tanto,
log Kw = log [H3O+] + log [OH]
14 = log [H3O+] + log [OH]
14 = log [H3O+] log [OH]
pH + pOH = 14
Por lo que se puede relacionar directamente el valor del pH con el del pOH.
En disoluciones no acuosas, o fuera de condiciones normales de presin y
temperatura, un pH de 7 puede no ser el neutro. El pH al cual la disolucin
es neutra estar relacionado con la constante de disociacin del disolvente
en el que se trabaje.
Medida del pH
Dependiendo del pH del suelo la Hortensia (Hydrangea) puede poseer flores
rosas o azules. En suelos cidos (pH <> 7) son rosas.[1]
El valor del pH se puede medir de forma precisa mediante un
potencimetro, tambin conocido como pH-metro, un instrumento que mide
la diferencia de potencial entre dos electrodos: un electrodo de referencia
(generalmente de plata/cloruro de plata) y un electrodo de vidrio que es
sensible al in hidrgeno.
Tambin se puede medir de forma aproximada el pH de una disolucin
empleando indicadores, cidos o bases dbiles que presentan diferente
color segn el pH. Generalmente se emplea papel indicador, que se trata de
papel impregnado de una mezcla de indicadores. Algunos compuestos
orgnicos que cambian de color en funcin del grado de acidez del medio en
que se encuentren se utilizan como indicadores cualitativos para la
determinacin del pH. El papel de litmus o papel tornasol es el indicador
mejor conocido. Otros indicadores usuales son la fenolftalena y el naranja
de metilo.
A pesar de que muchos potencimetros tienen escalas con valores que
van desde 1 hasta 14, los valores de pH pueden ser menores que 1 y
mayores que 14. Por ejemplo el cido de batera de automviles tiene
valores cercanos de pH menores que uno, mientras que el hidrxido de
sodio 1 M vara de 13,5 a 14.
Un pH igual a 7 es neutro, menor que 7 es cido y mayor que 7 es bsico
a 25 C. A distintas temperaturas, el valor de pH neutro puede variar debido
a la constante de equilibrio del agua (Kw).
La determinacin del pH es uno de los procedimientos analticos ms
importantes y ms usados en ciencias tales como qumica, bioqumica y la
qumica de suelos. El pH determina muchas caractersticas notables de la
estructura y actividad de las biomacromolculas y, por tanto, del
comportamiento de clulas y organismos.
En 1909, el qumico dans Sorensen defini el potencial hidrgeno como el
logaritmo negativo de la concentracin molar (ms exactamente de la
actividad molar) de los iones hidrgeno. Esto es:
pH = -\log[H^+] \,\!
El pOH
El pOH se define como el logaritmo negativo de la actividad de los iones de
hidrxido. Esto es, la concentracin de iones OH-:
pOH = log10.[OH ]
En soluciones acuosas, los iones OH- provienen de la disociacin del agua:
H2O H+ + OHo tambin,
2H2O H3O+ + OHPor ejemplo, una concentracin de [OH-] = 110-7 M (0,0000001 M) es
simplemente un pOH de 7 ya que : pOH = -log[10-7] = 7
Al igual que el pH, tpicamente tiene un valor entre 0 y 14 en disolucin
acuosa, siendo cidas las disoluciones con pOH mayores a 7, y bsicas las
que tienen pOH menores a 7.
Por lo tanto,
pH + pOH = 14
pH y pOH
Soren Sorensen defini el concepto de pH para facilitar el trabajo con las
concentraciones de iones H3O+, que son cantidades muy pequeas en disoluciones
acuosas y son exprersadas en potencias negativas de diez.
pH y pOH es una medida de la acidez o la forma bsica es una solucin y para la
mayora de las soluciones, se mide en una escala de 0 a 14. Cuanto menor sea el
nmero, ms cida es la solucin, y cuanto mayor sea el nmero, es el ms bsico de la
solucin.Soluciones neutras (no cidos o bsicos) tienen un pH de 7.
El pH se mide en lo que llamamos una escala logartmica, lo que significa que por cada
nmero de los cambios de pH, la concentracin de H tomos cambia por un factor de
10 (se vuelve 10 veces ms cido o bsico).
pH = - log [H3O+]/ 1 mol/l; la expresin 1 mol/l se hace para eliminar las unidades. Por
lo tanto se abrevia:
pH = -log [H3O+] o ms comunmente como pH = -log [H+].
+
Si [H+] > 10^-7, el pH < 7 y la solucin es cida.
Si [H+] = 10^-7, el pH es = 7 y la solucin es neutra
Si [H+] < 10^-7, el pH > 7 y la solucin es bsica.
El pOH = -log [OH-]
La escala de pH comienza en 0 y termina en 14; la escala de pOH es inversa, cuando pH
=0, pOH =14
cuando pH=14, pOH=0, y cuando pH = 7, pOH =7.
Relacin entre pH, pOH y pKw:
Kw = [H][OH], se aplica logaritmo:
logKw = log ([H][OH]) = log [H] + log [OH], se multiplca por -1 y se obtiene:
-log Kw = - (log [H]) + (- log[OH])
si pKw = -logKw, entonces:
pKw = pH + pOH
Dado que pKw= -log (1x10^-14), entonces:
pH + pOH = 14
Neutralizacin
La neutralizacin es la reaccin entre un cido y una base. Ejemplo:
HCl (ac) + NaOH (ac) ---------> NaCl (s) + H2O (l) (una sal + agua)
Conclusin
pH y pOH es una medida de la acidez o la forma bsica es una solucin y para la
mayora de las soluciones, se mide en una escala de 0 a 14. Cuanto menor sea el
nmero, ms cida es la solucin, y cuanto mayor sea el nmero, es el ms bsico de la
solucin.Soluciones neutras (no cidos o bsicos) tienen un pH de 7.
El pH se mide en lo que llamamos una escala logartmica, lo que significa que por cada
nmero de los cambios de pH, la concentracin de H tomos cambia por un factor de
10 (se vuelve 10 veces ms cido o bsico)
+
Você também pode gostar
- Introduccion A La Fisica PDFDocumento38 páginasIntroduccion A La Fisica PDFDaniel Alejandro Plascencia RuizAinda não há avaliações
- Iec 60076-12Documento3 páginasIec 60076-12Sebastián Fernández0% (1)
- El PH y El pOHDocumento5 páginasEl PH y El pOHJhon Jairo Rodriguez QuinteroAinda não há avaliações
- El PH y El pOHDocumento6 páginasEl PH y El pOHJose OrbegosoAinda não há avaliações
- El PH y El PoHDocumento5 páginasEl PH y El PoHCristina FelixAinda não há avaliações
- Por Que El PH Solo Se Mide de 0 A 14Documento2 páginasPor Que El PH Solo Se Mide de 0 A 14Walter Romero B67% (3)
- Medición de PH y PkaDocumento3 páginasMedición de PH y PkaFrancisco Javier Salas ArayaAinda não há avaliações
- PH Practicas de FQB IIDocumento15 páginasPH Practicas de FQB IINihil RivasAinda não há avaliações
- 8 Autoprotolisis - Celdas ElectroqxDocumento19 páginas8 Autoprotolisis - Celdas ElectroqxElmer SozaAinda não há avaliações
- Definicion Del PHDocumento5 páginasDefinicion Del PHCarSoAinda não há avaliações
- Indicador Marco Teorico, Concl, Biblio, IndiceDocumento7 páginasIndicador Marco Teorico, Concl, Biblio, IndiceMontes Villanueva MiguelAinda não há avaliações
- El PHDocumento5 páginasEl PHBriggiitte GuzmanAinda não há avaliações
- Medida Del PH: Acidez Basicidad Hidrógeno Químico Sørensen IonesDocumento2 páginasMedida Del PH: Acidez Basicidad Hidrógeno Químico Sørensen IonesBoris ZegarraAinda não há avaliações
- 2pH y pOHDocumento12 páginas2pH y pOHStephany Rojano MiguelAinda não há avaliações
- CÁLCULO DE PH y pOHDocumento5 páginasCÁLCULO DE PH y pOHAnita Duran100% (1)
- 1 Definición 2 Medición Del PH: HidrogenionesDocumento5 páginas1 Definición 2 Medición Del PH: HidrogenionesRonald Frank Patzi PomaAinda não há avaliações
- Caratula PHDocumento10 páginasCaratula PHAngela JarvisAinda não há avaliações
- Presentación QuimicaDocumento10 páginasPresentación QuimicaFrancisco AlbertoAinda não há avaliações
- FuenteDocumento11 páginasFuentejoseAinda não há avaliações
- Autoionizacion Del Agua PH y POHDocumento12 páginasAutoionizacion Del Agua PH y POHLizVDiAinda não há avaliações
- PH Definicion y Como MedirloDocumento11 páginasPH Definicion y Como MedirlopelicanoAinda não há avaliações
- Taller 17 NovenoDocumento3 páginasTaller 17 NovenoWilson Marquez LuydensAinda não há avaliações
- Equilibrio Ionico Del AguaDocumento2 páginasEquilibrio Ionico Del AguaJhosuny Pérez FernándezAinda não há avaliações
- PH y pOHDocumento12 páginasPH y pOHdéborah_rosalesAinda não há avaliações
- El PH y pOHDocumento6 páginasEl PH y pOHLeilani CejaAinda não há avaliações
- Revision y Discusiones de PHDocumento5 páginasRevision y Discusiones de PHpoolAinda não há avaliações
- PhoDocumento11 páginasPhobrandon donovan ortizAinda não há avaliações
- Qué Es El PHDocumento3 páginasQué Es El PHErick VAinda não há avaliações
- El PHDocumento10 páginasEl PHjesus emanuel zaragoza negreteAinda não há avaliações
- Det. de PH (Rev Cero) PDFDocumento6 páginasDet. de PH (Rev Cero) PDFoscarAinda não há avaliações
- Tema 6Documento15 páginasTema 6Miguel ReyesAinda não há avaliações
- Informe No. 9 - PH E INDICADORES ACIDO - BASEDocumento10 páginasInforme No. 9 - PH E INDICADORES ACIDO - BASEKevin MorenoAinda não há avaliações
- El pOHDocumento1 páginaEl pOHCesarAlexiissAinda não há avaliações
- Fuerza de ÁcidosDocumento9 páginasFuerza de ÁcidosRodrigo PimentelAinda não há avaliações
- PHDocumento2 páginasPHEliot Rivera100% (1)
- Informe Nº7-Química General A2Documento18 páginasInforme Nº7-Química General A2Jose Carlos Salgado Arimana80% (10)
- Colegio de Estudios Cientificos y Tecnologicos Del Estado de VeracruzDocumento13 páginasColegio de Estudios Cientificos y Tecnologicos Del Estado de VeracruzIsabella MeseñoAinda não há avaliações
- Tarea 19Documento2 páginasTarea 19Mateo Trujillo JimenezAinda não há avaliações
- A5. La Escala de PHDocumento2 páginasA5. La Escala de PHMIGUEL VALDOVINOSAinda não há avaliações
- Indiacadores de PH y Curvas de NeutralizacionDocumento6 páginasIndiacadores de PH y Curvas de NeutralizacionIsra Santy RodriguezAinda não há avaliações
- Que Es El PHDocumento6 páginasQue Es El PHMay Ben EstherAinda não há avaliações
- PH de LiquidosDocumento2 páginasPH de LiquidosBryan MorejónAinda não há avaliações
- 14.1. EL PHDocumento42 páginas14.1. EL PHS Cristian ItoAinda não há avaliações
- Marco TeóricoDocumento10 páginasMarco TeóricoMdyoriFlrsRmsAinda não há avaliações
- PH en SolucionesDocumento10 páginasPH en Solucioneskevin44onixAinda não há avaliações
- Potencial de HidrogenoDocumento9 páginasPotencial de HidrogenoAnakin AnthonyAinda não há avaliações
- Autoinizacion Del AguaDocumento24 páginasAutoinizacion Del Aguaabigail0% (1)
- Concepto de PHDocumento14 páginasConcepto de PHRoxii Barzola100% (2)
- Equilibrio Iónico Del AguaDocumento3 páginasEquilibrio Iónico Del AguaQkriiz Arriola0% (1)
- Solucion AmortiguadoraDocumento6 páginasSolucion AmortiguadoraSalomon Ticona MamaniAinda não há avaliações
- Indicadores de PH y Curvas de NeutralizacionDocumento22 páginasIndicadores de PH y Curvas de NeutralizacionAna Nayde ChristopherAinda não há avaliações
- PH 1.1. Definicion: Relación de PH, pOH y Concentración de H yOHDocumento4 páginasPH 1.1. Definicion: Relación de PH, pOH y Concentración de H yOHSantisteban Bances LanderAinda não há avaliações
- Química 2 Guía de Aprendizaje U4-S3Documento10 páginasQuímica 2 Guía de Aprendizaje U4-S3Enrique ZambranoAinda não há avaliações
- CAP 5 EQUILIBRIO IONICO Parte 3 Índice Del Ión HidrógenoDocumento22 páginasCAP 5 EQUILIBRIO IONICO Parte 3 Índice Del Ión HidrógenoEren AlbeAinda não há avaliações
- PH - PPT Nº3Documento21 páginasPH - PPT Nº3707002aAinda não há avaliações
- Medición de PHDocumento7 páginasMedición de PHHernández KarenAinda não há avaliações
- Informe PHDocumento7 páginasInforme PHAndres Camilo GVAinda não há avaliações
- Tema 4 Tercer Lapso Quimica 4to Año)Documento2 páginasTema 4 Tercer Lapso Quimica 4to Año)Yudith J Marcano P100% (1)
- El PH en Fase Acuosa en La Vida Cotidiana: Sustancia PH AproximadoDocumento7 páginasEl PH en Fase Acuosa en La Vida Cotidiana: Sustancia PH AproximadoCarlos Cuevas LópezAinda não há avaliações
- Escala de PHDocumento10 páginasEscala de PHJessica Carrión100% (1)
- 1.-Ampliacion de Plazo Nro 02Documento12 páginas1.-Ampliacion de Plazo Nro 02Kristel MagalyAinda não há avaliações
- Tecnologia de Concreto - UcvDocumento20 páginasTecnologia de Concreto - UcvKristel MagalyAinda não há avaliações
- Caratula y SeparadoresDocumento22 páginasCaratula y SeparadoresKristel MagalyAinda não há avaliações
- Especificaciones Tecnicas SeñaleticaDocumento5 páginasEspecificaciones Tecnicas SeñaleticaKristel MagalyAinda não há avaliações
- 02 Insumos Local Multiusos Cte 38Documento4 páginas02 Insumos Local Multiusos Cte 38Kristel MagalyAinda não há avaliações
- Cronograma de Mano de Obra, Materiales y EquiposDocumento3 páginasCronograma de Mano de Obra, Materiales y EquiposKristel MagalyAinda não há avaliações
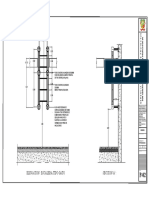
- Escalera Tipo GatoDocumento1 páginaEscalera Tipo GatoKristel MagalyAinda não há avaliações
- Empuje SísmicoDocumento6 páginasEmpuje SísmicoKristel MagalyAinda não há avaliações
- Google Sites PDFDocumento3 páginasGoogle Sites PDFKristel MagalyAinda não há avaliações
- EVALUACION MATEMÁTICA 8º BÁSICO - Doc Fila ADocumento3 páginasEVALUACION MATEMÁTICA 8º BÁSICO - Doc Fila AnancypaoAinda não há avaliações
- Hidráulica de Tuberías y Canales - A. RochaDocumento530 páginasHidráulica de Tuberías y Canales - A. RochaOscarAinda não há avaliações
- Mias U1 A3 RoauDocumento4 páginasMias U1 A3 RoauRoduribAinda não há avaliações
- 3 Teoría CuánticaDocumento29 páginas3 Teoría CuánticaDiana VillegasAinda não há avaliações
- Actividad3 Esperanza Ramirez MercadoDocumento14 páginasActividad3 Esperanza Ramirez MercadoEsperanza Ramirez MercadoAinda não há avaliações
- Goval Manual Programacion Regulador DCRLDocumento16 páginasGoval Manual Programacion Regulador DCRLJhon Jairo RiveraAinda não há avaliações
- Amplificadores Diferenciales Con BJTDocumento7 páginasAmplificadores Diferenciales Con BJTQuique CastroAinda não há avaliações
- MAGMASDocumento26 páginasMAGMASRossin HernanAinda não há avaliações
- Lubricantes y AditivosDocumento22 páginasLubricantes y Aditivososcarbritoc100% (1)
- Pronación PieDocumento3 páginasPronación PieNancy OrtegaAinda não há avaliações
- Programa Analítico Hidráulica General y AplicadaDocumento3 páginasPrograma Analítico Hidráulica General y AplicadaAndres CabelloAinda não há avaliações
- Elementos Del Sistema de TransmisionDocumento5 páginasElementos Del Sistema de TransmisioneswinAinda não há avaliações
- Mediciones y Rangos de Tolerancia Máximos de Armónicos en Una RedDocumento3 páginasMediciones y Rangos de Tolerancia Máximos de Armónicos en Una RedMauricio LlanoAinda não há avaliações
- Guia 2 Numeros CuanticosDocumento5 páginasGuia 2 Numeros CuanticosalyAinda não há avaliações
- Física Teoría, Ejemplos y Problemas - (PG 20 - 23)Documento4 páginasFísica Teoría, Ejemplos y Problemas - (PG 20 - 23)Felipe LeonAinda não há avaliações
- Examen 2Documento6 páginasExamen 2HUMBERTOAinda não há avaliações
- Calibración de La Balanza AnalíticaDocumento7 páginasCalibración de La Balanza AnalíticaLezkatheZapata100% (1)
- La Voz NormalDocumento39 páginasLa Voz NormalIgnacio Cardenas100% (2)
- Pract7 OpticaDocumento8 páginasPract7 Opticalab electroAinda não há avaliações
- El TitanioDocumento5 páginasEl TitanioGap Tkd MartínezAinda não há avaliações
- Laboratorio 2Documento14 páginasLaboratorio 2Sara Aguilar67% (3)
- Memoria de Cálculo Galpón Paddock PDFDocumento19 páginasMemoria de Cálculo Galpón Paddock PDFRodrigo Javier Alejandro Alvarez Vargas100% (1)
- Laboratorio 2 de Inorganica 1Documento7 páginasLaboratorio 2 de Inorganica 1Osmin RiveraAinda não há avaliações
- Reporte Virtual Densidad II 2017Documento4 páginasReporte Virtual Densidad II 2017Carlos Montenegro CastroAinda não há avaliações
- Capitulo 1Documento21 páginasCapitulo 1Isaac Sandoval CaleroAinda não há avaliações
- Intruduccion A La EstadisticaDocumento25 páginasIntruduccion A La Estadisticadjluigi080% (1)