Escolar Documentos
Profissional Documentos
Cultura Documentos
Taller 4 - Epe PDF
Enviado por
Richard MamaniTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Taller 4 - Epe PDF
Enviado por
Richard MamaniDireitos autorais:
Formatos disponíveis
QUIMICA EPE CE83
UPC 2016-1
TALLER 4
SOLUCIONES
1. Una mezcla de 105g de KClO3 y 380g de agua a 70C
de qu tipo ser?
Rpta: Mezcla homognea (solucin insaturada)
a) Si la temperatura desciende hasta 30C, qu
suceder?
Rpta: Mezcla heterognea (solucin saturada con
precipitado)
b) A qu temperatura ser una solucin saturada?
Rpta: 65C aprox.
2. El lmite permisible de cadmio en muestras de agua
potable es de 0,003 mg/L debido a su toxicidad. Una
muestra de 1000 ml de agua fue analizada y se
encontr que contena 8 g de cadmio, est por arriba
o por debajo del lmite permisible?
3. Describe cmo prepararas 250 mL de una disolucin de NaNO3 0,707 M.
Rpta: Disolver 15 g de NaNO3 en agua hasta enrazar 250 mL de solucin
4. Calcula la molaridad de una solucin acuosa de etanol formada por 5 g de etanol y 225 g de agua
cuya densidad es 0,98 g/mL. Masas molares: etanol=46 g/mol; agua=18 g/mol
5. Se disuelven 35 g de cloruro de magnesio, MgCl2, en 150 g de agua dando una solucin cuya
densidad es de 1,12 g/cm3. Expresar la concentracin de la solucin resultante en:
% m/m
% m/v
ppm
6. Con 30 g de nitrato de plata (AgNO3) se desea preparar una solucin acuosa de esta sal al 22%
m/m (densidad = 1,08 g/ml). Calcular:
a) El volumen de solucin que puede prepararse.
b) La masa de solvente necesaria.
c) La concentracin expresada en molaridad
Rpta. 126.26 ml
Rpta. 106.36 g
Rpta. 1,40 M
7. Se tienen las siguientes cantidades de sal disueltas en 425 g de agua cada una a 30C:
a) 392 g de NaNO3
b) 187 g de KNO3
c) 60 g de K2Cr2O7
Cunta sal debes agregar a cada sistema formado para saturarlo?
Rpta: Solubilidad en 100g de agua a) 95g aprox., b) 44g aprox., c) 16g aprox.
8. Selecciona de la siguiente lista la solucin saturada con precipitado e indica la masa del precipitado:
a) 89 g de NaNO3 en 425 g de agua
b) 40 g de KNO3 en 425 g de agua
c) 73,8 g de K2Cr2O7 en 425 g de agua
Rpta: Solubilidad en 100g de agua a) 95g aprox., b) 44g aprox., c) 16g aprox. c) 5,8 g (sin disolver)
1
TALLER 4
QUIMICA EPE CE83
UPC 2016-1
9. El nitrato de plata (AgNO3:169,87 g/mol) se
utiliza en el plateado de metales. Si se requiere
preparar 150 mL de solucin 1 M a 20 C.
a) Qu masa de soluto disolvera?
Rpta 25.48 g
b) Qu tipo de solucin ha preparado
(saturada, insaturada, sobresaturada)?
Rpta: Insaturada
c) Indique qu procedimiento realizara si
necesita diluir la solucin preparada y obtener
una concentracin de 0,1 M.
Rpta. Se debe agregar 1350 ml de agua
d) Qu masa de soluto se disolvera a 40C?
GASES IDEALES
10. En qu difiere el comportamiento de una muestra de gas comparado con una muestra de lquido
en cada una de las siguientes situaciones?
a) La muestra se transfiere de un recipiente a otro ms grande.
b) La muestra se calienta en un recipiente expandible, sin que ocurra un cambio de estado.
Rpta: F, V, F, V
11. Una muestra de amoniaco gaseoso ejerce una presin de 5,3 atm a 46oC. Cul es la presin
cuando el volumen del gas se reduce a una dcima parte de su valor inicial a la misma temperatura?
Rpta: 53 atm
12. Una muestra de aire ocupa un volumen de 3,8 L cuando la presin es de 1,2 atm. Si la temperatura
se mantiene constante. a) Qu volumen ocupara a 6,6 atm? b) Cul es la presin requerida
para comprimirlo a 0,075 L?
Rpta: a) 0,69L, b) 61atm
13. En condiciones de presin constante, una muestra de hidrgeno gaseoso con un volumen inicial
de 9,6 L a 88oC se enfra hasta que su volumen final es de 3,4 L. Cul es su temperatura final en
Celsius?
Rpta: (-145,2C).
14. Cierta cantidad de un gas est contenido en un recipiente de vidrio a 25oC y a una presin de 0,8
atm. Suponga que el recipiente soporta una presin mxima de 2 atm. Cunto se puede elevar la
temperatura del gas sin que se rompa el recipiente?
Rpta: 472C
15. Un recipiente cerrado de 2 L. contiene oxgeno a 200C y 2 atm. Calcula:
a) Las moles de oxgeno presentes en el recipiente.
Rpta: 0,103 mol
b) Los gramos de oxgeno contenidos en el recipiente.
Rpta: 3,296 g
16. Una empresa que se dedica a preparar fiestas infantiles emplea 500 mL de helio, para inflar un
globo (medido a la presin atmosfrica). Si el helio es vendido en cilindros de 20 L y 4 atm,
Cuntos cilindros se necesitar para inflar 640 globos? Considere que durante el inflado no vara
la temperatura.
17. Indique si las siguientes proposiciones son verdaderas (V) o falsas (F):
a) En un sistema isotrmico, al aumentar la presin, el volumen tambin se incrementa ()
b) En un sistema donde la presin permanece constante, al aumentar la temperatura el volumen
tambin se incrementa ()
c) En un sistema a volumen constante, cuando la temperatura aumenta, disminuye la presin ()
2
TALLER 4
QUIMICA EPE CE83
UPC 2016-1
d) En un sistema a presin y volumen constante, al aumentar la cantidad de partculas de gas, la
temperatura disminuye.
18. Una muestra gaseosa de 20 g de N2 (Masa molar = 28 g/mol) est encerrado en un cilindro de 20
litros a una temperatura de 5oC.
a)
b)
c)
d)
e)
Convierte la temperatura a grados Kelvin
Rpta: 278.15
Determine el nmero de moles de N2
Rpta: 0.71
Determine la presin dentro del recipiente que contiene N2
Rpta: 0.81 atm
A condiciones normales Qu volumen de N2 se tendra)
Rpta.: 15.90
Qu sucede con la presin dentro del recipiente si el gas del cilindro anterior se calienta
hasta 50oC encuentre la nueva presin?
Rpta.: 0.70 atm.
ESTEQUIOMETRIA 1
19. Balancea las siguientes ecuaciones y escribe los coeficientes estequiomtricos para cada
sustancia qumica. Asimismo, indica el tipo de reaccin.
a)
b)
c)
d)
e)
20.
H2(g) + O2(g) H2O(l)
C(s) +
Fe2O3(s) Fe(s)
H2SO4(ac) +
NaOH(ac)
Al2(CO3)3(s) Al2O3(s) +
NO(g) + O2(g) NO2(g)
+ CO(g)
H2O(l)
+
CO2(g)
Na2SO4(ac)
Representa los eventos qumicos que se muestran a continuacin en forma de ecuaciones
qumicas balanceadas. Debes recordar colocar los estados de agregacin de cada sustancia.
a)
El dixido de azufre gaseoso reacciona con el agua, produciendo una solucin de cido
sulfuroso.
b)
Al calentar piedra caliza, CaCO3, se descompone en xido de calcio y gas dixido de carbono.
c)
Una solucin de cido ntrico se neutraliza con otra solucin de hidrxido de aluminio,
formando una sal disuelta ms agua. La coloracin rosada de la fenolftalena indica el fin de
la reaccin.
Al agregar cinc metlico a una solucin acuosa de sulfato de cobre, se obtiene cobre metlico
y sulfato de cinc.
d)
21. Completa y balancea las siguientes ecuaciones qumicas:
a) .(ac) + (ac) PbCrO4(s) + KNO3(ac)
:Doble desplazamiento
b) .(ac) + . (g) NaCl(ac) + Br2(l)
:Simple desplazamiento
c) .(s) + .(ac) Fe2(SO4)3(ac) + H2(g)
:Simple desplazamiento
d) .(ac) + .(ac) CaCl2(ac) + H2O(g)
:Doble desplazamiento
22. Las reacciones de combustin usualmente presentan reactivos y productos esperados. Escribe
las reacciones qumicas asociadas a la combustin de cada una de las sustancias presentadas a
continuacin, balancalas e indica los coeficientes estequiomtricos.
a)
Combustin del metano (CH4)
b)
Combustin del butano (C4H10)
c)
Combustin del etanol (C2H6O)
d)
Combustin del propanol (C3H8O)
e)
Combustin de la glucosa (C6H12O6)
3
TALLER 4
QUIMICA EPE CE83
UPC 2016-1
23. Teniendo en cuenta la ecuacin qumica presentada a continuacin, responde las preguntas.
2 NO(g) + O2(g) 2 NO2(g)
a)
Calcula las moles que se producen de NO2 cuando reaccionan 3,30 moles de NO. Indica tu
respuesta.
b) Los gramos de O2 que se requieren para consumir 3,30 moles de NO.
Rpta. a) 3,30 mol NO2 ; b) 52,8 g O2
24.El sulfuro de hidrgeno (H2S) se puede obtener a partir de la siguiente reaccin.
FeS (s) + HCl (ac) FeCl2 (ac) + H2S (g)
Considera los datos de masas atmicas siguientes y responde las preguntas.
Fe = 55,85; S = 32; H = 1; Cl = 35,5.
a) Balancea la ecuacin qumica correspondiente e indica los coeficientes.
b) Calcula la masa (en g) de sulfuro de hidrgeno que se obtendr si se hacen reaccionar 175,7
g de sulfuro de hierro (II) y seala tu respuesta.
c) De acuerdo a la premisa dada en (b), cuntas moles de FeCl2 se producirn? Justifica tu
respuesta con clculos.
Rpta. a) 68 g H2S ; b) 2 mol FeCl2
25.Al hacer reaccionar calcio con cido clorhdrico se produce la siguiente reaccin.
Ca (s) + HCl (ac) CaCl2 (ac) + H2 (g)
Considera las siguientes masas atmicas y responde las preguntas.
Cl = 35,5; Ca= 40; H = 1
a)
b)
Balancea la ecuacin y escribe los coeficientes estequiomtricos.
Qu masa de HCl se necesitar para reaccionar con 20 g de Ca? Indica el procedimiento y,
en gramos, la respuesta.
c) Considerando los datos en la pregunta (b), qu masa, en g, de CaCl2 se formar? Seala el
procedimiento y la respuesta.
Rpta. b) 36,5 g HCl ; c) 55,5 g CaCl2
26.
El xido de magnesio es un compuesto que puede ser usado para el tratamiento de aguas
residuales y tambin en la industria de fertilizantes. Es producido a partir de la reaccin entre el
magnesio metlico y el oxgeno.
a) Escribe la ecuacin qumica balanceada.
b) Indica qu tipo de reaccin es.
c) Calcula las moles de magnesio y la masa de oxgeno necesarios para producir 180 g de MgO.
Rpta. c) 4,5 mol Mg y 72 g O2
PARA PRACTICAR EN CASA
1. Cuntos gramos de etanol (densidad=0,788g/mL) contienen 650mL de solucin de etanol al 28%
v/v?
Rpta: 143,42 g
2. Para analizar el contenido de oxgeno disuelto en el agua (un parmetro para medir contaminacin),
requieres preparar 150 mL de solucin 4M de cloruro de manganeso (II) MnCl2. Qu masa de
soluto disolveras? (MnCl2 masa molar: 126 g/mol)
Rpta: 75,6 g MnCl2
3.
El sulfato de cobre (II) CuSO4, se emplea comnmente para reducir el crecimiento de algas en
lagos, estanques y depsitos de agua. Una solucin acuosa que contiene 18% en masa de CuSO4
tiene una densidad de 1,208 g/mL.
a. Qu masa de esta sustancia se requiere para preparar 8 litros de una solucin que tiene 18%
en masa de CuSO4?
Rpta: 1739,52 g
b. Determina la molaridad de CuSO4 en esta solucin.
Rpta: 1,36 M
4
TALLER 4
QUIMICA EPE CE83
UPC 2016-1
4. Cmo prepararas 800mL de una solucin saturada de KNO3 a 10C sabiendo que la densidad
de dicha solucin es de 1,08 g/mL?
Rpta: Solubilidad 20g en 100g, entonces 144 g KNO3 en 720 g agua.
5. Para tu prctica de laboratorio requieres preparar una solucin de dicromato de potasio K2Cr2O7, si
a 80C mezcla 140 g de la sal con 250 g de agua, indica si se disolver toda la sal o si debers
calentar ms para disolver la mezcla. Justifica.
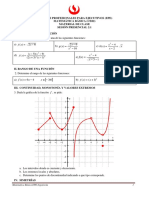
6. Utilizando el grfico de solubilidades de
diferentes sales, contesta:
120
110
c) Cul es la concentracin molar (mol/L) de
la solucin preparada en b)? Considera
que la solucin tiene una densidad de 1,15
g/mL.Dato:
masa
molar:
CuSO4=159,5g/mol
Rpta: 1,2 mol/L
100
s o lu b ilid a d (g s o lu to /1 0 0 g a g u a )
a) A 50C se tiene 80 g de sulfato de cobre
(II) (CuSO4) en 250 mL de agua, Qu tipo
de solucin se ha formado? Justifica tu
respuesta. Rpta: solucin insaturada
b) A 20C Cunto sulfato de cobre (II) como
mximo se podra disolver en 250 mL para
tener una solucin saturada? Justifica tu
respuesta.Rpta: 50 g CuSO4
90
80
KNO3
70
60
50
CuSO4
40
30
20
NaCl
10
0
0
10
20
30
40
50
60
70
80
90
100
te m p e r a tu r a (C )
N it r a t o d e p o t a s io
S u lf a t o d e c o b r e
C lo r u r o d e s o d io
7. Segn la teora cintico molecular. Cules son las caractersticas de un gas ideal?
8. En qu se diferencia un gas ideal de un gas real?
9. Dado que 6,9 moles del gas monxido de carbono estn presentes en un recipiente con un volumen
de 30,4 L, cul es la presin del gas (en atm) si la temperatura es de 62oC?
Rpta: 6,2 atm
10. Cierta cantidad de un gas est contenido en un recipiente de vidrio a 25oC y a una presin de
0,8 atm. Suponga que el recipiente soporta una presin mxima de 2 atm. Cunto se puede
elevar la temperatura del gas sin que se rompa el recipiente?
Rpta: 472C
11. El hielo seco es dixido de carbono slido. Una muestra de 0.050 g de hielo seco se coloca en un
recipiente vaco que tiene un volumen de 4,6 L a 30oC. Calcule la presin interior del recipiente
despus de que todo el hielo seco se ha convertido en CO2 gaseoso.
Rpta: 6.81x10-3 atm
12.
Para determinar la identidad de un hidrocarburo se le somete a un anlisis de densidad a 4
atm y 27C y da como resultado una densidad de 4,878 g/L. De qu hidrocarburo se trata:
CH4, C2H6, C3H8, C4H10? Rpta: C2H6
13. Qu volumen ocupan 12g de nitrgeno gaseoso a 3500 mmHg y 35C? Rpta: 2,35 L
14. Tenemos 4,8 g de SO3 y lo introducimos en un recipiente de 1 L y observamos que la presin que
ejerce a 27 C es de 1,5 atm.
a)
b)
c)
d)
Convierte la temperatura a grados Kelvin
Determine el nmero de moles de SO3
Determine la masa molar del SO3
Cuntos litros de SO3 hay a condiciones normales?
Rpta: 300.15 K
Rpta: 0.06
Rpta.: 80 g/mol
Rpta.: 1.34
5
TALLER 4
QUIMICA EPE CE83
UPC 2016-1
15. Balancea las siguientes ecuaciones y escribe los coeficientes estequiomtricos para cada
sustancia qumica. Asimismo, indica el tipo de reaccin.
a)
N2O5(g) NO2(g) + O2(g)
b)
C6H12(l) + O2(g) CO2(g) + H2O(g)
c)
Al2O3(s) + HCl(ac) AlCl3(ac) + H2O(l)
d)
NO2(g) +
H2O(l) HNO3(ac) + NO(g)
e)
C2H5OH(l) + Na(s) C2H5ONa(s) + H2 (g)
17.
El cido clorhdrico comercial se prepara tratando cloruro de sodio con cido sulfrico concentrado.
Esta reaccin produce, adems, sulfato de sodio. Responda la siguiente pregunta. Cuntos
kilogramos de cido clorhdrico se obtendrn si se utiliz 5102,04 mol de cido sulfrico? Recuerda
que debes escribir el procedimiento.
Rpta. 335,20 Kg HCl
18. El hierro reacciona con el oxgeno para formar xido frrico. Si se hace reaccionar un lingote de
hierro de 200 g, cuntos kg de xido frrico se obtendrn? Escribe el procedimiento y la
respuesta.
Considera las siguientes masas atmicas: Fe = 55,85; O = 16.
Rpta. 0,29 kg Fe2O3
19. El sodio es uno de los elementos muy reactivos y que al mezclarlo con agua se produce una
reaccin cuya ecuacin qumica es:
Na(s) + H2O(l) NaOH(ac) + H2(g)
a) Balancea e indica el tipo de reaccin.
b) Si reaccionan 460 g de sodio metlico, cuntos gramos de hidrxido de sodio y cuntas
moles de hidrgeno se formarn?
Rpta. b) 800 g NaOH y 10 mol H2
6
TALLER 4
Você também pode gostar
- Exámen Final de Q. G. Verano 2019 Turno MañanaDocumento7 páginasExámen Final de Q. G. Verano 2019 Turno MañanamariaAinda não há avaliações
- Examen Final FIISDocumento2 páginasExamen Final FIISMELISSA SONIA YACTAYO YARANGA100% (1)
- Problemas de Termodinamica 1 Ra LeyDocumento3 páginasProblemas de Termodinamica 1 Ra LeyOlfer ClarosAinda não há avaliações
- Guia de Practica N°3 Asociacion ResistenciasDocumento8 páginasGuia de Practica N°3 Asociacion ResistenciasMarco Antonio MendozaAinda não há avaliações
- S16.s1 - Material. Solucion en Serie de PotenciasDocumento27 páginasS16.s1 - Material. Solucion en Serie de PotenciasluisAinda não há avaliações
- Electro Qu Í MicaDocumento38 páginasElectro Qu Í MicaKaren Sofia Borja CamarenaAinda não há avaliações
- Material de Clase 2.2 RespuestasDocumento4 páginasMaterial de Clase 2.2 RespuestasRichard MamaniAinda não há avaliações
- Escalada en Hielo Tecnicas y Tactica (Interesante) PDFDocumento15 páginasEscalada en Hielo Tecnicas y Tactica (Interesante) PDFEstibaliz Duran Ruiz100% (1)
- ChayerosDocumento4 páginasChayerosEliel Samayoa67% (3)
- Química General Guía N°5 - rev0001Documento7 páginasQuímica General Guía N°5 - rev0001Wilson G. M.0% (1)
- Ciencias Básicas Aplicadas - ElectricidadDocumento3 páginasCiencias Básicas Aplicadas - ElectricidadLeandro Giraldo100% (1)
- ReglasKirchhoffLabFisicaDocumento7 páginasReglasKirchhoffLabFisicacesar zapata zuñigaAinda não há avaliações
- Reacciones Quimicas II-1 PDFDocumento8 páginasReacciones Quimicas II-1 PDFartu9712Ainda não há avaliações
- Examen de Entrada FQ - FISICOQUIMICA (37137)Documento3 páginasExamen de Entrada FQ - FISICOQUIMICA (37137)Miguel BaldeonAinda não há avaliações
- T - Sem 09 - Ses 10 - MicroTaller 05Documento7 páginasT - Sem 09 - Ses 10 - MicroTaller 05Alderan 512Ainda não há avaliações
- Hoja de Trabajo 13 FBDocumento3 páginasHoja de Trabajo 13 FBNina01 LoreAinda não há avaliações
- Microtaller de HoyDocumento7 páginasMicrotaller de HoyJosue Garcia AstocondorAinda não há avaliações
- Bobina secundaria: diámetro, espiras y frecuencia de resonanciaDocumento4 páginasBobina secundaria: diámetro, espiras y frecuencia de resonanciaJuan Jose Gonzales ContrerasAinda não há avaliações
- Ejercicio de Diagrama de FaseDocumento8 páginasEjercicio de Diagrama de Faseخافيير ألونسو شيروك كونتريراسAinda não há avaliações
- Taller Microeconomia RocioDocumento9 páginasTaller Microeconomia RocioROCIO OLIVAS LIFONZOAinda não há avaliações
- Taller 2 S5Documento3 páginasTaller 2 S5Antony Jesus Ynca NovaAinda não há avaliações
- MA420 Taller 5 vectores funciones cuadráticas optimizaciónDocumento3 páginasMA420 Taller 5 vectores funciones cuadráticas optimizaciónDārlēnē MüllerAinda não há avaliações
- T - Sem 08 - Ses 08 - Taller Examen ParcialDocumento3 páginasT - Sem 08 - Ses 08 - Taller Examen ParcialjuancitoAinda não há avaliações
- Utp Numeros Complejos RepasarDocumento17 páginasUtp Numeros Complejos RepasarAntony Bolivar RodriguezAinda não há avaliações
- Laboratorio Calificado 3Documento5 páginasLaboratorio Calificado 3Carlos Enrique Fernandez LlicahuaAinda não há avaliações
- Labo 3Documento18 páginasLabo 3Javier BL14Ainda não há avaliações
- 3 Actividad Asincronica Alumno2 2Documento2 páginas3 Actividad Asincronica Alumno2 2bl1tzAinda não há avaliações
- U5 - S7.Ficha de Trabajo 7 - Electroquimica PDFDocumento5 páginasU5 - S7.Ficha de Trabajo 7 - Electroquimica PDFjegonugaAinda não há avaliações
- Pcn°04a - Ed-2021-20Documento9 páginasPcn°04a - Ed-2021-20STEVE ALEX MANSILLA VIVASAinda não há avaliações
- S13 - Electroqu Mica 1 - CTDocumento15 páginasS13 - Electroqu Mica 1 - CTMoises Tordoya100% (1)
- Fisicoquimica EjerciciosDocumento3 páginasFisicoquimica EjerciciosJonathan Escalant SoloAinda não há avaliações
- 3.1 Taller 1 S222Documento7 páginas3.1 Taller 1 S222Luis Galvez CaballeroAinda não há avaliações
- TallORI S07 08 OyC 2020 1Documento4 páginasTallORI S07 08 OyC 2020 1jcaceresaleAinda não há avaliações
- Movimiento en Una DimensionDocumento12 páginasMovimiento en Una DimensionAbigail Flores0% (1)
- Laboratorio 1Documento17 páginasLaboratorio 1HENRYAinda não há avaliações
- Lab. 13 Leyes de KirchhoffDocumento3 páginasLab. 13 Leyes de KirchhoffJefferson RoseroAinda não há avaliações
- Ficha de Trabajo 7 - Electroquimica: Ejercicios y Evaluacion en Linea de Potenciales Estándar y No EstándarDocumento2 páginasFicha de Trabajo 7 - Electroquimica: Ejercicios y Evaluacion en Linea de Potenciales Estándar y No EstándarJuan Jose Gonzales ChumbesAinda não há avaliações
- Laboratorio Equivalente Mecanico Del CalorDocumento9 páginasLaboratorio Equivalente Mecanico Del CalorKatakuri CaceresAinda não há avaliações
- Segundo Avance - CAF2Documento11 páginasSegundo Avance - CAF2Daniel Serrano GalindoAinda não há avaliações
- Calorimetría y cambio de estadoDocumento56 páginasCalorimetría y cambio de estadoPablo Leo0% (2)
- Aaa Ecuaciones Diferenciales TerminadoDocumento18 páginasAaa Ecuaciones Diferenciales Terminadorivelino santrichAinda não há avaliações
- Medidas de Tendencia CentralDocumento64 páginasMedidas de Tendencia CentralKevin Olaya TrujilloAinda não há avaliações
- 08 - Estequiometria 1Documento19 páginas08 - Estequiometria 1Giancarlo FuentesAinda não há avaliações
- Oscilaciones Verticales de Una Caja FlotandoDocumento5 páginasOscilaciones Verticales de Una Caja FlotandoFernanda Andrea CedanoAinda não há avaliações
- T - Sem 08 - Ses 08 - Taller Examen Parcial PDFDocumento6 páginasT - Sem 08 - Ses 08 - Taller Examen Parcial PDFCarl JanAinda não há avaliações
- Fisica 1 Laboratorio 4Documento11 páginasFisica 1 Laboratorio 4Jean Pierre Auqui Tovar100% (1)
- Ejercicios Resueltos de QuimicaDocumento2 páginasEjercicios Resueltos de QuimicaEnrique PinazoAinda não há avaliações
- S18.s1 - Archivo Presentación Del Trabajo FinalDocumento10 páginasS18.s1 - Archivo Presentación Del Trabajo Finalgalleta oreoAinda não há avaliações
- 4 - Actividad Asincrónica - Alumno 1Documento2 páginas4 - Actividad Asincrónica - Alumno 1DAVID AARON DIAZ NIZAMAAinda não há avaliações
- S05. s1 - Separata de Ejercicios para Clase (Termodinamica)Documento19 páginasS05. s1 - Separata de Ejercicios para Clase (Termodinamica)AaronAinda não há avaliações
- Examen Final de Ciencia de Los Materiales I Mdl19-0130Documento5 páginasExamen Final de Ciencia de Los Materiales I Mdl19-0130Eduardo WinterAinda não há avaliações
- Taller de Cálculo y EstadísticaDocumento14 páginasTaller de Cálculo y EstadísticaBrt WswAinda não há avaliações
- (Clase 6) Conservación y No Conservación de La Energía (Ejercicios)Documento8 páginas(Clase 6) Conservación y No Conservación de La Energía (Ejercicios)Daniel Rios PrietoAinda não há avaliações
- Pepe 1Documento7 páginasPepe 1Jhon Jhampieer Gil HuamaniAinda não há avaliações
- Glab S05 Dfernandez 2022 1Documento5 páginasGlab S05 Dfernandez 2022 1Anderson Flores CabelloAinda não há avaliações
- EQUILIBRIO REDOX PROBLEMASDocumento7 páginasEQUILIBRIO REDOX PROBLEMASLee HansonAinda não há avaliações
- Exámen Parcial EstadisticaDocumento3 páginasExámen Parcial EstadisticaAnthony DominguezAinda não há avaliações
- Fisico Quimica Examen Parcial 2021-II-cuarto Semestre-Pirmer Consolidado.Documento5 páginasFisico Quimica Examen Parcial 2021-II-cuarto Semestre-Pirmer Consolidado.Enrique Pedraza LoazañoAinda não há avaliações
- Practica Calificada N°01 - Calculo Iii-2018 IDocumento4 páginasPractica Calificada N°01 - Calculo Iii-2018 IBrandy G. ReynaAinda não há avaliações
- S11.s2 - Poner en PrácticaDocumento4 páginasS11.s2 - Poner en PrácticaMarcelo Adrian GonzalesAinda não há avaliações
- SolparcDocumento5 páginasSolparcJULIO CESAR NUNEZ VILLAAinda não há avaliações
- Balotario Examen FinalDocumento4 páginasBalotario Examen Finalmiguel angel santa cruz ayalaAinda não há avaliações
- 06 - Taller 6 - Gases y SolucionesDocumento4 páginas06 - Taller 6 - Gases y SolucionesHector Tineo100% (1)
- Rescindir contrato transporte público usuarios mala calidad servicioDocumento4 páginasRescindir contrato transporte público usuarios mala calidad servicioRichard MamaniAinda não há avaliações
- EDRsemana1PPT Texto Académico RevisadofinalDocumento11 páginasEDRsemana1PPT Texto Académico RevisadofinalRichard MamaniAinda não há avaliações
- Material de Clase 1.2 RespuestasDocumento2 páginasMaterial de Clase 1.2 RespuestasRichard MamaniAinda não há avaliações
- S01 - PPT00 - Inducción A Las Actividades Blended - 2016-01Documento32 páginasS01 - PPT00 - Inducción A Las Actividades Blended - 2016-01Richard MamaniAinda não há avaliações
- Tabla de ConectoresDocumento1 páginaTabla de ConectoresRichard MamaniAinda não há avaliações
- Material de Clase 2.1 RespuestasDocumento3 páginasMaterial de Clase 2.1 RespuestasRichard MamaniAinda não há avaliações
- EDRsemana1PPTLectura RevisadofinalDocumento13 páginasEDRsemana1PPTLectura RevisadofinalRichard MamaniAinda não há avaliações
- Ruta de Aprendizaje CE82 Sem 2Documento1 páginaRuta de Aprendizaje CE82 Sem 2Richard MamaniAinda não há avaliações
- CE82 - 2016 - 1 - A Taller 2 SOLUCIONARIODocumento10 páginasCE82 - 2016 - 1 - A Taller 2 SOLUCIONARIORichard MamaniAinda não há avaliações
- CE82 Sesion 1.1Documento22 páginasCE82 Sesion 1.1Richard MamaniAinda não há avaliações
- CE82 Sesion 1.2Documento15 páginasCE82 Sesion 1.2Jurgen GabrielAinda não há avaliações
- Tabla de Conectores Lógicos y PuntuaciónDocumento1 páginaTabla de Conectores Lógicos y PuntuaciónRichard MamaniAinda não há avaliações
- UNIDAD 1fDocumento18 páginasUNIDAD 1fRichard MamaniAinda não há avaliações
- Casa 2 DDocumento1 páginaCasa 2 DRichard MamaniAinda não há avaliações
- MTA 2-ImpresionDocumento23 páginasMTA 2-ImpresionRichard MamaniAinda não há avaliações
- Casa 01Documento1 páginaCasa 01Pedro Alvarez SifuentesAinda não há avaliações
- Viernes Semana 4Documento8 páginasViernes Semana 4Richard MamaniAinda não há avaliações
- Herramientas de Precision - AutocadDocumento33 páginasHerramientas de Precision - AutocadEduardo Talla NegreirosAinda não há avaliações
- Guion Del Alumno Semana 1-2013-1Documento1 páginaGuion Del Alumno Semana 1-2013-1Richard MamaniAinda não há avaliações
- Tabla de potenciales estándar de reducción a 25°CDocumento1 páginaTabla de potenciales estándar de reducción a 25°CRichard MamaniAinda não há avaliações
- 01 Sistemas de CoordenadasDocumento5 páginas01 Sistemas de CoordenadasRichard MamaniAinda não há avaliações
- CE82 Clase Integral PC1 2016 1 ADocumento2 páginasCE82 Clase Integral PC1 2016 1 ADavidCarbajalLaMadridAinda não há avaliações
- Carta-Empresarial VFDocumento24 páginasCarta-Empresarial VFRichard MamaniAinda não há avaliações
- S24 DD6 Domino CineticaDocumento4 páginasS24 DD6 Domino CineticaRichard MamaniAinda não há avaliações
- Material de Clase 11Documento2 páginasMaterial de Clase 11Richard MamaniAinda não há avaliações
- Pasos para Crear Cuenta en Wikispaces3Documento2 páginasPasos para Crear Cuenta en Wikispaces3Richard MamaniAinda não há avaliações
- Material de Clase 11Documento2 páginasMaterial de Clase 11Richard MamaniAinda não há avaliações
- Pasos para Crear Cuenta en Wikispaces3Documento2 páginasPasos para Crear Cuenta en Wikispaces3Richard MamaniAinda não há avaliações
- Material de Clase 1.2Documento1 páginaMaterial de Clase 1.2Richard MamaniAinda não há avaliações
- Inmuno Practica 2Documento10 páginasInmuno Practica 2Coello trinidad bartolo100% (1)
- 3-Bizcocho GenovésDocumento2 páginas3-Bizcocho GenovésCristina FontelosAinda não há avaliações
- Fallos en La Tenencia ResponsableDocumento26 páginasFallos en La Tenencia ResponsableLicetPaolaMolinaGuzmanAinda não há avaliações
- Pae Cancer de TiroidesDocumento33 páginasPae Cancer de TiroidesLourdes MamaniAinda não há avaliações
- Teografia de Los SignosDocumento67 páginasTeografia de Los SignosRenny100% (1)
- In SumosDocumento32 páginasIn SumosAmarainy HerediaAinda não há avaliações
- Preguntas de Mecánica de FluidosDocumento29 páginasPreguntas de Mecánica de Fluidosomar anthonyAinda não há avaliações
- 4 Temperatura CorporalDocumento40 páginas4 Temperatura CorporalAdrïPändöräAinda não há avaliações
- Eco DrainDocumento5 páginasEco DrainMarcelo MorenoAinda não há avaliações
- Paso 2 - Dainy Medina - Grupo 403027 - 96Documento9 páginasPaso 2 - Dainy Medina - Grupo 403027 - 96Dainy Yulina Medina OspinaAinda não há avaliações
- Comprensión LectoraDocumento32 páginasComprensión LectoraPryscilla Ugas WisnarAinda não há avaliações
- Recurso 5 Analisis y Clasificacion de Los AceitesDocumento9 páginasRecurso 5 Analisis y Clasificacion de Los AceitesPaola Nicole Mendez GamezAinda não há avaliações
- ZF1.07.lex - It-Es ViajarDocumento2 páginasZF1.07.lex - It-Es ViajarHumberto Aguilar AAinda não há avaliações
- Instructivo Taller 5 - Investigación Psicologica y Comites de Etica.Documento5 páginasInstructivo Taller 5 - Investigación Psicologica y Comites de Etica.Gabriel GonzalezAinda não há avaliações
- Ginecología IIDocumento13 páginasGinecología IIMax Facundo RamirezAinda não há avaliações
- Qué Es La DislexiaDocumento2 páginasQué Es La DislexiaJhersonAinda não há avaliações
- CAPITULO I Hospital MilitarDocumento10 páginasCAPITULO I Hospital Militarcarolina100% (2)
- Relacion 2 Materia Sistema Sin 2013 2014Documento4 páginasRelacion 2 Materia Sistema Sin 2013 2014Roxy TacoAinda não há avaliações
- Psicología y Medición. Sir Francis Galton (1822-1911)Documento9 páginasPsicología y Medición. Sir Francis Galton (1822-1911)Ale RodriguezAinda não há avaliações
- Cadena Agroalimentaria Fresa PPRDocumento28 páginasCadena Agroalimentaria Fresa PPRBerenice GonzalezAinda não há avaliações
- CocinaSEODocumento4 páginasCocinaSEOCarlos YesielAinda não há avaliações
- Consulta Medico Familia Clase 4Documento20 páginasConsulta Medico Familia Clase 4keytin16Ainda não há avaliações
- Mezclador Giratorio Cat RM500BDocumento24 páginasMezclador Giratorio Cat RM500BCarlos Alfredo LauraAinda não há avaliações
- Accesorios IndustrialesDocumento5 páginasAccesorios IndustrialesAngie CajasAinda não há avaliações
- Estructura de La PersonalidadDocumento4 páginasEstructura de La PersonalidadAnonymous DjGaIiQjwAinda não há avaliações
- Bromatología CarnesDocumento21 páginasBromatología CarnesKarina Rodríguez CrispínAinda não há avaliações
- Remedio para Curar Quistes en Los SenosDocumento7 páginasRemedio para Curar Quistes en Los SenosJolisber OrtizAinda não há avaliações
- Prev 095e Protección Colectiva para Huecos HorizontalesDocumento2 páginasPrev 095e Protección Colectiva para Huecos HorizontalesAnxo Cancelo PérezAinda não há avaliações