Escolar Documentos
Profissional Documentos
Cultura Documentos
FORMULARIO de FISICOQUIMICA - Anderson Portilla Benavides - Academia
Enviado por
Matías Bordones VergaraTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
FORMULARIO de FISICOQUIMICA - Anderson Portilla Benavides - Academia
Enviado por
Matías Bordones VergaraDireitos autorais:
Formatos disponíveis
2/9/2015
(1) (1) FORMULARIO DE FISICOQUIMICA | Anderson Portilla Benavides - Academia.edu
1
Search...
HOME
ANALYTICS
SESSIONS
UPLOAD PAPERS
FORMULARIO DE FISICOQUIMICA
UPLOADED BY
TRENDING
VIEWS
INFO
A. Portilla Benav...
top 2%
499
more
DOWNLOAD
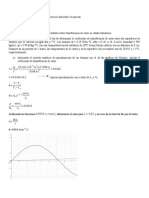
1ra LEY DE LA TERMODINAMICA
LAS LEYES DE LOS GASES
p1 v1
(n y T constantes)
p2v 2
p1
p2
T1
T2
pV
nRT
pe t V
nRT ln
(n y p constantes)
pT
dU
(Ley de Dalton de presiones parciales)
pi
an
(V
Z 1
nb)
V V
1 Bp Cp
(Factorde compresibilidad)
nRT
B
3
(Ec. de an der Waals)
...
cp
(Ec. irial)
V
2
Dp
... (Ec. irial)
T
H
T
E trans
vrms
2NA
3KBT
m
KBT (Energia cinetica promedio)
(Trab. de e p. isotermica re . de gas
(Primera ley de la termodinamica)
(Def. de entalpia)
(Capacidad calorifica a olumen constante)
(Capacidad calorifica a presion constante )
ncV T
(Cambio de energia interna)
ncp T
(Cambio de entalpia)
cp
cV
p1V1
nR
p2V2
V
rH 2
(Diferencia de capacidades calorificas de una gas)
3RT
p1
TEORIA CINETICA DE LOS GASES
p2
(Primera ley de la termodinamica)
pV
cV
pV
RT
pV
nRT
nRT ln
V1
dW
dq
V2
q W
(Ec. de gases ideales)
(Trabajo de e pansion irre ersible de una gas)
V
r H1
(E pansion adiabatica re ersible de un gas ideal)
f
H
f
( productos )
(Entalpia de reaccion estandar)
( reactivos)
c p (T2
EE( reactivos )
T1 ) (Ley de Kirchhoff)
EE( productos ) (Entalpia de reaccion estandar)
3RT
(Raiz de la elocidad cuadrada media)
M
file:///Users/matiasbordonesvergara/Downloads/(1)%20FORMULARIO%20DE%20FISICOQUIMICA%20_%20Anderson%20Portilla%20Benavides%20-%20Academia.edu.html
1/3
2/9/2015
(1) (1) FORMULARIO DE FISICOQUIMICA | Anderson Portilla Benavides - Academia.edu
dN
N
dN
2 E
Report Work
2da LEY DE LA TERMODINAMICA
2 K T
1
1/2
mc 2 /2 KBT
dc (Distr. de rapidez de Ma
ell)
KB ln(W)
ZN
2
N
2
d c V
2
(Frecuencia de colisiones)
2 d 2 ( N / V)
mc
2
3 2 d
r1
M2
r2
M1
(Velocidad mas probable)
2 d c
(Numero de colisiones binarias)
N1
(Cambio de entropia debido a e p. isot. de un gas)
(Def. termodinamica de la entropia)
(Def.termodinamica de la entropia)
T2
eficiencia
T1
mi
R[nA ln(
fusH
Tf
fus
vap
vap
Tf
S2
S1
ST
S0
(Capacidad calorifica a olumen constante)
r
VS
(Cambio de entropia debido a la fusion)
T2
nCp ln
Cp
T
dT
dAsis
VS
(Def. de la energia de Helmholtz)
(A T y Vconstantes)
dU
TdS
pdV (Cuando se combinan la 1ra y la 2da leyes de termodinamica)
dG
Vdp
SdT
(Dependencia de G de T y p)
G=Wel ,ma
G
(Cuando G se relaciona con el trabajo electrico)
V
( reactivos )
(Entropia estandar de reaccion)
SOLUCIONES ELECTROLITICAS
1000cm3
(A T y p constantes)
TS
A
U T S
(A T y V constantes)
(Cuando A se relaciona con trabajo ma imo)
A Wrev
(Entropia de tercera ley)
( productos )
H TS (Def. de la energia de Gibbs)
dGsis
(Cambio deentropia debido a calentamiento a presion ctt
T1
Y SUS APLICACIONES
A U
)] (Cambio de entropia deb ido a mezclado isot.)
(Ley de distribucion de Boltzmann)
LAS ENERGIAS DE GIBBS Y DE HELMHOLTS
G
(Cambio de entropia debido a la e aporacion)
(Segunda ley de la termodinamica)
) nB ln(
(Leyes de Graham de difusion y efusion)
E / KBT
(Eficiencia termodinamica)
T2
Salr 0
S sist
T1
T2
Suniv
(Viscocidad de los gases)
T
e
T
dqrev
(Trayectoria media libre)
U
cV
N2
qrev
dS
2 T
Z1
ell)
(Velocidad media o premedio)
8KBT
2
dE (Dist. de energia de Ma
8 RT
cmp
E / KBT
(Ec. de Bolzmann)
V2
V1
nR ln
3/2
KBT
8KBT
ell)
3/2
(Distr. de elociades de Ma
dv
mv 2 /2 K BT
2 KBT
4 c
N
dN
1/2
G
f
G / T
(Cambio de la energia estandar de Gibbs en una reaccion)
( prod )
(Ec. de Gibbs - Helmholtz)
2
0
( c)
1/v
1/v
(a a )
1
2
(Molalidad ionica media)
(Acti idad ionica media)
(Definicion de
1/v
mi zi
(Coef. de la acti i dad i onica medi a)
(Fuerza ionica)
log
0.509 z z
file:///Users/matiasbordonesvergara/Downloads/(1)%20FORMULARIO%20DE%20FISICOQUIMICA%20_%20Anderson%20Portilla%20Benavides%20-%20Academia.edu.html
p
(Ley de dilusion de Ost ald)
(Ley de Coulumb)
(m v m v )
1
0
0 r2
(Conductancia molar o equi alente)
(Ley de Kohlrausch de imigracion independiente)
qNa qCl
1
k0
( reac )
T2
(Ley limite de Debye-Hckel)
2/3
2/9/2015
(1) (1) FORMULARIO DE FISICOQUIMICA | Anderson Portilla Benavides - Academia.edu
log
0.509 z z
S
p2
log
0.509 z z
(Cambio en G debido al cambio en p)
nRT
ln
S0
p1
G
dp
dT T V
ln
(Ec de Clapeyron)
(T2
H
p1
RT
p 2
U
l
T
T
ln
(Rel. ent re
RT ln Q
rG
f
p
G y Kp )
(Cambio de energia Gibbs de una
(Coef. de fugacidad)
K2
K1
(Fuerza restauradora de una banda de hule estirada)
RT ln Kp
rG
(Regla de fases)
S
(Efecto salino secundario)
EQUILIBRIO QUIMICO
(Ec. de Clausius - Clapeyron)
ctte
(Ley limite de Debye-Hckel)
I (Efecto salino primario)
k I
S0
(Ec. de Clausius - Clapeyron)
T1T2
T1 )
log
(Energia molar de Gibbs de un gas)
1_bar
p2
ln(p )
f
RT ln
T2
ln K
T1
(Ec. de an t Huff)
T2T1
S
(Ec. de an t Huff)
SOLUCIONES NO ELECTROLITICAS
V
n2V2
n1V1
Gi
G
nRT (
mez
nR (
pi
i pi
U1 (l ) U 1* ( l)
p
Job Board
About
(Def. de potencial quimico)
G
ni
mez
Press
(Volumen de una solucion)
Ti Pn
i i
1
1
ln
ln
ln
ln
2
2
) ( Energias de Gibbs del mezclado)
) (Entropia del mezclado)
ELECTROQUIMICA
E
(Ley de Raoult)
RT ln
(Pot. quimico del ste en soln. ideal)
(Ley de Henry)
Blog
People
Terms
Privacy
Ec ato do
rG
Copyright
Ea no do (Fem estandar de una celda)
vFE
G
r
vF
RT ln K
We're Hiring!
(Rel.
G con la Fem de una celda)
(Rel.
G con la Fem estandar de una celda)
Help Center
Academia 2015
file:///Users/matiasbordonesvergara/Downloads/(1)%20FORMULARIO%20DE%20FISICOQUIMICA%20_%20Anderson%20Portilla%20Benavides%20-%20Academia.edu.html
3/3
Você também pode gostar
- Formulario FISICOQUIMICADocumento2 páginasFormulario FISICOQUIMICAquiron001100% (1)
- Problem As Re Sueltos 1 Er Parcial BDocumento10 páginasProblem As Re Sueltos 1 Er Parcial BMissael AlvarezAinda não há avaliações
- Problemasresueltos 1 ErparcialbDocumento10 páginasProblemasresueltos 1 ErparcialbLeiner Amilcar Rios VictorioAinda não há avaliações
- Aplicacione de Variable Compleja en La Ingenieria MecatronicaDocumento10 páginasAplicacione de Variable Compleja en La Ingenieria MecatronicaViToAinda não há avaliações
- Momentum, Fluidos y ViscosidadDocumento21 páginasMomentum, Fluidos y ViscosidadGabriel QuirozAinda não há avaliações
- Propiedades y Tablas Termodinamicas PDFDocumento32 páginasPropiedades y Tablas Termodinamicas PDFRosa Luz Quintanilla ChavezAinda não há avaliações
- 1.2. Agua y Fluidos Newtonianos - C2Documento67 páginas1.2. Agua y Fluidos Newtonianos - C2Abel Valderrama PerezAinda não há avaliações
- EDO - IntroducciónDocumento12 páginasEDO - IntroducciónFelipe PerezAinda não há avaliações
- PRESENTACION ElectroquímicaDocumento89 páginasPRESENTACION ElectroquímicaJorge Miranda BernalAinda não há avaliações
- La Prueba de Fra en TransformadoresDocumento32 páginasLa Prueba de Fra en TransformadoresmhrandersonAinda não há avaliações
- Balance de Materia y Energia en Un Reactor Tubular Adiabatico de Lecho Fijo Con Difusión RadialDocumento37 páginasBalance de Materia y Energia en Un Reactor Tubular Adiabatico de Lecho Fijo Con Difusión Radialsteve19826Ainda não há avaliações
- Modelo CSTRDocumento16 páginasModelo CSTRClaudio Ayala BravoAinda não há avaliações
- EstequiometriaDocumento18 páginasEstequiometriaDaniel LautaroAinda não há avaliações
- Formulario FisicoquimicaDocumento2 páginasFormulario FisicoquimicaRodrigo NaganoAinda não há avaliações
- Temario - M3T1 - Hidráulica Industrial I - CEDocumento98 páginasTemario - M3T1 - Hidráulica Industrial I - CEjherssonAinda não há avaliações
- Formulario Física IIDocumento5 páginasFormulario Física IIBetilloAinda não há avaliações
- Formulario de FisicaDocumento3 páginasFormulario de FisicadennisquispeAinda não há avaliações
- Cinetica ElectroquimicaDocumento55 páginasCinetica Electroquimicajesus curichahuaAinda não há avaliações
- AletasDocumento12 páginasAletasDavid VelázquezAinda não há avaliações
- Escaleti - Losa Aligerada 1er Piso Zona de PuenteDocumento45 páginasEscaleti - Losa Aligerada 1er Piso Zona de PuenteCarlos Antonio García DávilaAinda não há avaliações
- Aplicación de Ecuaciones DiferencialesDocumento18 páginasAplicación de Ecuaciones DiferencialesJorge AraizaAinda não há avaliações
- EB22Documento15 páginasEB22Isabel OropezaAinda não há avaliações
- 6 - HumidificacionDocumento32 páginas6 - HumidificacionBruce VanceAinda não há avaliações
- Presentacion Mi 76a 2007 Color 992 LightDocumento89 páginasPresentacion Mi 76a 2007 Color 992 Lightfernanda.baezaAinda não há avaliações
- Ecuaciones de EstadoDocumento30 páginasEcuaciones de EstadoDarwinA.MillaAinda não há avaliações
- Transferencia de Masa en Freido Por Inmersión (Villa 2012)Documento8 páginasTransferencia de Masa en Freido Por Inmersión (Villa 2012)Medardo AnibalAinda não há avaliações
- Diseño de Reactores No Isotérmicos en Estado EstacionarioDocumento8 páginasDiseño de Reactores No Isotérmicos en Estado EstacionarioJulieth JiménezAinda não há avaliações
- Examen Parcial Q2Documento35 páginasExamen Parcial Q2NicoAinda não há avaliações
- Simulacion de Procesos Quimicos: Universidad Nacional Del Altiplano Facultad de Ingenieria QuimicaDocumento19 páginasSimulacion de Procesos Quimicos: Universidad Nacional Del Altiplano Facultad de Ingenieria Quimicaelia melayde rosello ccasaAinda não há avaliações
- Primera Ley de La TermodinámicaDocumento53 páginasPrimera Ley de La TermodinámicaJavier MejiaAinda não há avaliações
- 1ra. Ley-Gases Ideales AgericoDocumento17 páginas1ra. Ley-Gases Ideales AgericopatcyAinda não há avaliações
- Clase 4 - Flujo en Tubería Horizontal e InclinadaDocumento14 páginasClase 4 - Flujo en Tubería Horizontal e InclinadaJuan Quispe ConisllaAinda não há avaliações
- Formulario FísicaDocumento7 páginasFormulario Físicamarinacruz172002Ainda não há avaliações
- PRESIONDocumento312 páginasPRESIONIvonne GSaia100% (1)
- Diseño de Secciones Sometidas A Flexion CompuestaDocumento20 páginasDiseño de Secciones Sometidas A Flexion CompuestaADrian RDzAinda não há avaliações
- Formulario de Física IIIDocumento3 páginasFormulario de Física IIIMichele CarrilloAinda não há avaliações
- 07 - Entropia Sistemas Abiertos IDocumento40 páginas07 - Entropia Sistemas Abiertos Ijerzio15Ainda não há avaliações
- Formula RioDocumento17 páginasFormula RioCristian Lema BañaAinda não há avaliações
- D.T.blackstock - Fundamentals of Physical Acoustic (2000)Documento70 páginasD.T.blackstock - Fundamentals of Physical Acoustic (2000)ivansendacross5221Ainda não há avaliações
- Formulario FisicoquimicaDocumento9 páginasFormulario FisicoquimicaMeli Arazelly CazerezAinda não há avaliações
- Segundo Examen Ciclos Termodinamicos 2021 - 1Documento6 páginasSegundo Examen Ciclos Termodinamicos 2021 - 1Andrés Lasso SAinda não há avaliações
- Examen Parcial 2 - FDS 2022Documento8 páginasExamen Parcial 2 - FDS 2022Cristian TorresAinda não há avaliações
- Tema 1 Viscosidad y Mecanismo Del Transporte de Cantidad de Movimiento Ley de Newton de La Viscosidad Fluidos No NewtonianosDocumento19 páginasTema 1 Viscosidad y Mecanismo Del Transporte de Cantidad de Movimiento Ley de Newton de La Viscosidad Fluidos No NewtonianosJose Luis EscobarAinda não há avaliações
- Ecuaciones de Estado y Factores CruzadosDocumento21 páginasEcuaciones de Estado y Factores CruzadosJosé Luis LMAinda não há avaliações
- Examen Parcial Q2Documento34 páginasExamen Parcial Q2Brenda Mirella Ore Gutierrez0% (1)
- Asignación 5Documento4 páginasAsignación 5Grecia Cajigas VelásquezAinda não há avaliações
- Ensayo Transformadores Filpra02MEEDocumento12 páginasEnsayo Transformadores Filpra02MEEJesus VivasAinda não há avaliações
- Tablas y Diagramas TermodinamicosDocumento24 páginasTablas y Diagramas TermodinamicosJose SifontesAinda não há avaliações
- Formulario TADocumento3 páginasFormulario TAThomasPolhAinda não há avaliações
- Proyecto OptimizaciónDocumento11 páginasProyecto OptimizaciónDanielaMoralesAinda não há avaliações
- Formulario FisicoquimicaDocumento2 páginasFormulario FisicoquimicaKarensita Andrea100% (4)
- Electro Exp 4Documento17 páginasElectro Exp 4cristianAinda não há avaliações
- Ingeniería química. Soluciones a los problemas del tomo INo EverandIngeniería química. Soluciones a los problemas del tomo IAinda não há avaliações
- Experiencias sobre circuitos eléctricos en serie operados por corriente directaNo EverandExperiencias sobre circuitos eléctricos en serie operados por corriente directaAinda não há avaliações
- Problemas resueltos de Hidráulica de CanalesNo EverandProblemas resueltos de Hidráulica de CanalesNota: 4.5 de 5 estrelas4.5/5 (7)
- Casos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSNo EverandCasos de estudio de termodinámica: Solución mediante el uso de ASPENHYSYSNota: 4.5 de 5 estrelas4.5/5 (7)
- Modelamiento y casos especiales de la cinética química heterogéneaNo EverandModelamiento y casos especiales de la cinética química heterogéneaNota: 3 de 5 estrelas3/5 (1)
- Unidad Química de MasaDocumento17 páginasUnidad Química de MasamarceloAinda não há avaliações
- Ejercicios de Química AnalíticaDocumento3 páginasEjercicios de Química AnalíticaJhonatan LigueAinda não há avaliações
- Ejemplo Verificacion Riesgo de Condensacion IRAM 11625Documento15 páginasEjemplo Verificacion Riesgo de Condensacion IRAM 11625Miguel HerreraAinda não há avaliações
- Descenso TérmicoDocumento7 páginasDescenso TérmicoalexisAinda não há avaliações
- Actividad 1. Ciclo de Refrigeracion.Documento4 páginasActividad 1. Ciclo de Refrigeracion.jezmar lamontAinda não há avaliações
- Diapos No ElectroliticasDocumento50 páginasDiapos No ElectroliticasNéstor Bazán ArribasplataAinda não há avaliações
- Tarea 1.1.3Documento32 páginasTarea 1.1.3joseAinda não há avaliações
- Syllabus Fisico QuimicaDocumento4 páginasSyllabus Fisico QuimicaJuan Manuel Rojas HuayanayAinda não há avaliações
- Presion Vap. de Liq. (Grupo 1)Documento34 páginasPresion Vap. de Liq. (Grupo 1)edwar ricardoAinda não há avaliações
- Calculos QuimicosDocumento20 páginasCalculos QuimicosAlison AliAinda não há avaliações
- FQ Ejercios ResueltosDocumento8 páginasFQ Ejercios ResueltosCes KratesAinda não há avaliações
- Informe 4Documento14 páginasInforme 4miltonAinda não há avaliações
- Problema 2.3 CarberryDocumento4 páginasProblema 2.3 CarberryAbner LugoAinda não há avaliações
- EJERCICIOS-SOLUCIONESDocumento3 páginasEJERCICIOS-SOLUCIONESGabriel atrapa hackersAinda não há avaliações
- Geometria Analitica - Charles H. LehmannDocumento1 páginaGeometria Analitica - Charles H. Lehmannmaria estherAinda não há avaliações
- Planificacion Quimica Lapso III 3ero, 4to y 5to..Documento7 páginasPlanificacion Quimica Lapso III 3ero, 4to y 5to..Unidad Educativa Nacional Hermano Juan67% (3)
- Previo 2 Lqgii Tarea Previa de La Practica 2Documento12 páginasPrevio 2 Lqgii Tarea Previa de La Practica 2Frida Arroyo ChavarriaAinda não há avaliações
- Formulario Termodinamica ITCHDocumento19 páginasFormulario Termodinamica ITCHOscar canoAinda não há avaliações
- Tarea para Enviar III SEMESTREDocumento6 páginasTarea para Enviar III SEMESTRECarlos Bruno TolenAinda não há avaliações
- Refrigeracion y Aire Acondicionado - IEM - 67 - V3Documento5 páginasRefrigeracion y Aire Acondicionado - IEM - 67 - V3Walter RuedaAinda não há avaliações
- Reacciones QuimicasDocumento4 páginasReacciones QuimicasHQ MadelyAinda não há avaliações
- Balance de Materia Caldera ListoDocumento5 páginasBalance de Materia Caldera ListoYasna Fritz CifuentesAinda não há avaliações
- Serie de Reactores Con Reacciones Múltiples PDFDocumento48 páginasSerie de Reactores Con Reacciones Múltiples PDFgetsemaniAinda não há avaliações
- INFORME 4 (Preparación de Disoluciones)Documento13 páginasINFORME 4 (Preparación de Disoluciones)Leslie Garcia100% (1)
- Termodinamica de Soluciones MulticomponenteDocumento48 páginasTermodinamica de Soluciones Multicomponenterosario AspeAinda não há avaliações
- Aplicación de Modelos TermodinámicosDocumento24 páginasAplicación de Modelos TermodinámicosLalo Cortes EspinosaAinda não há avaliações
- Instrucciones Termostato Digital Garza 400606Documento11 páginasInstrucciones Termostato Digital Garza 400606susanaAinda não há avaliações
- Unidad 2. Ejemplo 11 Clase 03.04.20Documento5 páginasUnidad 2. Ejemplo 11 Clase 03.04.20Sergio Daniel Valencia CartagenaAinda não há avaliações
- Patologias EdiliciasDocumento30 páginasPatologias EdiliciasJack SuquitaAinda não há avaliações
- Guia Cinetica EstudianteDocumento5 páginasGuia Cinetica EstudianteLuis FuenmayorAinda não há avaliações