Escolar Documentos
Profissional Documentos
Cultura Documentos
Unidad 06
Enviado por
Gabriela35sanTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Unidad 06
Enviado por
Gabriela35sanDireitos autorais:
Formatos disponíveis
UTN F r a
Enzimas
Introduccin a Catlisis
Un catalizador es una sustancia que afecta la velocidad de una reaccin, permaneciendo sin cambio alguno al
final del proceso. Generalmente, el catalizador modifica la velocidad promoviendo una ruta molecular distinta
para la reaccin, es decir, con el uso del catalizador la reaccin ocurre a travs de otro mecanismo.
Sabemos que para que una reaccin tenga lugar se deben romper algunos enlaces qumicos en los reactantes
permitiendo la formacin de productos. La mnima energa requerida para iniciar una reaccin qumica es la
energa de activacin Ea.
Figura n1: Reaccin no catalizada
Se observa en la figura, que la energa de activacin Ea es la diferencia de energa que existe entre los reactivos
y el estado de transicin, mientras que la entalpa de reaccin H es la diferencia de energa entre reactivos y
productos.
Como ya se dijo, un catalizador hace posible la obtencin del producto final por un mecanismo distinto, cuya
barrera energtica es ms baja que la correspondiente a la reaccin no catalizada. Considerando la ecuacin de
Arrhenius, segn la cual la constante de velocidad es k=A e-Ea/RT, vemos que al disminuir Ea para una
temperatura fija el valor de k aumenta, por lo tanto aumenta la velocidad de reaccin.
Figura n2: Reaccin catalizada y no catalizada
Ing. Bernarda Mancuello - 1/26
Como se puede ver en la figura anterior, H no se modifica con la presencia del catalizador.
Finalmente, resulta importante dejar en claro que los catalizadores pueden aumentar la velocidad de reaccin,
pero no modifican el equilibrio termodinmico, no hacen que una reaccin no favorable sea favorable. El nico
efecto de un catalizador es reducir la energa necesaria para que la reaccin ocurra.
Generalidades de las enzimas
Las enzimas son catalizadores biolgicos de naturaleza proteica. No son organismos vivos, sino que son
producidas por ellos para catalizar diversas reacciones que forman parte su metabolismo.
Son compuestos orgnicos de estructura compleja, esenciales en todo organismo vivo ya que los procesos
bioqumicos que ocurren en el mismo estn vinculados con el mecanismo de accin de una o varias enzimas
(sistemas enzimticos).
Las reacciones qumicas ocurren en los seres vivos a gran velocidad, en condiciones muy moderadas de
temperatura, pH y presin gracias a la existencia de las enzimas.
Las enzimas aumentan la velocidad de la reaccin disminuyendo la energa de activacin. O sea que la reaccin
ocurre a travs de un mecanismo en el cual la energa requerida para alcanzar el estado intermediario o de
transicin es menor, siendo suficiente para efectuar la transformacin qumica. Como todo catalizador, las
enzimas no modifican el cambio neto de energa (H) ni la constante de equilibrio.
Por ejemplo, para la siguiente reaccin vemos como disminuye la energa de activacin en medio cido, y an
en mayor medida en presencia de la enzima -fructofuranoxidasa:
Sacarosa Glucosa + fructuosa
Sin catalizador Ea = 32 Kcal/mol
+
Con H Ea = 26 Kcal/mol
Con -fructofuranoxidasa Ea = 9 Kcal/mol
Reacciones enzimticas
Reversibilidad de las reacciones enzimticas
Las reacciones catalizadas por enzimas son reversibles:
E + S ES E + P
Durante el transcurso de la reaccin la enzima debe unirse al sustrato para lograr su accin cataltica. Se unen
para formar un complejo activado, el cual luego se disociar en enzima y producto. Al final de la reaccin, la
enzima se separa del producto permaneciendo inalterada. Generalmente la reaccin inversa es catalizada por la
misma enzima. La unin de la enzima al sustrato tiene lugar por interacciones inicas, puentes de Hidrgeno o
fuerzas de van der Waals.
La irreversibilidad de una reaccin significa que existe un equilibrio desfavorable, es decir, que uno de los
componentes de la reaccin reversible desaparece, ya sea por ser voltil o por formar una sustancia ms estable
como lo es un complejo. El grado de reversibilidad depende del cambio de energa libre de la reaccin, y es
independiente de las propiedades catalticas de la enzima.
La escisin de molculas orgnicas de estructuras complejas por la actividad enzimtica viene acompaada con
liberacin de energa. Comparando sobre una base molecular, las enzimas son mucho ms efectivas que otros
catalizadores, ya que el aumento en la velocidad de reaccin que provocan es mucho mayor.
El concepto general ms importante es entonces que la molcula de enzima forma un complejo inestable con
una o ms molculas de sustrato, el complejo se rompe en distintos fragmentos, uno de los cuales es el enzima
libre y el otro es el producto.
Ing. Bernarda Mancuello - 2/26
Especificidad
Se distinguen dos clases de sustancias que participan en las reacciones enzimticas: el sustrato y los productos.
Los microorganismos se desarrollan sembrndolos en variados tipos de sustratos nutritivos. Estos se
caracterizan por contener diversas sustancias que sern las fuentes de carbono, nitrgeno, azufre, fsforo y
otros elementos indispensables como minerales y micronutrientes.
Generalmente los procesos industriales de fermentacin transcurren sobre medios de cultivos naturales que se
denominan medios de fermentacin, mostos o caldos de cultivo. Como fuentes de carbono encontramos
glucosa, almidn, maltosa, azcar invertido, sacarosa; melaza negra que es extraccin de la sacarosa de caa de
azcar y remolacha azucarera. Tambin hay presentes aminocidos, polipptidos. Subproductos de la
industrializacin agrcola pueden utilizarse como fuentes de protenas y derivados, mientras que el macerado
de maz se usa en obtencin industrial de antibiticos.
Una caracterstica fundamental de una enzima es su especificidad, que consiste en la direccin de la biocatlisis
sobre una sola direccin. Las enzimas son muy especficas para los reactivos o sustratos sobre los que actan, y
el grado de especificidad vara segn el sustrato. Algunas enzimas actan sobre un grupo de sustratos
relacionados y otras sobre un nico compuesto.
La especificidad de un sistema ES (enzima-sustrato), se ha descrito como un mecanismo de llave cerradura
que debe imaginarse como una combinacin de la forma estrica y la estructura de las cargas electrnicas.
Figura n3: Modelo llave-cerradura
La especificidad que caracteriza a las enzimas les permite distinguir con gran selectividad entre diferentes
sustancias, y an entre ismeros pticos, por lo cual se dice tienen estereoespecificidad. Por ejemplo, la
glucoquinasa cataliza la reaccin con D-glucosa y no acta frente a la L-glucosa. Tambin la especificidad de
las enzimas permite una mayor pureza en la obtencin de productos, a diferencia de las mezclas de productos
que se obtienen con otros catalizadores.
Entre otros ejemplos, destacamos la hidrlisis cataltica de la maltosa por la maltasa, y la hidrlisis cataltica de
la sacarosa por la enzima invertasa:
C22H22O12 + H2O 2 C6H12O6
maltosa maltasa glucosa
C12H22O12 + H2O C6H12O6 + C6H12O6
sacarosa invertasa glucosa fructuosa
(levulosa)
Sitio activo
El sustrato se une o se fija en un lugar definido de la molcula de la enzima. Esta regin de la enzima se llama
comnmente sitio activo, centro activo o sitio cataltico, responsable de la accin cataltica.
El sustrato posee un sitio de unin y sitio cataltico. Para que esta unin y la accin catalizadora tengan lugar,
es indispensable una conformacin tridimensional altamente especfica a nivel del sitio activo, con la presencia
de grupos funcionales definidos, aportados por las cadenas laterales de restos aminoacdicos.
Ing. Bernarda Mancuello - 3/26
Las evidencias sugieren que la cadena polipeptdica de la enzima se dobla de tal forma que un grupo de
aminocido reactivo como el aspartato, cistena, histidina, lisina, metionina, serina o treonina, se posiciona para
formar un sitio activo. Este sitio es la regin en la que se localiza la actividad cataltica de la enzima.
El sustrato se une a este sitio activo mediante varios enlaces dbiles que incluyen como ya se dijo puentes de
Hidrgeno, interacciones inicas, fuerzas de van der Waals, y ocasionalmente uniones covalentes, para formar
el complejo ES.
Generalmente, la relacin de tamao E/S es 500/1. Cuando se considera la formacin del complejo ES deben
tenerse en cuenta los tamaos muy diferentes de las sustancias que lo forman. El elevado peso molecular de
las enzimas contrasta con el peso molecular de los sustratos ms corrientes, como son mono y disacridos.
Una protena tiene un peso molecular de entre 50.000 y 100.000, mientras que un monosacrido de 180.
Por consiguiente la molcula de sustrato ocupar una pequea zona de la enzima, la cual corresponde a los
centros activos, cuya existencia se ha comprobado en algunos casos, y se encuentra en puntos ms o menos
prximos a la porcin protenica, en su forma helicoidal.
Tipos de enzimas
Endoenzimas y exoenzimas
Aquellas enzimas que se encuentran ligadas al protoplasma celular son llamadas endoenzimas, y actan en la
reaccin de descomposicin de mono y disacridos. Por otro lado, encontramos enzimas que son secretadas al
medio exterior de la clula, llamadas exoenzimas, que actan en la asimilacin de macromolculas como
polisacridos y protenas.
Nomenclatura y clasificacin de las enzimas
Existen tres distintas maneras en que suelen nombrarse a las enzimas:
1) agregando el sufijo -asa al nombre del sustrato sobre el cual acta la enzima. Por ejemplo:
Sustrato: almidn amilasa
Sustrato: urea ureasa
Sustrato: tirosina tirosinasa
2) Tambin puede denominarse por el tipo de reaccin que catalizan. Por ejemplo:
Dehidrogenasas: sustraccin de H+.
Descarboxilasas: eliminacin de grupos carboxlicos (-COOH) del sustrato.
3) Nombres comunes o trivial
Por ejemplo Ptialina: salival
Pepsina: jugo gstrico
Tripsina, Quimiotripsina: jugo pancretico.
Nomenclatura y clasificacin de la IUB
La Unin Internacional de Bioqumica (IUB) fija pautas para la clasificacin de las enzimas.
Ing. Bernarda Mancuello - 4/26
Consiste en un sistema de clasificacin con normas para asignar a cada enzima un nombre descriptivo y un
nmero que permite ubicarla inequvocamente.
En esta clasificacin se consideran seis clases principales de enzimas segn el tipo de reaccin que catalizan.
Cada una de estas clases se subdividen en:
Clase principal
Subclase
Subsubclase
N de orden
El n de cdigo consta de 4 componentes: 1 nmero: clase principal; 2 nmero: subclase; 3 nmero:
subsubclase; 4 nmero: n de orden de la enzima en su subsubclase.
Luego, se asigna un nombre sistemtico a cada enzima, se indica el nombre comn o trivial ms recomendado
y se da el n de cdigo.
Las seis categoras de enzimas que comprende la clasificacin internacional son las siguientes,
correspondiendo su numeracin al nmero de la clase principal: 1 oxidorreductasas, 2 transferasas, 3
hidrolasas, 4 liasas, 5 isomerasas y 6 ligasas.
Figura n4: Distribucin de todas las enzimas conocidas de acuerdo al nmero de su clase principal (1 oxidorreductasas, 2
transferasas, 3 hidrolasas, 4 liasas, 5 isomerasas, 6 ligasas).
1. Oxidorreductasas
Catalizan reacciones de xido reduccin. La mayora de estas enzimas son generalmente deshidrogenasas,
aunque tambin hay reductasas, oxidasas y peroxidasas entre otras.
Un ejemplo de una oxidorreductasa es la lactato dehidrogenasa. Esta enzima cataliza la oxidacin reversible del
L-lactato a piruvato, reaccin acoplada a la reduccin de la coenzima NAD+ (nicotinamida adenina
dinucletido).
Figura n5: Conversin reversible de L-lactato a piruvato por accin de la enzima lactato deshidrogenasa
Para este ejemplo, el nombre sistemtico de la enzima es L-lactato: NAD xidorreductasa. El nombre comn o
trivial recomendado es lactato-dehidrogenasa, su nmero de cdigo1.1.1.27:
Ing. Bernarda Mancuello - 5/26
1. 1. 1. 27
nmero de orden
subsubclase
subclase
clase principal
2. Transferasas
Catalizan transferencias de un grupo de tomos desde un sustrato a otro. Por ejemplo, las aminotransferasas y
las acetiltransfereasas catalizan el paso del grupo amino y acetilo respectivamente. A continuacin vemos la
transferencia de un grupo amino de la alanina para la formacin de piruvato y L-glutamato, catalizada por la
alanina transaminasa:
Figura n6: Transferencia de un grupo amino de la alanina para formar piruvato y L-glutamato por accin de la enzima alanina
transaminasa
El nombre sistemtico de esta enzima es L-alanina:2-oxiglutarato aminotransferasa, el nombre trivial
recomendado es alanina transaminasa, y su nmero de cdigo 2.6.1.2.
3. Hidrolasas
Catalizan la hidrlisis del sustrato. Son un grupo especial de transferasas donde el agua participa como aceptor
del grupo transferido. Pertenecen a este grupo acetilcolinoestereasa y la ribonucleasa, que hidrolizan la unin
ster entre acetato y la colina de la acetilcolina y las uniones entre nucletidos en el ARN respectivamente. Un
ejemplo sencillo de hidrolasa es la pirofosfatasa, que cataliza la conversin de un pirofosfato a dos grupos
fosfatos:
Figura n7: Conversin de pirofosfatos a grupos fosfato por accin cataltica de la enzima pirofosfatasa
Su nombre sistemtico es difosfato fosfohidrolasa, su nombre trivial pirofosfatasa, y su nmero de cdigo
3.6.1.1
4. Liasas
Catalizan la ruptura de molculas de sustrato por mtodos distintos que la hidrlisis, al generar un doble enlace.
Son reacciones de eliminacin, no hidrolticas y no oxidantes.
Ing. Bernarda Mancuello - 6/26
Por ejemplo, entre las aldolasas, la fructosa-bifosfato aldolasa divide la fructuosa-1,6-bifosfato en dos triosas
fosfato:
fructosa-bifosfato
aldolasa
Figura n8: Conversin de la fructosa-1,6-bifosfato en dos triosas fosfato por catlisis de una aldolasa
El nombre sistemtico de la enzima es fructosa-1,6-bifosfato:D-gliceraldedo-3-fosfato liasa, el nombre trivial
recomendado fructosa-bifosfato aldolasa, y su nmero de cdigo 4.1.2.13.
5. Isomerasas
Catalizan cambios estructurales dentro de la misma molcula, catalizan la interconversin de ismeros tanto
pticos, como geomtricos y de posicin. Como estas reacciones slo tienen un reactivo y un producto, son del
tipo de reaccin enzimtica ms simple.
Por ejemplo encontramos a la fosfoglucosa isomerasa que realiza la interconversin de glucosa-6-fosfato y
fructuosa-6-fosfato a fosfotriosa isomerasa. Otro ejemplo comn es la alanina racemasa que cataliza la
interconversin de L-alanina y D-alanina.
Figura n9: Interconversin de L-alanina y D-alanina por accin cataltica de la alanina racemasa
Su nombre sistemtico es en este caso igual a su nombre trivial, alanina racemasa, y su nmero de cdigo es
5.1.1.1.
6. Ligasas
Catalizan la unin de dos sustratos para formar un tercer compuesto ms complejo. En estas reacciones la
energa necesaria es provista por la hidrlisis de ATP. Por ejemplo, la glutamina sintetasa cataliza la unin de
cido glutmico y amonaco para la obtencin de glutamina:
Ing. Bernarda Mancuello - 7/26
Figura n10: Unin de cido glutmico y amonaco para la formacin de glutamina
El nombre sistemtico de esta enzima es L-glutamato: amoniaco ligasa (ADP), su nombre trivial es glutamina
sintetasa, y su nmero de cdigo 6.3.1.2.
Se puede acceder al nomenclador de enzimas de la IUBMB siguiendo este link, ingresando nmero de cdigo o
nombre de la enzima (en ingls), y obtener la reaccin que cataliza, nombres aceptados, nombre comn y otras
referencias: http://www.chem.qmul.ac.uk/iubmb/enzyme/
Naturaleza qumica de las enzimas
Las enzimas son de naturaleza proteica. Algunas pocas son protenas puras como por ejemplo la pepsina y
tripsina, las cuales por s mismas presentan actividad cataltica.
Otras estn asociadas a un cofactor, que puede ser un ion o una molcula orgnica compleja unida, llamada
grupo prosttico, o no unida llamada coenzima. El sistema complejo se llama holoenzima y est constituido
por la apoenzima que es la protena, termolbil y no dializable, y el cofactor que molcula no protenica,
termoestable. Para que la holoenzima tenga actividad cataltica, tanto la parte proteica como la no proteica son
indispensables.
Figura n11: Holoenzima Apoenzima + Cofactor
Cofactores: coenzimas, activadores, grupos prostticos
Coenzimas
Las coenzimas intervienen activamente en la reaccin experimentando cambios que compensan las
transformaciones sufridas por el sustrato.
Por ejemplo, las coenzimas de oxidorreductasas actan aceptando o cediendo los hidrgenos o electrones que
se le quitan o se le agregan al sustrato (NAD).
Las transferasas poseen coenzimas capaces de captar o ceder los grupos que se transfieren en la reaccin.
Iones metlicos o activadores
Generalmente Mg, Zn, Fe, Mn, Cu, Mo y Ca.
Ing. Bernarda Mancuello - 8/26
Compuestos orgnicos complejos
Nucletidos, como las coenzimas I y II, NAD, NADP, FAD y CoA.
Estructuras organometlicos
Actan como grupos prostticos, no pueden separarse con facilidad. Deriva de una estructura porfirnica, como
la hemina, es comn de algunas holoenzimas de la funcin respiratoria: citocromos y fermento de Warburg. Por
ejemplo, el grupo hemo, complejo de hierro asociado a la hemoglobina.
Vitaminas del grupo B
Suelen aparecer como cofactores de ciertas enzimas, entre ellas la vitamina B12, biotina, aneurina, flavina,
nicotinamida, ridoxal, cido pantotnico.
Determinacin de la actividad enzimtica
La actividad de una enzima se puede medir determinando la cantidad de producto formado o la cantidad de
sustrato consumido en un tiempo dado. Es necesario medir la velocidad inicial cuando el consumo de sustrato
no supere el 20%.
Como unidad de medida de la actividad enzimtica se utilizan las unidades internacionales UI. Una unidad de
cualquier enzima es la cantidad de enzima que cataliza la transformacin de un micromol (1 mol = 10 -6 mol)
de sustrato por minuto.
Una cantidad de enzima en un determinado volumen es igual a la concentracin de la actividad enzimtica:
UI/ml.
Factores que modifican la actividad enzimtica
La velocidad de una reaccin catalizada por una enzima depende:
a) Concentracin de enzima
b) Concentracin de sustrato
c) Temperatura del medio
d) pH del medio
e) Presencia de inhibidores
a) Concentracin de enzima
Si imaginamos una reaccin enzimtica simple en la cual un sustrato se convierte en producto por accin de
una enzima que cataliza la reaccin, la actividad enzimtica ser mayor cuanto mayor sea la cantidad de
enzima presente en el medio de reaccin. En una muestra, si queremos determinar la concentracin de enzima,
se utiliza un saturacin de sustrato, es decir que para cada enzima hay disponible sustrato con el cual formar el
complejo ES, y se mantienen constantes temperatura y pH. Las condiciones son medir la velocidad inicial, y no
consumir ms del 5% del sustrato.
Ing. Bernarda Mancuello - 9/26
Figura n12: Dependencia de la actividad enzimtica con la concentracin de enzimas
b) Concentracin del sustrato
Cintica de reacciones enzimticas con un sustrato
La cintica enzimtica simple se basa en tres principios experimentales:
1) El sustrato S forma un complejo intermediario ES con la enzima.
2) La velocidad instantnea de reaccin al tiempo t, es decir la velocidad de desaparicin del sustrato ds/dt, o
bien de la velocidad de formacin del producto, dp/dt se representa con la pendiente de la curva [P] o [S] en
funcin del tiempo t. Estas pendientes varan con el tiempo durante el curso de la reaccin, debido a la
desaparicin del sustrato.
Las mediciones cinticas se basan generalmente en la parte lineal de la curva, es decir, la velocidad inicial de la
reaccin. En esta regin, la concentracin del producto es extremadamente pequea y, en consecuencia la
descomposicin de producto a sustrato es insignificante.
E + S ES E + P
3) Para una concentracin dada de sustrato, la determinacin de la variacin en la velocidad de reaccin en
funcin de la concentracin de la enzima, no es lineal sino hiperblica. Esto se debe a que todo el sustrato est
en la forma de complejo ES, a altas concentraciones de la enzima. En consecuencia, la velocidad inicial de la
reaccin como funcin de la concentracin de la enzima permanece constante en estas condiciones.
Para mediciones de cintica es necesario trabajar en la regin lineal de la curva. Se debe mantener constantes la
concentracin de enzimas y otras condiciones del medio, excepto la concentracin de sustratos.
La ecuacin de Michaelis-Menten
Las reacciones catalizadas por enzimas pueden describirse en forma matemtica como ecuaciones de
velocidad. Estas reacciones exhiben cintica de saturacin, ya que a bajas concentraciones de sustratos, la
velocidad de la reaccin es proporcional a la concentracin de sustrato y luego, la reaccin es de primer orden
con respecto al sustrato. A medida que la concentracin de sustrato aumenta, la velocidad de la reaccin ya no
es proporcional a la concentracin de sustrato, sino que la reaccin es de orden mixto. A concentraciones an
ms altas la velocidad de la reaccin es constante e independiente de la concentracin de sustrato, la reaccin
es de orden cero y la velocidad es mxima.
Ing. Bernarda Mancuello - 10/26
Figura n13: Curva de la ecuacin de Michaelis-Menten
Estos factores llevaron a Michaelis y Menten a proponer una teora general de cinticas enzimticas. Esta teora
se basa en tres suposiciones:
1) que la concentracin de enzima es mucho ms baja que la concentracin de sustrato, de modo que el cambio
en la concentracin de sustrato durante la reaccin es insignificante.
2) que la concentracin de producto es cero, lo cual significa que la cantidad de P formado durante el perodo
de medicin de la velocidad es poco significativo y demasiado pequeo para que ocurra la reaccin inversa.
3) que la liberacin de S a partir del complejo ES es mucho ms rpida que la liberacin de los productos y, en
consecuencia, que E y S pueden considerarse en equilibrio.
Deduccin de la ecuacin de Michaelis- Menten
ES ES1 ES2 . EP1 EP2 .. E + P
De aqu en adelante llamaremos al complejo ES = A.
Luego la concentracin de enzima total presente en el medio se encuentra libre o formando complejo con el
sustrato: Et = E + A (1)
Este modelo cintico adopta la hiptesis de estado estacionario, por lo tanto la velocidad de formacin del
complejo enzima-sustrato es igual a su velocidad neta de descomposicin.
k1 [E] [S] - k2 [A] = k3 [A] - k4 [E] [P]
velocidad neta de formacin de A velocidad neta de descomposicin de A
Agrupamos de un lado de la igualdad los trminos [A] y del otro los trminos con [E]:
k1 [E] [S] + k4 [E] [P] = k2 [A] + k3 [A]
[E] (k1 [S] + k4 [P]) = [A] (k2 + k3)
[ A] k [ S ] k 4 [ P] k1[ S ] k [ P]
1 4 (2)
[E] k 2 k3 k 2 k3 k 2 k3
Ing. Bernarda Mancuello - 11/26
k 2 k3
Denominamos Km a la constante de Michaelis- Menten y se define como: Km
k1
Una de las suposiciones de las que partimos fue que la concentracin de producto es cero, luego [P]=0. Por lo
tanto reemplazando [P]=0 y Km en (2), e invirtindola:
[ E ] Km
[ A] [ S ]
Reemplazando en la ecuacin anterior por (1), segn la cual [E] = [Et] [A]:
[ Et ] [ A] Km
[ A] [S ]
Por lo tanto:
[ Et ] Km
1
[ A] [S ]
La velocidad mxima es proporcional a [Et]: Vmx k3 [ Et ] . La velocidad mxima es una constante para
cada enzima.
La velocidad real v es proporcional a [A]: v k3 [ A] .
Haciendo el cociente entre Vmx y v:
Vmx [ Et ] Km Km [ S ]
1
v [ A] [ S ] [S ]
Si despejamos v, obtenemos la ecuacin de Michaelis-Menten que describe el comportamiento hiperblico
observado en la curva:
Vmx[ S ]
v
Km [ S ]
Km es la concentracin de sustrato para la cual la velocidad de reaccin alcanza un valor igual a la mitad de la
velocidad mxima, en condiciones definidas del medio de pH, temperatura. Km tiene un valor fijo para cada
enzima y cada sustrato, y permite caracterizarla.
Cuando la concentracin de sustrato est por debajo de Km la velocidad de reaccin depende de la
concentracin de sustrato. Cuando [S] es muy superior al valor de Km la curva es de orden cero.
Si consideramos luego, [S] = Km y lo reemplazamos en la ecuacin de Michaelis-Menten se demuestra que
cuando la concentracin de sustrato [S] = Km, la velocidad de la reaccin es igual a la mitad de la Vmx:
Vmx[ S ] Vmx[ S ] Vmx[ S ] Vmx
v
Km [ S ] [ S ] [ S ] 2[ S ] 2
Significado de Km
En la mayora de las enzimas el valor de Km guarda una relacin inversa a la afinidad de la enzima por el
sustrato. A mayor afinidad de la enzima por un sustrato, menor es su valor de Km.
Cuando una enzima acta sobre varios sustratos Km es diferente para cada uno de ellos. El sustrato con Km
menor es considerado el sustrato natural o fisiolgico de la enzima.
Ing. Bernarda Mancuello - 12/26
Km es inversamente proporcional a la afinidad de la Enzima por el sustrato. Si se conoce el valor de Km es
posible establecer la velocidad de la reaccin (v) para cualquier concentracin de sustrato. Km es en realidad
una concentracin, luego est expresado en unidades de concentracin del sustrato: [moles/L] o [mg/L].
Representacin de los datos cinticos
La cintica de una reaccin caracterstica catalizada por una enzima con un solo sustrato es una curva
hiperblica donde es difcil determinar con precisin Vmx y tambin Km. Debido a esto se ha recurrido a la
linealizacin de la ecuacin de Michaelis- Menten para obtener estos parmetros con mayor facilidad.
Entre las formas linealizadas ms utilizadas encontramos la representacin de Lineweaver-Burk, y la de Eadie-
Hofstee:
Representacin de Lineweaver-Burk
Es la representacin usada con ms frecuencia, la ecuacin de Michaelis-Menten se transforma en las inversas
recprocas obtenindose una lnea recta.
1 Km [ S ] Km [S ]
v Vmx[ S ] Vmx[ S ] Vmx[ S ]
1 Km 1 1
v Vmx [ S ] Vmx
Se obtuvo una recta del tipo y=ax+b. Vemos que una grfica de 1/v contra 1/[S] produce una recta con
pendiente Km/Vmx, ordenada al origen 1/Vmx y abscisa al origen 1/Km.
Km
Pendiente =
Vmx
1
Ordenada al origen =
Vmx
1
Abscisa al origen =
Km
Figura n14: Representacin de Lineweaver-Burk
Esta representacin nos permite determinar los valores de Vmx y Km a partir de mediciones de actividad
enzimtica a varias concentraciones de sustratos.
Representacin de Eadie-Hofstee
Aunque es menos utilizada que la de Lineweaver-Burk, esta representacin de los datos cinticos se obtiene
multiplicando ambos miembros de la ecuacin de Lineweaver-Burk por Vmx y reordenando:
v
v Km Vmx
[S ]
Ing. Bernarda Mancuello - 13/26
Pendiente = Km
Ordenada al origen = Vmx
Vmx
Abscisa al origen =
Km
Figura n15: Representacin de Eadie-Hofstee
c) Efecto de la temperatura
Conforme aumenta la temperatura tambin lo hace la velocidad de la reaccin enzimtica, pero slo hasta
alcanzar un mximo a partir del cual la actividad enzimtica disminuye aunque la temperatura siga en aumento.
Esto se debe a la naturaleza proteica de las enzimas, por la cual con el aumento de temperatura la enzima puede
desplegarse y/o desnaturalizarse perdiendo su actividad cataltica.
Existe una temperatura ptima que es aquella para la cual la velocidad de la reaccin es mxima, y que se
encuentra en un intervalo de unos pocos grados centgrados. Si se supera esa temperatura la velocidad
comienza a disminuir, hasta que cesa la reaccin entre 70 y 100 C, zona de desnaturalizacin irreversible de
las protenas.
La mxima actividad de una enzima est muchas veces disimulada por ciertos factores concurrentes, que
impiden la determinacin de esta temperatura ptima. Los de mayor influencia son el grado de pureza de
enzima y sustrato y la presencia de activadores o inhibidores.
Figura n16: Efecto de la temperatura en la actividad enzimtica
En la variacin de la velocidad con la temperatura es aplicable la ecuacin de Arrhenius:
d (ln K ) Ea
dT R T 2
Ea 1
ln K cte
R T
Ing. Bernarda Mancuello - 14/26
K Ea T2 T1
ln 2
K1 R T2 T1
d) pH
A semejanza de lo que ocurre con la temperatura el concepto de pH ptimo tienen un valor poco real, pues un
conjunto de variables lo afectan: temperatura, tipo de solucin buffer presente, concentracin de sustrato,
presencia o no de activadores, tipo de sustrato.
La relacin de la actividad enzimtica con respecto al pH est expresada en la mayora de los casos, por una
curva en forma de campana como indica la figura siguiente para distintas enzimas.
Figura n17: Efecto del pH en la actividad cataltica de la pepsina, la tripsina y la fosfatasa.
Algunas enzimas presentan gran actividad cataltica a valores extremos de pH. Por ejemplo la pepsina presente
en el jugo gstrico tiene pH ptimo de 1,5, la fosfatasa cida tiene un pH ptimo 5 en la prstata, y la fosfatasa
alcalina tiene un pH ptimo de 9,5 en huesos y ciertos rganos.
Los cambios de pH del medio afectan el estado de ionizacin de ciertos grupos funcionales en la molcula de la
enzima y tambin en la del sustrato. Para que se realice la unin en el complejo ES es necesario una adecuada
distribucin de cargas en ambas molculas. El pH ptimo es aquel en el cual ciertos grupos esenciales poseen
la carga apropiada para asegurar la formacin del complejo ES en las mejores condiciones.
Los pH extremos provocan la desnaturalizacin de la molcula enzimtica con la consiguiente inactivacin.
En el efecto del pH sobre la ionizacin del sustrato o del producto merece especial atencin, el valor de la
constante de equilibrio aparente (Kap), con respecto al pH est basado en el caso especfico de la oxidacin (o
deshidrogenacin) del in lactato en presencia del DPN (difosfopiridn nucletido)
CH3CHOHCOO- + DPN CH3COCOO- + DPN.H2
in lactato in piruvato
En primer lugar se observa que por el incremento de una unidad de pH se duplica el valor de Kap. En segundo
lugar, la variacin de la concentracin de iones hidrgenos influye en la ionizacin del DPN.H 2 de la siguiente
manera
DPN.H2 DPN.H + H+ DPN + 2 H+
En un medio alcalino (pH = 10) sostenido por un sistema buffer, los iones H + se eliminarn del sistema en
equilibrio, completndose la reduccin de la coenzima, por consiguiente, se favorece la formacin de piruvato.
e) Inhibidores enzimticos
Los inhibidores son especies que interactan con las enzimas de forma tal que stas resultan ineficaces para
catalizar una reaccin, son agentes qumicos que inhiben su accin cataltica.
Ing. Bernarda Mancuello - 15/26
Estas sustancias se unen a sitios o grupos funcionales que participan en la catlisis o que son responsables de
asegurar los requerimientos estructurales para la unin ES.
La inhibicin puede ser reversible o irreversible
Inhibicin irreversible
Son inhibidores irreversibles aquellas sustancias que se unen covalentemente a la enzima produciendo un
cambio permanente en ella, dando lugar a un deterioro definitivo de su actividad cataltica.
Por ejemplo, venenos organofosforados muy utilizados como insecticidas producen la inhibicin irreversible de
la Acetilcolinesterasa, enzima muy importante para el funcionamiento del sistema nervioso.
Inhibicin reversible
Los inhibidores reversibles pueden ser de tres tipos: competitivos, no competitivos y anticompetitivos. El
mecanismo de accin de un inhibidor puede ser estudiado experimentalmente realizando determinaciones de
actividad enzimtica a varias concentraciones de sustrato en ausencia y en presencia de una concentracin fija
de inhibidor.
Inhibidores competitivos
En este tipo de inhibicin, el inhibidor slo puede unirse a molculas de enzima libre que no estn unidas a
sustrato alguno. Cuando este inhibidor se une a la enzima ya ninguna molcula de sustrato podr unirse a ella.
Por lo tanto, vemos que inhibidor I y sustrato S compiten por unirse a la enzima.
Figura n18: Inhibicin competitiva
Generalmente S e I se unen al mismo sitio de la enzima, el sitio activo. El inhibidor presenta similitud
estructural con el sustrato y ambos compiten por el sitio activo de la enzima. Por ejemplo, el ion malonato
acta como inhibidor competitivo de la succinato-deshidrogenasa:
Succinato-deshidrogenasa
- - -
OOCCH2CH2COO OOC-CH=CH-COO-
Succinato Fumarato
- -
OOC-CH2-COO
Malonato
El in malonato es un cido dicarboxlico de cadena lineal, pero con un carbono menos. Se supone que en el
centro activo de la succinato dehidrogenasa deben existir dos grupos con carga positiva que atraen a los dos
iones carboxlicos del succinato.
Otros dicidos que poseen la funcin COO- separada por una distancia adecuada como es el caso del
malonato y algunos otros cidos dicarboxlicos pueden adaptarse al sitio activo de la enzima. Esta no puede
dehidrogenar al malonato, pues su cadena carbonada no alcanza para formar la doble ligadura y por ello su
accin es bloqueada.
Ing. Bernarda Mancuello - 16/26
Una caracterstica de los inhibidores competitivos es que su efecto puede ser revertido aumentando la
concentracin de sustrato. Si este predomina tiende a desplazar al inhibidor de su unin con la enzima.
Los inhibidores competitivos aumentan el valor de Km pero no modifican la Vmx caracterstica de la enzima,
son el tipo ms frecuente de inhibicin.
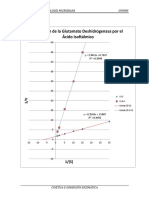
Figura n19: Curva de Michaelis-Menten y representacin de Lineweaver-Burk para inhibicin competitiva
La actividad es reducida por el inhibidor a concentraciones bajas de sustratos, pero a concentraciones muy
elevadas la actividad aumenta y se llega a la Vmx.
k1 k3
E + S ES E + P
+ k2 k4
I
KI= k6/k5
EI (bloqueo)
A partir de este esquema se llega a la expresin cintica que describe la inhibicin competitiva:
Vmx[ S ]
v
[I ]
Km1 [S ]
K I
Y la expresin de Lineweaver-Burk para inhibicin competitiva que se observa en el segundo grfico de la
figura n19:
1 1 1 Km [ I ]
1
v Vmx [ S ] Vmx K I
Siendo KI la constante de inhibicin y [I] la concentracin de inhibidor, denominamos como sigue a la
constante aparente de Michaelis-Menten, viendo el efecto de la inhibicin competitiva ya que Kmap > Km:
[I ]
Kmap Km1
K I
El inhibidor y el sustrato slo se pueden unir a la enzima E libre pues ambas se excluyen mutuamente. La
enzima unida al inhibidor es inactiva. El resultado aparente es como si hubiera una disminucin de afinidad de
la E por el sustrato (aumentando Km).
Ing. Bernarda Mancuello - 17/26
Los inhibidores competitivos han encontrado aplicacin farmacolgica. Algunos poderosos quimioteraputicos
antibacterianos son inhibidores de este tipo.
Muchos microorganismos patgenos sintetizan cido flico, factor esencial para su desarrollo siempre que
dispongan de cido p-aminobenzoico APAB. La sulfanilamida es un anlogo estructural del cido p-
aminobenzoico que acta como inhibidor competitivo en la sntesis de cido flico.
Figura n20: Anlogos estructurales
Inhibidores no competitivos
Son compuestos que se unen a la enzima en un lugar distinto al sitio activo y producen una disminucin de
Vmx sin modificar Km, ya que el sustrato puede unirse igualmente a la enzima.
Figura n21: Inhibicin no competitiva
No poseen similitud estructural con el sustrato. Por ejemplo, el salicilato inhibe competitivamente a la alcohol-
dehidrogenasa y a la 3-fosfoglicerato-quinasa.
El efecto de estos inhibidores no puede ser revertido con un aumento en la concentracin de sustrato.
Figura n22: Curva de Michaelis-Menten y representacin de Lineweaver-Burk para inhibicin no competitiva
Ing. Bernarda Mancuello - 18/26
E + S ES E + P
+ +
I I
KI KI
EI + S IES (catalticamente inactivo)
El inhibidor se une con la enzima libre o con el complejo ES. Una vez formado IES, la enzima se inactiva.
El valor de Km no se modifica pues el sustrato reacciona con la enzima lo mismo que en ausencia del
inhibidor. Pero la cantidad de ES con posibilidad de liberar producto se reduce y el resultado final es semejante
al que se obtendra con menos enzima en el medio, la Vmx disminuye.
Vemos a continuacin las expresiones de la cintica para la inhibicin no competitiva, donde K I es la constante
de inhibicin:
Vmx[ S ]
v
Km [S ]1 [ I ]
KI
Y reordenando se obtiene la expresin linealizada:
1 1 Km [ I ] 1 [I ]
1 1
v [ S ] Vmx K I Vmx K I
Pertenecen a esta categora ciertos reactivos que se unen reversiblemente a grupos sulfidrilos (-SH) de restos
de cistenas indispensables para la actividad de algunas enzimas. Ciertos iones metlicos como el Cu, Hg, Ag,
inhiben enzimas combinndose con grupos (-SH). La unin del in metlico provocara cambios
conformacionales que inactivan a la enzima.
Otros inhibidores se unen a metales de la molcula de enzima y produce inhibicin. Este es el mecanismo de
accin del CN- que al unirse al Fe de la citocromoxidasa, catalasa y peroxidasa, bloquea su actividad.
Otro ejemplo son el ion CN- y el CO que se combinan con el Fe de la citocromoxidasa y de la hemoglobina,
respectivamente.
El tetraacetato de etilendiamina EDTA es un agente quelante que se une en forma reversible a cationes
bivalentes e inhibe a enzimas que requieren esos iones para su actividad.
El in arseniato puede sustituir al PO32-, bloqueando su actividad.
Inhibidores acompetitivos
El inhibidor y el sustrato se fijan a diferentes sitios de la enzima, pero la unin de uno de ellos impide la del
otro, probablemente porque induce cambios conformacionales en la enzima. El inhibidor se une al complejo ES
para dar el complejo IES incapaz de transformarse en productos.
Figura n23:Inhibicin acompetitiva
Ing. Bernarda Mancuello - 19/26
E + S ES E + P
+
I
KI
IES (complejo inactivo)
Este tipo de inhibicin se da en casos en los cuales participan varios sustratos en la reaccin, no puede ser
revertido por aumento de la concentracin de sustrato.
Vemos a continuacin la expresin linealizada para la inhibicin acompetitiva:
1 1 Km 1 [I ]
1
v [ S ] Vmx Vmx K I
Figura n24: Curva de Michaelis-Menten y representacin de Lineweaver-Burk para inhibicin acompetitiva
Se observa una reduccin de la velocidad a todas las concentraciones de sustrato. La interseccin con los ejes
vertical y horizontal nos indica que el inhibidor produce disminucin tanto de la velocidad mxima como del
valor de Km.
A modo de conclusin, se resumen en el siguiente cuadro los efectos que producen en la actividad enzimtica
los tres tipos de inhibidores reversibles estudiados:
Ing. Bernarda Mancuello - 20/26
Tecnologa enzimtica
Las enzimas son productos de la biotecnologa, ya que se pueden separar en estado activo a partir de una clula
viva para luego ser usadas en otras reacciones. La obtencin de las enzimas comprende varias etapas:
1) Obtencin de la fuente apropiada:
Las enzimas pueden ser de origen microbiano, vegetal o animal.
a) Origen microbiano
Provenientes generalmente de bacterias y hongos. Entre ellas destacamos las enzimas del siguiente cuadro,
donde se indica el microorganismo del cual se obtienen.
Figura n25: Enzimas microbianas y su aplicacin
Las clulas microbianas son la fue ms empleada, ya que ofrecen mayor variedad debido a que puede inducirse
variaciones genticas. Esto permite obtener enzimas con mayor cantidad de parmetros deseables y una gran
velocidad de reproduccin.
De las clulas microbianas se obtienen endoenzimas producidas dentro del protoplasma celular, que catalizan
reacciones de sntesis, y exoenzimas son secretadas al medio exterior y participan en reacciones de hidrlisis o
degradacin.
b) Vegetal
Como ejemplos podemos nombrar las -amilasa que se obtiene del grano de la cebada,la peroxidasa de la raz
del rbano. La papana proveniente del ltex del rbol de papaya se utiliza para ablandar carnes y en la
clarificacin de la cerveza, y la ureasa que se obtiene de la soja.
c) Animal
Enzimas provenientes del bazo, hgado, pncreas o alguna seccin del tracto intestinal de bovinos o porcinos.
Por ejemplo la -amilasa, lipasa, pepsina y renina (para la manufactura de quesos) entre otras.
Las plantas y los rganos animales como fuentes de obtencin son muchos ms caros que las clulas
microbianas, por los largos perodos de crecimiento y la mayor dificultad para aislar las enzimas.
Vemos que para varias enzimas existen fuentes de obtencin microbiana, vegetal y tambin animal. Por
ejemplo:
Amilasas
Fuente microbiana: levadura de pan
Vegetal: malta de cebada
Animal: varios
Ing. Bernarda Mancuello - 21/26
Proteolticas
Fuente: animal, vegetal, microbiana
Se utilizan en las industrias de quesos, harinas, curtido de pieles, clarificacin de bebidas.
En curtiembre
Purga enzimtica: enzima proteoltica (pncreas), pH 8 9,
Tiene por objeto abrir las fibras y eliminar los restos de pelos que hayan quedado despus de la pelambre,
(despus del desencalado).
Lipasas
Degradan grasas por hidrlisis, se usan en las industrias de curtiembres, la industria alimenticia.
Ureasa
Urea + agua 2 NH3 + CO2
2) Aislamiento y purificacin
1- Obtencin del extracto bruto de la enzima (polvo de pncreas, levadura desecada).
2- Purificacin
a) Dilisis a travs de membranas semipermeables (derivado celulsico, colgeno).
b) Ultrafiltracin: bajo presin a travs de membranas.
3- Precipitacin fraccionada en fro con un disolvente orgnico (acetona, etanol, isopropanol) o SO4(NH4)2.
4- Concentracin
a) al vaco
b) refrigeracin
c) smosis inversa
5- Desecado
a) al vaco
b) rodillo
c) atomizacin
6- Dilucin con soporte inerte: celulosa, almidn, lactosa.
7- Estabilizacin: con estabilizadores apropiados, se ajusta a un grado de actividad definido.
3) Obtencin en estado ptimo para su empleo tecnolgico
Mtodos empleados en laboratorio
Obtencin de enzimas puras cristalizadas
- Filtracin por gel (poliacrilamida, agarosa).
- Cromatografa de intercambio inico.
- Electroforesis.
- Ultracentrifugacin.
Ing. Bernarda Mancuello - 22/26
- Cromatografa de afinidad
Consiste en ligar selectivamente a la enzima en una columna que contiene una sustancia que se une
especficamente a ella. Por ejemplo un inhibidor reversible en enlace covalente. Haciendo pasar una mezcla de
enzimas a travs de la columna, la enzima forma un complejo y queda retenida, las dems atraviesan la
columna. La enzima retenida se extrae con un eluyente adecuado.
El soporte apropiado: agarosa (polisacrido) laxa.
Los derivados de los geles de agarosa sustitudos son capaces de reaccionar unindose covalentemente a los
ligandos, por ejemplo:
R COOH R NH2 R OH
= grupo aromtico
Inmovilizacin de enzimas
Cualquier proceso biotecnolgico si usa organismos completos, extractos o enzimas purificadas debe competir
con la fermentacin o con la sntesis qumica.
Las enzimas a menudo son lbiles y no son fcilmente reutilizables, de modo que el concepto de enzimas
inmovilizadas en cuanto a los catalizadores reusables estabilizados tiene un gran atractivo en la intensificacin
del proceso, y por lo tanto afecta la economa de ste. La misma idea tambin se aplica a clulas completas.
Inmovilizar una enzima significa circunscribir su accin en un espacio definido y limitado en lugar de estar
dispersa (soluble) en todo el sustrato. La enzima as inmovilizada es ms estable que en solucin, fcilmente
recuperable al final de la reaccin y permite su re-uso. De esta manera se abren nuevas perspectivas para su
uso, especialmente para aplicaciones industriales puesto que representa una reduccin apreciable de costos.
En la siguiente figura se esquematiza el uso de las enzimas o clulas inmovilizadas para realizar ciertas
reacciones.
Figura n26: Utilizacin de las clulas y enzimas inmovilizadas
Bajo el concepto de inmovilizacin se agrupan procedimientos para fijar las enzimas en un espacio limitado
sobre una superficie limitada. Se conocen hasta ahora cuatro mtodos bsicos de inmovilizacin, con ms de
100 variables para los mismos.
a) Adsorcin sobre superficies slidas o membranas semipermeables.
b) Inclusin dentro de un gel.
c) Encapsuladas dentro de una membrana de permeabilidad controlada.
Ing. Bernarda Mancuello - 23/26
d) Unida por unin covalente a algunas macromolculas (soportes insolubles).
Un resumen de los cuales son presentados en el siguiente cuadro:
1. UNIN
Unin covalente a soportes insolubles
Adsorcin a soportes slidos
2. CAPTURA
Microencapsulacin
Dentro de un polmero
Entrecruzamiento a tra pa da en
Membranas semipermeables una ma tri z
Figura n27: Mtodos de inmovilizacin
Para el estudio de la cintica de las enzimas as inmovilizadas se hacen consideraciones similares a la cintica
de la catlisis heterogneas, analizando en cada caso, segn la enzima est unida a una superficie porosa o no
porosa.
En caso de que la enzima sea soluble, el nico tipo de reactor posible es el tanque agitado en proceso batch
(catlisis homognea).
Estando la enzima insolubilizada (catlisis heterognea), permite el uso de reactores diversos: tanque agitado
en proceso continuo o semicontinuo, columna rellena, reactor tubular en capa delgada y reactor de lecho fluido.
4) Desarrollo de los dispositivos apropiados para llevar a cabo los procesos tcnicos.
5) Comprobacin de ventajas: tcnicas o econmicas, frente a un proceso qumico.
Propiedades de las enzimas inmovilizadas
La caracterstica ms importante de una enzima en un proceso industrial es su estabilidad, medida por su vida
media. La vida media se define como el tiempo requerido para alcanzar una prdida del 50 % de la actividad
enzimtica.
La inmovilizacin de las enzimas mediante la unin en sitios mltiples incrementa su resistencia al calor,
tambin aumenta la resistencia a agentes desnaturalizantes, pH, etc.
Entre los problemas asociados con las enzimas inmovilizadas encontramos:
- Limitaciones difusionales (limitaciones internas debido a que los sustratos deben difundir dentro de un
soporte poroso).
- Impedimentos estricos.
Estos se solucionan reduciendo el tamao de las partculas, aumentando la concentracin de sustrato,
aumentando la porosidad de la cama, reduciendo la profundidad de la capa lmite.
Procesos industriales que utilizan enzimas inmovilizadas.
a) Conversin de glucosa a fructuosa mediante una glucosa-isomerasa, con lo cual se incrementa el poder
edulcorante.
b) Hidrlisis enzimtica de penicilina para la obtencin de cido 6-amino penicilnico (6 APA) usado
para la obtencin de penicilinas semisintticas.
Ing. Bernarda Mancuello - 24/26
c) Conversin de D-L aminocidos a L-aminocidos de mayor poder nutritivo.
d) Conversin de fumarato de amonio a cido L-asprtico.
e) Hidrlisis de lactosa para hacerla ms digerible (en suero de leche, lactasa inmovilizada sobre cama de
slice porosa).
Ing. Bernarda Mancuello - 25/26
CUESTIONARIO N6
1) Qu son las enzimas? Caractersticas fundamentales.
2) Nomenclatura y clasificacin de las enzimas.
3) Naturaleza qumica de las enzimas Qu son las holoenzimas?
4) Qu son las coenzimas?
5) Qu es un sitio activo?
6) Cules son los factores que modifican la actividad enzimtica?
7) Qu permite explicar la ecuacin de Michaelis-Menten?
8) Deduccin de la ecuacin de Michaelis-Menten.
9) Qu es Km? Qu significado e importancia industrial tiene?
10) Cmo se obtienen los parmetros cinticos Km y Vmx? Explicar mediante la representacin de
Lineweaver-Burk.
11) Qu efecto tiene la temperatura sobre una reaccin enzimtica?
12) Desarrollar tipos de inhibicin enzimtica. Graficar.
13) Cmo se realiza la estabilizacin de clulas y enzimas?
Ing. Bernarda Mancuello - 26/26
Você também pode gostar
- Ceramicos I PDFDocumento44 páginasCeramicos I PDFEsaul GcAinda não há avaliações
- Bloque I DefectosDocumento38 páginasBloque I DefectosGabriela35sanAinda não há avaliações
- Clase 6-2016 Ensayos MecánicosDocumento107 páginasClase 6-2016 Ensayos MecánicosGabriela35sanAinda não há avaliações
- Ceramicos I PDFDocumento44 páginasCeramicos I PDFEsaul GcAinda não há avaliações
- Clase 6-2016 Ensayos MecánicosDocumento107 páginasClase 6-2016 Ensayos MecánicosGabriela35sanAinda não há avaliações
- Tecnicas de Adn Recombinante NoDocumento5 páginasTecnicas de Adn Recombinante NoMelissa Barrios CcasaniAinda não há avaliações
- Transferencia de CalorDocumento33 páginasTransferencia de CalorJuliaPirruiaAinda não há avaliações
- Unidad 4Documento27 páginasUnidad 4Gabriela35sanAinda não há avaliações
- 2017 03 15 Introduccion IyfaDocumento38 páginas2017 03 15 Introduccion IyfaGabriela35sanAinda não há avaliações
- Serie 9 ResueltaDocumento4 páginasSerie 9 ResueltaGabriela35sanAinda não há avaliações
- Tutorial CodigoGeneticoDocumento3 páginasTutorial CodigoGeneticoDavid HernandezAinda não há avaliações
- Tet GTP TR #7Documento48 páginasTet GTP TR #7Gabriela35sanAinda não há avaliações
- 1 - Conduccion 2013Documento34 páginas1 - Conduccion 2013Gabriela35sanAinda não há avaliações
- AtmosferaDocumento71 páginasAtmosferaGabriela35sanAinda não há avaliações
- Parcial de Calculo Avanzado 2006 Tema 23Documento2 páginasParcial de Calculo Avanzado 2006 Tema 23Gabriela35sanAinda não há avaliações
- TP NO 3 BIO para ImprimirDocumento19 páginasTP NO 3 BIO para ImprimirGabriela35sanAinda não há avaliações
- INTEGRACIONDocumento9 páginasINTEGRACIONGabriela35sanAinda não há avaliações
- Recipientes y TubosDocumento18 páginasRecipientes y TubosCLIFFORDPAAinda não há avaliações
- Resumen 2do Parcial MeiDocumento32 páginasResumen 2do Parcial MeiGabriela35sanAinda não há avaliações
- 313 79-90Documento12 páginas313 79-90Raúl ZuraAinda não há avaliações
- Unidad 03Documento22 páginasUnidad 03Gabriela35sanAinda não há avaliações
- Agua Iiv 2016Documento67 páginasAgua Iiv 2016Gabriela35sanAinda não há avaliações
- Resumen 2do Parcial PDFDocumento20 páginasResumen 2do Parcial PDFGabriela35sanAinda não há avaliações
- Seminario BiotecnologíaDocumento21 páginasSeminario BiotecnologíaGabriela35sanAinda não há avaliações
- Unidad 05Documento22 páginasUnidad 05Gabriela35sanAinda não há avaliações
- TP NO 3 BIO para ImprimirDocumento19 páginasTP NO 3 BIO para ImprimirGabriela35sanAinda não há avaliações
- Fenomenos de Tramsporte PDFDocumento6 páginasFenomenos de Tramsporte PDFchmariaelenaAinda não há avaliações
- Tratamientos TérmicosDocumento3 páginasTratamientos TérmicosGabriela35sanAinda não há avaliações
- FluorDocumento62 páginasFluorPedro Gerardo WfreezerAinda não há avaliações
- Prueba de Inhibicion de HemaglutinacionDocumento3 páginasPrueba de Inhibicion de HemaglutinacionKATHERINEAinda não há avaliações
- TEMA20Documento46 páginasTEMA20Mariana Linares QuevedoAinda não há avaliações
- FenitoínaDocumento11 páginasFenitoínaArianne Villagra YañezAinda não há avaliações
- Metabolismo CelularDocumento33 páginasMetabolismo CelularPatricia Mabel LedezmaAinda não há avaliações
- Aplicaciones Del QuitosanoDocumento22 páginasAplicaciones Del QuitosanoGabriel GonzálezAinda não há avaliações
- Inhibición EnzimáticaDocumento15 páginasInhibición EnzimáticaDiego TorresAinda não há avaliações
- Informe Actividad Enzimática - Fosfolipasa BiochemDocumento7 páginasInforme Actividad Enzimática - Fosfolipasa BiochemStupot100% (1)
- Anteproyecto de Tesis Automedicacion Con Inhibidores Bomba de ProtonesDocumento20 páginasAnteproyecto de Tesis Automedicacion Con Inhibidores Bomba de ProtonesLeunam Diaz100% (2)
- Aislamiento, Separación y Purificación de ProteínasDocumento24 páginasAislamiento, Separación y Purificación de Proteínastaniacuadra67% (3)
- Metabolismo CambellDocumento5 páginasMetabolismo CambellNelson Nel100% (2)
- Charla Malezas Anacaco 2018Documento41 páginasCharla Malezas Anacaco 2018vivesclanAinda não há avaliações
- Resumen Farmacos Hematologia 2Documento3 páginasResumen Farmacos Hematologia 2Dannie TroncosoAinda não há avaliações
- Inhibicion EnzimaticaDocumento38 páginasInhibicion EnzimaticaAlex Pan de GraciaAinda não há avaliações
- Interacciones FarmacológicasDocumento8 páginasInteracciones FarmacológicasMisuzu KamioAinda não há avaliações
- Prácticas de Laboratorio de BioquímicaDocumento35 páginasPrácticas de Laboratorio de BioquímicaAndres Luis0% (1)
- Farmacocinética y Farmacodinámica de Los Fármacos AntiinfecciososDocumento44 páginasFarmacocinética y Farmacodinámica de Los Fármacos AntiinfecciososWhentusAinda não há avaliações
- Informe Cinetica EnzimaticaDocumento19 páginasInforme Cinetica EnzimaticacarmenAinda não há avaliações
- Biotransformacion de Las DrogasDocumento44 páginasBiotransformacion de Las DrogasMishellDominguez100% (2)
- Seminario EnzimasDocumento12 páginasSeminario EnzimasAllison OportaAinda não há avaliações
- Hidratos de GasDocumento36 páginasHidratos de GasBrayan MuñozAinda não há avaliações
- Drogas AntireumaticasDocumento28 páginasDrogas AntireumaticasElizabeth DanielaAinda não há avaliações
- Cosméticos LipolíticosDocumento60 páginasCosméticos LipolíticosMARIA83% (12)
- Catalogo EodDocumento21 páginasCatalogo EodAnonymous CXNLTvm100% (1)
- Clasificacion de Farmacos Por Uso TerapeDocumento12 páginasClasificacion de Farmacos Por Uso TerapeAlejandro Carreño100% (4)
- Pseudocereales para Fermentacion LacticaDocumento14 páginasPseudocereales para Fermentacion LacticaMarcia NisAinda não há avaliações
- Sistema Renina-Angiotensina-AldosteronaDocumento13 páginasSistema Renina-Angiotensina-AldosteronaKing_Tacvbo13Ainda não há avaliações
- Actualizacion para El Medico No Especialista Sobre Tto Del VIHDocumento15 páginasActualizacion para El Medico No Especialista Sobre Tto Del VIHOscar Alejandro Cardenas QuinteroAinda não há avaliações
- Los Inhibidores de La RespiraciónDocumento5 páginasLos Inhibidores de La RespiraciónJuan Carlos Flores SanchezAinda não há avaliações