Escolar Documentos
Profissional Documentos
Cultura Documentos
9 Des Comp Cat Ali Tic A
Enviado por
795795Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
9 Des Comp Cat Ali Tic A
Enviado por
795795Direitos autorais:
Formatos disponíveis
Laboratorio de equilibrio y cinética
Agosto de 2008
DESCOMPOSICIÓN CATALÍTICA DEL PERÓXIDO DE HIDRÓGENO
Grupo: ____________ Equipo: ______________ Fecha: ______________
Nombre(s):________________________________________________________________
_______________________________________________________________
_______________________________________________________________
I. OBJETIVO GENERAL
Analizar el efecto que tiene la adición de un catalizador sobre la rapidez de una reacción
II. OBJETIVOS PARTICULARES
a. Aplicar el método integral para evaluar las constantes de rapidez de reacción a diferentes
concentraciones de catalizador.
b. Seleccionar la técnica analítica adecuada para seguir el avance de la reacción.
c. Determinar el orden de reacción respecto al sustrato y al catalizador
III. PROBLEMA
Determinar la ecuación de rapidez de reacción para una reacción catalítica
A1. CUESTIONARIO PREVIO
1. ¿Qué factores determinan la rapidez de una reacción?
2. ¿Cómo se puede medir el avance de una reacción?
3. Explique qué es catálisis, catalizador, inhibición e inhibidor de una reacción.
4. Explique qué diferencia hay entre una catálisis homogénea y una heterogénea
5. Si en una reacción se desprenden gases, explique cómo se determina el avance de la
reacción.
6. Investiga las propiedades químicas del peróxido de hidrógeno, del dicromato de potasio y de
la enzima catalasa.
7. ¿Cuál es la reacción de descomposición del peróxido de hidrógeno que se lleva a cabo por el
catalizador?
8. ¿Cuál es la ecuación de rapidez de descomposición del peróxido de hidrógeno?
a) en ausencia de catalizador
b) en presencia de catalizador
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
A2. PROPUESTA DEL DISEÑO EXPERIMENTAL
Llevar a cabo una discusión grupal, identificar las variables involucradas y plantear la hipótesis
para proponer el diseño del experimento que pueda conducir a la resolución del problema
planteado (considerar que en el laboratorio se dispone del material indicado en el punto A3).
Anotar la propuesta en el Cuadro 1.
Cuadro 1. Variables, hipótesis y propuesta del diseño de experimento.
A3. MATERIALES Y REACTIVOS
Peróxido de hidrógeno al 1.5% Gasómetro formado por :
Agua destilada 1 tubo graduado ( bureta sin punta) de 50 mL
Probeta de vidrio sin graduación (h = 60cm)
Catalizadores: 1 soporte universal
KI 0.1 M, 0.2 M 2 pinzas de tres dedos con nuez
K2Cr2O7 0.01 M “T” de vidrio o plástico
Jugo de papa recién extraído Tubo látex para conexiones
Jugo de zanahoria recién extraído Otros materiales
1 Agitador magnético con barra
Placa de material aislante (unicel 15x15 cm2)
1 pipeta graduada de 10 mL
1 jeringa de plástico graduada con aguja de 5 mL
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
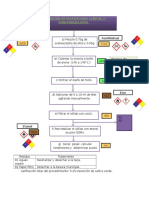
A4. METODOLOGÍA EMPLEADA.
Describir detalladamente en el cuadro 2 la metodología empleada después de haber realizado
el experimento.
Cuadro 2. Metodología empleada.
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
A5. DATOS, CÁLCULOS Y RESULTADOS
1. Condiciones de trabajo:
Temperatura: ____________ Presión ambiental: ___________
2. Algoritmo de cálculo.
a. Volúmenes de gas desprendidos a diferentes tiempos en particular el volumen máximo
desprendido (Vmáx). Registrar los datos en la tabla 1.
b. A partir de los volúmenes de gas desprendidos aplicar el método integral y registrar los datos
en la tabla 1.
TABLA 1
5 mL de peróxido de hidrógeno al 1.5%
Tabla 1.1. 0.5 mL de catalizador
t /(min) Vt = Vol O2 /mL (Vmax − Vt) Ln (Vmax − Vt) 1/(Vmax − Vt)
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
Tabla 1.2. 0.7 mL de catalizador
t /(min) Vt = Vol O2 /mL (Vmax − Vt) Ln (Vmax − Vt) 1/(Vmax − Vt)
Tabla 1.3. 1.0 mL de catalizador
t /(min) Vt = Vol O2 /mL (Vmax − Vt) Ln (Vmax − Vt) 1/(Vmax − Vt)
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
Tabla 1.4. 1.2 mL de catalizador
t /(min) Vt = Vol O2 /mL (Vmax − Vt) Ln (Vmax − Vt) 1/(Vmax − Vt)
Tabla 1.5. 1.5 mL de catalizador
t /(min) Vt = Vol O2 /mL (Vmax − Vt) Ln (Vmax − Vt) 1/(Vmax − Vt)
A6. ELABORACIÓN DE GRÁFICOS
1. Trazar las gráficas de ( Vmáx − Vt) vs. t, Ln (Vmáx − Vt) vs. t y 1/ (Vmáx − Vt) vs. t para cada
volumen empleado de catalizador.
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
Tabla 2. Resumen de resultados obtenidos de las gráficas de acuerdo al orden de reacción
obtenido.
Corrida Cat (mL) k [Cat] Ln k Ln [Cat]
1 0.5
2 0.7
3 1
4 1.2
5 1.5
2. Trazar la gráfica de Ln k vs. Ln [Cat] con los datos de la tabla 2.
A7. ANÁLISIS DE RESULTADOS
1. ¿Del conjunto de gráficas para cada volumen de catalizador utilizado, cuál de ellas se
aproxima más a una recta y cual es su coeficiente de correlación?
2. ¿Cuál es el orden de la reacción?
3. ¿Cual es la constante aparente kap de rapidez de la reacción para cada volumen de
catalizador?
4. ¿Cuáles son las unidades de la constante de rapidez aparente?
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Laboratorio de equilibrio y cinética
Agosto de 2008
5. ¿Qué forma tiene la gráfica de Ln k vs. Ln [Cat]?, ¿Qué significado tiene la pendiente de ésta
gráfica? ¿Qué significado tiene la ordenada al origen?
A8. CONCLUSIONES.
A.9. MANEJO DE RESIDUOS
Residuo Cantidad Riesgo Forma de disposición
A10. BIBLIOGRAFÍA.
Keith J. Laidler y John H. Meiser, (1997) Fisicoquímica, CECSA 1ª Ed.
Jerry Bell et al, (2005) Química. Un proyecto de la ACS, Editorial Reverté. S. A.
Peter Atkins, Julio de Paula., (2004) Physical Chemistry, Oxford University Press. 2ª impresión
India.
Ramiro Domínguez D, Minerva Téllez Ortiz, Emma González Ch.
Você também pode gostar
- LIQ Caidas de Presion ReporteDocumento8 páginasLIQ Caidas de Presion Reporte795795Ainda não há avaliações
- A 07 V 8Documento9 páginasA 07 V 8Sergio Ivan LopezAinda não há avaliações
- Unicacio CientificaDocumento1 páginaUnicacio Cientifica795795Ainda não há avaliações
- 000 FlashDocumento2 páginas000 Flash795795Ainda não há avaliações
- Lista de referencias de piezas para automóvilesDocumento7 páginasLista de referencias de piezas para automóvilesJavier RodríguezAinda não há avaliações
- Practica 4 PDFDocumento18 páginasPractica 4 PDFEdwinSanchezAinda não há avaliações
- Estruct CristalesDocumento24 páginasEstruct CristalesKikee CeledonAinda não há avaliações
- Triptico AGRICOLA 2018 1bDocumento1 páginaTriptico AGRICOLA 2018 1bRonald CordovaAinda não há avaliações
- Sistemas de Suspensión y DireccionDocumento20 páginasSistemas de Suspensión y DireccionRaul SantiagoAinda não há avaliações
- ProcesoAdobeDocumento1 páginaProcesoAdobeIta-lym Milagros Sotelo OcañaAinda não há avaliações
- 1731 en EsDocumento2 páginas1731 en EsCarlos Rocha FernandezAinda não há avaliações
- 1-Catálogo Mezclador Videonics MXproDocumento2 páginas1-Catálogo Mezclador Videonics MXproiba ogbaAinda não há avaliações
- Prob. Propuestos 1ra Unidad RM I 2021Documento13 páginasProb. Propuestos 1ra Unidad RM I 2021Karolainne Chamorro Angeles0% (1)
- UsbFix ReportDocumento2.975 páginasUsbFix ReportMiguel Angel Cardozo MolinaAinda não há avaliações
- Silabo 2019-I (Eia)Documento27 páginasSilabo 2019-I (Eia)Javier AlejandroAinda não há avaliações
- Arbol de Expansión MínimaDocumento11 páginasArbol de Expansión MínimaFelipe valenciaAinda não há avaliações
- ZTE Obsidian User Manual SpanishDocumento92 páginasZTE Obsidian User Manual SpanishFranklin FigueroaAinda não há avaliações
- Relaciones Hombre - MáquinaDocumento47 páginasRelaciones Hombre - MáquinaAlejandro Pantoja67% (12)
- Informe de Defensa CivilDocumento6 páginasInforme de Defensa CivilYaneth Mariluz100% (1)
- Concepto de PlaneaciónDocumento3 páginasConcepto de PlaneaciónMauricio VelasquezAinda não há avaliações
- Sesion 8 - Válvula Limitadora de PresiónDocumento14 páginasSesion 8 - Válvula Limitadora de PresiónJason Jose AndradeAinda não há avaliações
- La Envergadura de Los Proyectos de Riego AutomáticoDocumento5 páginasLa Envergadura de Los Proyectos de Riego AutomáticoZorayda YasmiraAinda não há avaliações
- BIOBARDA CienciasDocumento2 páginasBIOBARDA CienciasRómulo Leus HuancaAinda não há avaliações
- 7000 td002 - Es P PDFDocumento518 páginas7000 td002 - Es P PDFkarley leonardo venturaAinda não há avaliações
- Red Vial Primaria E35Documento9 páginasRed Vial Primaria E35Alx Leon TAinda não há avaliações
- Práctica de Laboratorio HidrologiaDocumento17 páginasPráctica de Laboratorio HidrologiaAlexSuntaxiAinda não há avaliações
- WWW - Widman.biz Seleccion Viscosidad PDFDocumento7 páginasWWW - Widman.biz Seleccion Viscosidad PDFJose Miguel Bautista FigueroaAinda não há avaliações
- Ccama Jaliri Edson EugenioDocumento110 páginasCcama Jaliri Edson EugenioSandro Edward Rojas AlvarezAinda não há avaliações
- Diagrama Ecologico PirazolonasDocumento3 páginasDiagrama Ecologico Pirazolonasabdielo88Ainda não há avaliações
- Producto Académico N1 202020Documento2 páginasProducto Académico N1 202020carlosAinda não há avaliações
- ANTECEDENTES (Practica Del Higado)Documento18 páginasANTECEDENTES (Practica Del Higado)Ollin Bädillo100% (6)
- ProcesoDocumento7 páginasProcesoAlejandra Choque100% (3)
- Programación PLC SIEMENS S7-200Documento118 páginasProgramación PLC SIEMENS S7-200Oscar Eduardo González Jiménez100% (2)
- TABLA DE TORQUEO Class 150-300-600Documento6 páginasTABLA DE TORQUEO Class 150-300-600Wilmar Fernando Gonzalez100% (6)