Escolar Documentos
Profissional Documentos
Cultura Documentos
Caso Clinico 4 Fisio
Enviado por
Mark HernandezDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Caso Clinico 4 Fisio
Enviado por
Mark HernandezDireitos autorais:
Formatos disponíveis
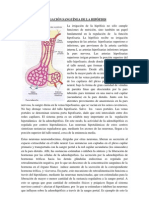
Fisiología de la hormona liberadora de gonadotropina
La hormona liberadora de gonadotropina (GnRH), también conocida como
hormona liberadora de hormona luteinizante (LHRH), es una hormona peptídica
responsable de la liberación de hormona estimulante del folículo (FSH) y de
hormona luteinizante (LH) de la pituitaria anterior. La GnRH es sintetizada y
liberada en las neuronas del hipotálamo. Se considera una neurohormona, es
decir, una hormona producida en una célula neuronal y liberada en sus terminales
neuronales.
Un área clave para la producción de GnRH es la zona preóptica del hipotálamo,
que contiene la mayoría de las neuronas secretoras de GnRH. La GnRH es
secretada en el torrente sanguíneo portal hipofisiario, en la eminencia media. La
sangre portal lleva la GnRH a la glándula pituitaria, que contiene células
gonadotropas donde la GnRH activa su propio receptor. El receptor de la GnRH
(GNRHR) es un receptor con siete dominios transmembrana acoplados a proteína-
G, que estimula la isoforma beta de la fosfolipasa C fosfoinositida (la cual moviliza
el calcio y la proteína quinasa C). Esto resulta en la activación de proteínas
implicadas en la síntesis y secreción de las gonadotropinas LH y FSH. La GnRH
es degradada por proteolisis en pocos minutos.
Estos procesos son controlados por el tamaño y frecuencia de los pulsos de
GnRH, así como por la retroalimentación de andrógenos y estrógenos. La baja
frecuencia de pulsos de GnRH conduce a la liberación de FSH, mientras que la
alta frecuencia de pulsos de GnRH estimula la liberación de LH.
Los niveles de prolactina elevados disminuyen la actividad de la GnRH.
Fisiologia corteza suprarrenal
Encargada de producir glucocorticoides y mineralocorticoides. Estos son
esteroides del grupo C 21, y son el cortisol por un lado y la aldosterona por el otro.
El cortisol se encarga de regular la homeostasis de la glucosa y el manejo del
estrés. Eleva la glicemia, al igual que lo hacen la somatotropina, el glucagòn y la
epinefrina. Hace parte pues de las hormonas contrarreguladoras de la insulina. Es
también inmunosupresor (linfolìtico) y antinflamatorio, y juega un papel permisivo
en la acción de otras hormonas.
La aldosterona por su parte regula la volemia por su capacidad retenedora de
sodio, haciendo parte de los mecanismos de regulación del metabolismo hídrico y
electrolítico y de la tensión arterial.
La corteza responde al ACTH con un mecanismo de “todo o nada” a una dosis de
0.35 unidades, necesitándose una unidad para el funcionamiento cortical en 24
horas. El cortisol efectúa una retroalimentación negativa sobre la hormona
liberadora de corticotropina (CRH) producida en el hipotálamo, que frena la
producción de ACTH, lo que hace lo mismo con la producción de cortisol lo que a
su vez favorece nuevos pulsos en el eje.
La producción de aldosterona depende del sistema renina-angiotensina. La renina
es una generada en el aparato yuxtaglomerular del riñón; la renina se libera por
cambios hemodinàmicos en la arteriola eferente. Estos pueden ser la pérdida de
sangre, cambios posturales o disminución en los niveles de sodio. Una globulina
alfa originada en el es catalizada por la renina para producir angiotensina I. Por
medio de la enzima convertidora de angiotensina esta pierde dos aminoácidos y
se transforma en angiotensina II. Esta última hormona interactúa con un receptor
suprarrenal con el que tiene gran afinidad y produce la aldosterona; es una
hormona muy potente, que aunque circula sólo por un minuto antes de ser
destruida en el pulmón, tiene varios efectos, todos destinados a elevar la presión
arterial: estimula el simpático a varios niveles e inhibe el tono vagal, estimula la
sed, el apetito por la sal, la hormona antidiurética, el ACTH y como ya dijimos, la
producción de aldosterona.
El sistema renina-angiotensina actúa de manera antagónica al Péptido Auricular
Natriurètico, que además de la acción que le da su nombre es relajante del
músculo liso vascular, inhibe la vasoconstricción por la norepinefrina y la
angiotensina II, reduce la secreción de renina y de aldosterona.
Fisiologia Hipoglucemia
Una cifra de glucemia inferior a 40 mg / dl.
La insulina frena la producción hepática de glucosa y aumenta la utilización de la
glucosa por parte de los tejidos periféricos (fundamentalmente el músculo)..
Cuando por cualquier mecanismo aparece hipoglucemia se aumenta la producción
de una serie de hormonas de contrarregulación, tales como: Glucagón y
epinefrina. Estas hormonas producirían un aumento en la glucogenolisis de forma
que intentarían elevar las cifras de glucemia hasta niveles normales. La hormona
de crecimiento y el cortisol serían otras hormonas de contrarregulación que
vendrían en una segunda fase evolutiva, una vez pasada la fase más aguda.
Aunque las catecolaminas son unas hormonas muy importantes en el proceso de
contrarregulación de la hipoglucemia.
La hipoglucemia activa células del hipotálamo que serían las responsables de la
descarga del sistema nervioso simpático, dicha activación produciría síntomas
tales como: sudoración, palpitaciones, ansiedad; la activación del sistema nervioso
parasimpático produciría manifestaciones tales como: cambios en el tamaño
pupilar y aumento en la secreción de saliva por la parótida. Tanto hipotermia como
hipertermia pueden observarse en la hipoglucemia. La hipotermia se debería a la
pérdida de calor causada por la sudoración excesiva y la vasodilatación periférica.
La hipertermia se produciría por las convulsiones o el edema cerebral.
El umbral aceptado para el desarrollo de síntomas por neuroglucopenia es
aproximadamente 36 mg / dl, por debajo de estas cifras de glucemia pueden
demostrarse cambios en el electroencefalograma y en la conciencia.
Fisiopatologia de la diabetes insípida
El lóbulo posterior de la hipófisis es el sitio primario de almacenamiento y
liberación de vasopresina, pero la vasopresina se sintetiza en el hipotálamo. La
hormona recién sintetizada puede liberarse a la circulación mientras los núcleos
hipotalámicos y parte del tracto neurohipofisario permanezcan indemnes. Debe
quedar indemne menos del 10% de las neuronas neurosecretoras para que se
desarrolle una diabetes insípida central. En consecuencia, esta enfermedad
siempre compromete a los núcleos supraóptico y paraventricular del hipotálamo o
una porción significativa del tallo hipofisario.
La diabetes insípida central puede ser total (ausencia de vasopresina) o parcial
(concentración insuficiente de vasopresina) y también puede ser primaria, con
reducción notable de la síntesis en los núcleos hipotalámicos del sistema
neurohipofisario
Fisiopatologia del panhipopituitarismo
El hipopituitarismo puede presentarse en adenomas hipofisarios secretores y
no secretores (existe una hiper o hipoproducción hormonal). Los macroadenomas
invaden estructuras vecinas; si la silla turca está intacta son de clase II, cuando
producen ensanchamiento de la silla turca son de clase III y los que presentan
invasión y destrucción: clase IV.
Un rápido crecimiento hace que el suministro de sangre no sea suficiente y pro-
duzca isquemia y posteriormente hemorragia o fragilidad de los vasos tumorales.
La hemorragia puede expandirse por el espacio subaracnoideo y producir irritación
meníngea; sin embargo en los microadenomas, el déficit suele ser de
gonadotropinas. La mayor parte de los microadenomas no progresa a
macroadenomas. Así el exceso de prolactina produce galactorrea e
hipogonadismo, los tumores secretores de TSH causan hipertiroidismo, los
secretores de ACTH causan enfermedad de Cushing o síndrome de Nelson; los
tumores secretores de gonadotropinas causan paradójicamente hipogonadismo.
Los mecanismos por los cuales los tumores hipofisarios causan hipopituitarismo,
que puede ser parcial o completo, incluyen la compresión mecánica de la glándula
hipofisaria por el tumor, o del tallo hipofisario y determinan alteraciones del campo
visual por compresión del quiasma óptico o invasión del seno cavernoso o de los
pares craneales con las alteraciones neurológicas subsiguientes; por interferencia
del flujo del tallo hipofisario que deja de transportar los factores hipotalámicos, la
vasopresina (ADH, AVP) y la
oxitocina que se producen en las neuronas del hipotálamo y que se almacenan
en la hipófisis posterior también pueden afectarse. El hipopituitarismo puede ser
reversible si se consigue la exéresis del tumor o con tratamiento farmacológico
como en el caso de los prolactinomas con agonistas de la dopamina. Sin embargo
en los casos de destrucción amplia de tejido hipotalámico o hipofisario (véase
radioterapia, cirugía o hemorragia) es poco probable la restitución funcional y es
necesario instaurar una terapia hormonal de sustitución.
Fisiología del déficit de la hormona del crecimiento
La hormona de crecimiento (GH) es sintetizada, segregada y almacenada por las
células somatotropas y somatomamotropas de la hipófisis anterior.
La vida media de la GH es de alrededor de 14 min. La secreción de GH aumenta
con la malnutrición y el ayuno, y disminuye en la obesidad. Es estimulada por la
hipoglucemia, las comidas ricas en proteínas, en contraste la hiperglucemia y la
leptina inhiben su secreción. La secreción de GH se ve influida por hormonas,
neuropéptidos, neurotransmisores y opioides. Aumentan la secreción de GH el
ejercicio, el sueño, el trauma y la sepsis. La secreción de GH se realiza en forma
de pulsos, con aproximadamente 10 pulsos intermitentes de secreción que duran
aproximadamente 90 minutos y se producen cada 128 minutos, siendo más
frecuentes por la noche. Los niveles plasmáticos medidos en situaciones basales y
en adultos sanos son habitualmente indetectables durante la mayor parte del día..
La GH estimula el crecimiento lineal en los niños actuando directa e
indirectamente (vía IGF-I) sobre el cartílago epifisario de los huesos largos. La GH
tiene igualmente importantes acciones metabólicas: aumenta la lipólisis, lo que
provoca la movilización de los triglicéridos almacenados. Estimula la síntesis
proteica. Antagoniza la acción de la insulina. Provoca retención de fosfato, agua y
sodio.
Você também pode gostar
- Ciclo MenstrualDocumento13 páginasCiclo MenstrualHuayi HsuAinda não há avaliações
- Glandula ParatiroideaDocumento16 páginasGlandula ParatiroideaBrian Welch100% (2)
- Células Especializadas de Los Órganos de Los SentidosDocumento13 páginasCélulas Especializadas de Los Órganos de Los SentidosPablo MartinezAinda não há avaliações
- Physiology of The Normal Menstrual Cycle - UpToDateDocumento14 páginasPhysiology of The Normal Menstrual Cycle - UpToDateL M MAinda não há avaliações
- SistemasDocumento15 páginasSistemasRonaldAinda não há avaliações
- Sistema Genital FemeninoDocumento22 páginasSistema Genital FemeninoCervantes Ledesma Karla BeatrizAinda não há avaliações
- Caso Clínico Insuficiencia SuprarrenalDocumento14 páginasCaso Clínico Insuficiencia SuprarrenalDIANA CAROLINA PECHE SILVA100% (1)
- Amenorrea SecundariaDocumento39 páginasAmenorrea SecundariaBerenice HurtadoAinda não há avaliações
- Urgencias TirodeasDocumento30 páginasUrgencias TirodeasluicgomezAinda não há avaliações
- Aut. Seres Olga Hernandez 40614305Documento1 páginaAut. Seres Olga Hernandez 40614305Wilmer Guarnizo BustosAinda não há avaliações
- 2.-Tiroides ClasesDocumento28 páginas2.-Tiroides ClasesYos GOarAinda não há avaliações
- HormonasDocumento115 páginasHormonaskatherine50% (2)
- Irrigación Sanguínea de La HipófisisDocumento2 páginasIrrigación Sanguínea de La HipófisisBerwil Brocca Loyola100% (5)
- Unidad 2 Tto Cosmético Glandulas SebacesaDocumento5 páginasUnidad 2 Tto Cosmético Glandulas SebacesaFernanda Nicole Torres Guti�rrez 18418831Ainda não há avaliações
- Fisiologìa ReproductivaDocumento2 páginasFisiologìa ReproductivaGabriellSierraAinda não há avaliações
- Taller Sistema EndocrinoDocumento71 páginasTaller Sistema EndocrinoSilvia Patricia RestrepoAinda não há avaliações
- Hiperplasia Suprarrenal Congenita: Expositora: Dra. Andrea Torrico Siacara R1-PediatriaDocumento34 páginasHiperplasia Suprarrenal Congenita: Expositora: Dra. Andrea Torrico Siacara R1-PediatriaAndrea Torrico SiacaraAinda não há avaliações
- Exposición Ciclo MentrualDocumento15 páginasExposición Ciclo MentrualAlberto Kenyo Riofrio PalaciosAinda não há avaliações
- Cuestionario Fisiología Generalidades EndocrinoDocumento3 páginasCuestionario Fisiología Generalidades EndocrinoErnesto ZavalaAinda não há avaliações
- CLASE 5 SISTEMA ENDOCRINO (1) KKKLKDocumento71 páginasCLASE 5 SISTEMA ENDOCRINO (1) KKKLKSARA ISABEL ROMERO AGUIRREAinda não há avaliações
- Eje Hipotalamo HiposiarioDocumento31 páginasEje Hipotalamo HiposiarioMonique Maciel100% (1)
- Fase Postanalítica: Fase Desde La Obtención Del Resultado Hasta La Recepción Del Profesional SolicitanteDocumento11 páginasFase Postanalítica: Fase Desde La Obtención Del Resultado Hasta La Recepción Del Profesional SolicitanteELIA ANAAinda não há avaliações
- Miniensayo Reproducción Celular y EndocrinoDocumento5 páginasMiniensayo Reproducción Celular y EndocrinofranciscaAinda não há avaliações
- 304sesion de Aprendizaje 6Documento36 páginas304sesion de Aprendizaje 6Jose Luis López YupanquiAinda não há avaliações
- Hormonas TiroideasDocumento84 páginasHormonas TiroideasElisa FloresAinda não há avaliações
- 6.pubertad UnuDocumento26 páginas6.pubertad UnuHelmut Valera CovarrubiasAinda não há avaliações
- Semiologia EndocrinaDocumento15 páginasSemiologia EndocrinaElio PomaAinda não há avaliações
- Dialnet EnfermedadesTiroideasEnEquidos 6282934Documento24 páginasDialnet EnfermedadesTiroideasEnEquidos 6282934juliruiz86Ainda não há avaliações
- Glandulas SuprarrenalesDocumento21 páginasGlandulas SuprarrenalesStephanie Lisbeth PazmiñoAinda não há avaliações
- La Adolescencia: P A R T EDocumento141 páginasLa Adolescencia: P A R T EFelicidad Lemos OteroAinda não há avaliações