Escolar Documentos
Profissional Documentos
Cultura Documentos
Laboratorio N°3
Enviado por
Oscar DiazDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Laboratorio N°3
Enviado por
Oscar DiazDireitos autorais:
Formatos disponíveis
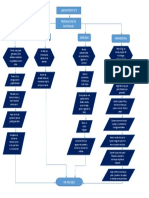
LABORATORIO N°3
Alistamiento de materiales: 10 tubos de ensayo, 1 Reactivos necesarios: KMnO4 – 0,1 M, HCL al 5%, Na(OH)
gradilla,1 pinza para tubo de ensayo, 1 vidrio de reloj, 1 al 5%, Na2S2O3, H2SO4 al 5%, (NH4)2C2O4 al 5%, C2H5OH,
vaso de precipitados de 250 mL H2O2, Fe(SO4) al 5%
En un tubo de ensayo colocar una solución de oxalato de
Observar el color y calentar en baño de maría
amonio (NH4)2C2O4 , dos gotas de H2SO4 y dos gotas de
KMnO4.
En el primer tubo adicionar 0,5 mL de HCL al 5%,v/v
Observar los cambios que ocurra en diez minutos Colocar tres tubos de ensayo en la gradilla y en c/u adicione 1
mL de solución de KMnO4 0,1 M y dos gotas de etanol puro En el segundo tubo adicionar 0,5 mL de agua destilada
En el tercer tubo adicionar 0,5 mL de Na(OH) al 5% p/v
En el primer tubo adicionar 0,5 mL de HCL al 5%,v/v
Colocar dos tubos de ensayo en la gradilla y en cada uno
Observar los cambios que ocurran agregar 1mL de Na2S2O3 al 5% p/v
En el segundo tubo adicionar 0,5 mL de Na(OH) al 5% p/v
Vertir en un tubo de ensayo 2 mL de solución de KMnO 4 y 2
mL de H2SO4. Añadir gota a gota de H2O2 hasta que se
produzca un cambio de coloración.
Identificar los agentes oxidantes y el agente reductor. Calcular Colocar en un tubo de ensayo 2 mL de solución de Fe(SO 4) y 2
sus pesos equivalentes mL de H2SO4. Añadir gota a gota de H2O2 hasta que se
produzca un cambio permanente.
FIN DE PROCESO
Você também pode gostar
- Función de La Enfermera en La Central de EsterilizaciónDocumento28 páginasFunción de La Enfermera en La Central de EsterilizaciónWilmer Loyola Bustillos56% (9)
- 2 1Documento8 páginas2 1alex00__is0% (1)
- Laboratorio N°1Documento1 páginaLaboratorio N°1Oscar DiazAinda não há avaliações
- ActividadesComplementariasU1 IPDocumento16 páginasActividadesComplementariasU1 IPJairo Espinosa GutierrezAinda não há avaliações
- Anexo - PROCEDIMIENTO PARA EL ENCAPSULADO DE MUESTRAS PARA EL ANÁLISIS METALOGRÁFICO PDFDocumento6 páginasAnexo - PROCEDIMIENTO PARA EL ENCAPSULADO DE MUESTRAS PARA EL ANÁLISIS METALOGRÁFICO PDFOscar DiazAinda não há avaliações
- EngranajesDocumento20 páginasEngranajesOscar DiazAinda não há avaliações
- Laboratorio Capacidad CalorificaDocumento1 páginaLaboratorio Capacidad CalorificaOscar DiazAinda não há avaliações
- Laboratorio N°2Documento1 páginaLaboratorio N°2Oscar DiazAinda não há avaliações
- Ejercicios Con Ciclos ExtraClase PDFDocumento3 páginasEjercicios Con Ciclos ExtraClase PDFOscar DiazAinda não há avaliações
- Anexo - PROCEDIMIENTO PARA EL ENCAPSULADO DE MUESTRAS PARA EL ANÁLISIS METALOGRÁFICO PDFDocumento6 páginasAnexo - PROCEDIMIENTO PARA EL ENCAPSULADO DE MUESTRAS PARA EL ANÁLISIS METALOGRÁFICO PDFOscar DiazAinda não há avaliações
- Trabajo N°2 AlgoritmosDocumento5 páginasTrabajo N°2 AlgoritmosOscar DiazAinda não há avaliações
- 8a. Paralelo Flujo Pseudo CDocumento2 páginas8a. Paralelo Flujo Pseudo COscar DiazAinda não há avaliações
- EjercPropuestoCondicionales PDFDocumento2 páginasEjercPropuestoCondicionales PDFOscar DiazAinda não há avaliações
- Problemas Propuestos Contador y AcumuladorDocumento4 páginasProblemas Propuestos Contador y AcumuladorOscar DiazAinda não há avaliações
- Ejercicios Con Ciclos ExtraClase PDFDocumento3 páginasEjercicios Con Ciclos ExtraClase PDFOscar DiazAinda não há avaliações
- Quiz 1 Segundo CorteDocumento2 páginasQuiz 1 Segundo CorteOscar DiazAinda não há avaliações
- Laboratorio N°4Documento1 páginaLaboratorio N°4Oscar DiazAinda não há avaliações
- Cartilla Ingenieria Economica 2017Documento83 páginasCartilla Ingenieria Economica 2017Oscar Diaz100% (1)
- Ejercicios Maquinas HidraulicasDocumento7 páginasEjercicios Maquinas HidraulicasOscar DiazAinda não há avaliações
- Trigonometric IdentitiesDocumento1 páginaTrigonometric IdentitiesOscar DiazAinda não há avaliações
- Laboratorio N°2Documento1 páginaLaboratorio N°2Oscar DiazAinda não há avaliações
- Proyecto Hidroelectrica PorvenirDocumento20 páginasProyecto Hidroelectrica PorvenirOscar Diaz100% (1)
- Presentacion Abstraccion GeometricaDocumento5 páginasPresentacion Abstraccion GeometricaOscar DiazAinda não há avaliações
- TERMODINAMICA1Documento3 páginasTERMODINAMICA1Oscar DiazAinda não há avaliações
- Las Serpientes RobóticasDocumento3 páginasLas Serpientes RobóticasOscar DiazAinda não há avaliações
- TERMODINAMICA1Documento39 páginasTERMODINAMICA1Oscar DiazAinda não há avaliações
- Supra SistemaDocumento12 páginasSupra SistemaOscar DiazAinda não há avaliações
- Administracion en Una PaginaDocumento1 páginaAdministracion en Una PaginaOscar DiazAinda não há avaliações
- Supra SistemaDocumento1 páginaSupra SistemaOscar DiazAinda não há avaliações
- Tabla Periodica 2Documento1 páginaTabla Periodica 2Oscar DiazAinda não há avaliações
- Introduccioón A La Teoría General de Sistemas PDFDocumento88 páginasIntroduccioón A La Teoría General de Sistemas PDFOscar DiazAinda não há avaliações
- Elaboración de Un Hidrogel A Partir de Quitosano para La Eliminacion de Metales PesadosDocumento19 páginasElaboración de Un Hidrogel A Partir de Quitosano para La Eliminacion de Metales PesadosJoel Santiago Aguilar LoyolaAinda não há avaliações
- Psicologia Social - Martillero - UBP - Actividad 4Documento1 páginaPsicologia Social - Martillero - UBP - Actividad 4Candelaria GonzalezAinda não há avaliações
- Molestias Del EmbarazoDocumento5 páginasMolestias Del EmbarazoLuhito Luchiin XDAinda não há avaliações
- CuscoDocumento10 páginasCuscobrauliohpAinda não há avaliações
- Investigación de La Familia MexicanaDocumento13 páginasInvestigación de La Familia MexicanayertsAinda não há avaliações
- Cerveceria Boliviana NacionalDocumento19 páginasCerveceria Boliviana NacionalRosa Arenas88% (8)
- Taller Tercer Periodo CN NovenoDocumento3 páginasTaller Tercer Periodo CN NovenoAngie AldanaAinda não há avaliações
- Avena GranoDocumento2 páginasAvena GranoENRIQUE ANDRES MELGAREJO FUENTEALBAAinda não há avaliações
- Mapas 26Documento5 páginasMapas 26FPMAinda não há avaliações
- Proyecto de AfectividadDocumento11 páginasProyecto de AfectividadTatiana RojasAinda não há avaliações
- Oxansil 17 PDFDocumento1 páginaOxansil 17 PDFAspro Brazil Se IglesiasAinda não há avaliações
- Clase 1 de Dinamica de GruposDocumento11 páginasClase 1 de Dinamica de GruposMaria Victoria Guevara100% (1)
- Tarea de Qumimica y Su Laboratorio Emei 2022Documento9 páginasTarea de Qumimica y Su Laboratorio Emei 2022ESMARLIS BELLO JOSEAinda não há avaliações
- Menú 28 Días - 1800 CaloríasDocumento14 páginasMenú 28 Días - 1800 Caloríaslili quinteroAinda não há avaliações
- Cambios Refractivos en El AncianoDocumento4 páginasCambios Refractivos en El Ancianomendra_zakiAinda não há avaliações
- Formulario Nelson OrtizDocumento6 páginasFormulario Nelson OrtizPUÑOYLETRA0% (1)
- Grupo 9 Taller EstadisticaDocumento9 páginasGrupo 9 Taller Estadisticajoel ruizAinda não há avaliações
- Portafolio Viviendas Prioritarias Conceptos Plásticos ExtDocumento11 páginasPortafolio Viviendas Prioritarias Conceptos Plásticos ExtLuis OsorioAinda não há avaliações
- Sesion 12Documento101 páginasSesion 12VALERY ALEXA CASTILLO ROMEROAinda não há avaliações
- Proyecto para El Area de SecretariaDocumento44 páginasProyecto para El Area de Secretariarosa emilia cifuentes calderonAinda não há avaliações
- Clase 9 - Fisiopatología Cardiovasculares en La GestaciónDocumento41 páginasClase 9 - Fisiopatología Cardiovasculares en La GestaciónSheyla Ramos PalominoAinda não há avaliações
- INFOGRAFÍADocumento2 páginasINFOGRAFÍABritneyAinda não há avaliações
- Curso Camion Minero KomatsuDocumento180 páginasCurso Camion Minero KomatsuRuben LiviseAinda não há avaliações
- Apsd Apsd-616 FormatoalumnotrabajofinalDocumento8 páginasApsd Apsd-616 FormatoalumnotrabajofinalJhoel Quispe CastilloAinda não há avaliações
- Silabo - Del - Curso Laboratorio de MetalurgiaDocumento5 páginasSilabo - Del - Curso Laboratorio de Metalurgiajohanna lilibethAinda não há avaliações
- Guia de Aprendizaje 5. Laboratorio de AguasDocumento11 páginasGuia de Aprendizaje 5. Laboratorio de AguasAisa PiragautaAinda não há avaliações
- 2m Ficha2Documento5 páginas2m Ficha2Camila Patiño RodríguezAinda não há avaliações
- Manual Micorrizas PropagulosDocumento41 páginasManual Micorrizas PropagulosSony Ramírez100% (2)