Escolar Documentos
Profissional Documentos
Cultura Documentos
Informe Fiqui
Enviado por
Sebas MenaTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Informe Fiqui
Enviado por
Sebas MenaDireitos autorais:
Formatos disponíveis
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
Asignatura: Fisicoquímica I NOTA
Número de práctica: Dos (2)
Fecha de realización: 2018/05/04 Fecha de entrega: 2018/04/11
Integrantes / Grupo N°: Imaicela Maldonado Pamela Alexandra
Sebastian Mena
Rivadeneira Asimbaya Lady Micaela
1. Tema: DETERMINACIÓN DE LA MASA MOLECULAR DEL GAS IDEAL
DEL CICLO HEXANO POR EL MÉTODO DE DUMAS.
2. Objetivos:
- Determinar la densidad y el peso molecular de un líquido en estado de
vapor (n-hexano), por el método de Dumas
- Comparar y determinar el error porcentual entre el valor teórico del peso
molecular del n-hexano y el valor experimental.
- Determinar el punto de ebullición experimental del n-hexano y compararlo
con su valor teórico
3. Resumen
La presente practica tiene como objetivo principal llegar a determinar la
densidad y el peso molecular del n-hexano mediante el método de Dumas,
el mismo que consiste en la determinación de la masa molecular de un
compuesto por medida directa de la densidad de vapor, teniendo en
cuanta que se deben conocer datos como la presión atmosférica, el punto
de ebullición del compuesto y el volumen real del gas, en donde es
importante asumir que el gas presenta un comportamiento ideal. El
material utilizado en la práctica principalmente fue un bulbo en donde se
colocó el n-hexano a evaporarse, y un baño maría que actuó como medio
de calentamiento para el bulbo para lograr evaporar el n-hexano
contenido en el interior de este. Finalmente, el experimento nos permitió
obtener los valores experimentales de la densidad y masa molecular del
n-hexano con su desviación estándar, mostrando de esta manera valores
de 1,96 (±) 9,62 x 10-2 g/L y 78,89 (±) 3,87 g/mol respectivamente.
Adicionalmente se evidencia un porcentaje de error relativo
correspondiente a un 8,46%, que está dado por errores aleatorios o
sistemáticos como factores que pueden afectar el comportamiento del gas
o descalibración de los equipos de medida.
4. Fundamento Teórico
Densidad y Peso Molecular de un gas
La hipótesis de Avogadro establece que volúmenes iguales de gases
diferentes, a la misma temperatura y a la misma presión contienen el
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
mismo número de moléculas. Esto implica que R es una constante
universal en la ecuación de los gases perfectos
pV=nRT (1)
En la cual “n” es el número de moles. La ecuación (1) es obedecida sólo
aproximadamente por los gases y vapores reales a las presiones y
temperaturas ordinarias, pero es una expresión exacta en los límites de
densidad o presión gaseosa cero. Dentro de esta limitación, la hipótesis
de Avogadro ha sido aceptada como una importante ley natural. A
presiones y temperaturas ordinarias, la ley de los gases se cumple
suficientemente bien para servir como un medio de calcular
aproximadamente el peso molecular M de un gas o de un vapor a partir
de su densidad que es medida:
𝜌∙𝑅 ∙𝑇 𝑚∙𝑅 ∙𝑇
𝑀= = (2)
𝑃 𝑉∙𝑃
Donde la densidad puede expresarse como la relación de las magnitudes
de la masa del gas sobre su volumen. El peso molecular exacto puede
entonces deducirse al tener conocimiento de las otras condiciones a las
que se encuentra el gas, uno de los principales métodos para determinar
experimentalmente la masa molar de un gas es el método de dumas.
Método de Dumas
Es el método más directo para la determinación de la densidad de vapor
aunque debido a las características del experimento resulta inexacto.
Consiste en llenar un bulbo de vidrio con el vapor, sellarlo a una presión y
temperatura convenientes y pesarlo, el volumen de del bulbo se
determinar llenándolo de agua y pensándolo, es necesario pesar el bulbo
vacío, cosiderando también el peso del aire contenido en él, para poder
determinar por diferencia de masas, la masa tanto del vapor como la del
agua.
Jean Dumas demostró que el peso molecular de algunos compuestos orgánicos
era proporcional a la densidad de vapor del compuesto. El hecho de que el gas
no sea estrictamente ideal, no presenta dificultad en la asignación de la fórmula
molecular correcta. Las mediciones de la masa molar han de realizarse a
temperaturas suficientemente altas para garantizar su vaporización. Además el
hecho de que un gas real se parezca al ideal al disminuir la presión, se emplea
como base para la determinación de las masas molares de los gases.
5. Parte experimental
5.1. Reactivos y sustancias
Reactivos Cantidad
n-hexano 5ml
Agua potable 1000ml
5.2. Materiales y equipos
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
Materiales Equipos
Plancha de calentamiento Balanza analítica 𝐀 = ± 𝟏 ×
𝟏𝟎−𝟒 𝐠
Termómetro 𝐀 = ±𝟏 ℃ Aparato de Dumas
Vaso de precipitación 500mL Balanza granataria 𝐴 = ±𝟎, 𝟏 𝐠
Jeringa de 5ml
Pinzas
Bulbo de Dumas
5.3. Procedimiento
Limpiar correctamente el bulbo de Dumas utilizando alcohol antiséptico
por dentro y por fuera, secar el bulbo colocándolo en la estufa y medir
el peso del mismo.
Llenar un vaso de precipitación de 500m con agua y ponerla en
calentamiento sobre la plancha de calentamiento.
Tomar 1ml de n-hexeno, tomando en cuenta la volatilidad, y colocar en
el bulbo de Dumas. Y colocar el bulbo en el baño de modo que
únicamente el extremo se encuentre sobre la superficie.
A continuación, colocar el termómetro en el baño, para controlar la
temperatura de vaporización.
Cuando el líquido se ha evaporado completamente, tapar el bulbo y
sacar del baño. Anotar la temperatura y presión barométrica.
Dejar enfriar, secar la parte externa y pesar. Repetir el proceso anterior
dos veces más.
Al final llenar el bulbo con agua libre de gas, secar el bulbo por fuera y
pesar.
6. Datos experimentales
Tabla 2.1 Valores experimentales
# de 𝑾𝟏 (𝒈) 𝑾𝟐 (𝒈) 𝑻𝟏 (𝑲) 𝑾𝟑 (𝒈) 𝑻𝟐 (𝑲)
determinaciones 𝐀 = ± 𝟏 × 𝟏𝟎−𝟒 𝐠 𝐀 = ± 𝟏 × 𝟏𝟎−𝟒 𝐠 𝐀 = ±𝟏 ℃ 𝐀 = ±𝟎, 𝟏 𝐠 𝐀 = ±𝟏 ℃
1 40,4749 40,675 348 141,1 294
2 40,4749 40,682 349 141,1 294
3 404749 40663 348 141,1 294
Patm= 0,71 atm
Masa del bulbo más agua = 141,1
𝑔
Densidad del agua a 21 °C = 0.998299 𝑚𝐿
7. Cálculos
7.1. Masa de n-hexeno
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
𝑚ℎ𝑒𝑥𝑎𝑛𝑜 = 𝑚𝑏𝑢𝑙𝑏𝑜 𝑐𝑜𝑛 𝑣𝑎𝑝𝑜𝑟 𝑑𝑒 ℎ𝑒𝑥𝑒𝑛𝑜 − 𝑚𝑏𝑢𝑙𝑏𝑜 𝑣𝑎𝑐í𝑜
𝑚1ℎ𝑒𝑥𝑎𝑛𝑜 = 40,6750 − 40,4749 = 0,2001 𝑚2 𝑂2 = 0,2071 𝑚3 𝑂2 = 0,1881
7.2. Determinación de la densidad del agua a temperatura del
laboratorio
𝜌𝐻2𝑂 21℃ = 4 × 10−6 𝑇 2 + 3 × 10−6 𝑇 + 1
𝜌𝐻2𝑂 21℃ = 0,998299
7.3. Masa de agua pesada
𝑚𝑎𝑔𝑢𝑎 = 𝑚𝑏𝑢𝑙𝑏𝑜 𝑐𝑜𝑛 𝑎𝑔𝑢𝑎 − 𝑚𝑏𝑢𝑙𝑏𝑜 𝑣𝑎𝑐í𝑜
𝑚1ℎ𝑒𝑥𝑎𝑛𝑜 = 141,1g − 40,4749g = 100,62g
7.4. Volumen de agua
𝑚
𝜌𝐻2𝑂 =
𝑣
𝑚 100,62 𝑔 3
𝑉= = 𝑔 = 100,83 𝑐𝑚
𝜌𝐻2𝑂 0,998 𝑐𝑚3
7.5. Determinación de la densidad experimental del n-hexano
𝑚1 ℎ𝑒𝑥𝑎𝑛𝑜
𝜌1 =
𝑉 𝑎𝑔𝑢𝑎
0,2001𝑔
𝜌1 = = 1,98 𝑔/𝐿
1𝐿
100,83𝑚𝑙 ×
1000 𝑚𝑙
𝑔 𝑔
𝜌2 = 2,05 𝜌3 = 1,86
𝑙 𝐿
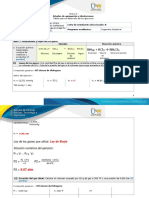
7.6. Determinación de la masa molecular del n-hexano
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
𝑎𝑡𝑚 ∙ 𝐿
𝑚 ∙ 𝑅 ∙ 𝑇 (0,2001𝑔)(0,082057 𝑚𝑜𝑙 ∙ 𝐾)(348𝐾) 𝑔
𝑀1 = = = 79,68
𝑉∙𝑃 (0,101L)(0,71 𝑎𝑡𝑚) 𝑚𝑜𝑙
𝑀2 = 82,46 g/mol 𝑀3 = 74,90 g/mol
Tabla 2.2. Resultados obtenidos
Nº 𝑽𝒃𝒖𝒍𝒃𝒐 (𝑳) 𝒎𝒗 (𝒈) 𝒈 𝒈
𝝆𝒗 ( ) 𝑴( )
determinación 𝑳 𝒎𝒐𝒍
1 0,1008 0,2001 1,98 79.68
2 0,1008 0,2071 2,05 82,46
3 0,1008 0,1881 1,86 74,90
8. Análisis estadístico
8.1. Desviación estándar de la masa
∑(𝑋𝑖 − 𝑋̅)2
𝑆𝑚 = ±√
𝑛−1
(0,201 + 0,2071 + 0,1881)𝑔
𝑚
̅= = 01984 𝑔
3
[(0,20001 − 0,1984)2 + (0,2071 − 0,1984)2 + (0,1881 − 0,1881)2 ]𝑔
𝑆𝑚 = ± √
3−1
−3 −4
𝑆𝑚 = 9,609 × 10 𝑔 = ±0,9609 × 10 𝑔
𝒎 = 𝟎, 𝟏𝟗𝟖𝟒 ± 𝟎, 𝟗𝟔𝟎𝟗 × 𝟏𝟎−𝟒 𝒈
8.2. Desviación estándar de la densidad
∑(𝑋𝑖 − 𝑋̅)2
𝑆𝜌 = ±√
𝑛−1
(1,98 + 2,05 + 1,86)𝑔/𝐿
𝜌̅ = = 1,96 𝑔/𝐿
3
[(1,98 − 1,96)2 + (2,05 − 1,96)2 + (1,86 − 1,96)2 ]𝑔/𝐿
𝑆𝜌 = ±√
3−1
𝑆𝜌 = ±9.62 × 10−2 𝑔/𝐿
𝝆 = 𝟏, 𝟗𝟔 ± 𝟗, 𝟔𝟐 × 𝟏𝟎−𝟐 𝒈/𝑳
8.3. Masa molecular promedio
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
(79,68 + 82,46 + 74,90)𝑔/𝑚𝑜𝑙
̅=
𝑀
3
̅ = 79.01 𝑔/𝑚𝑜𝑙
𝑀
8.4. Masa molecular con los valores promedio
𝑅 ∙ 𝑇̅
𝑀̅ = 𝜌̅
𝑃
(348 + 349 + 348)𝐾
𝑇̅ = = 348,3 𝐾
3
𝑎𝑡𝑚 · 𝐿
𝑔 0,082057 (𝐾 · 𝑚𝑜𝑙 ) ∙ 348,3(𝐾)
𝑀̅ = 1,96 ( )( )
𝐿 0,71 𝑎𝑡𝑚
𝑀̅ = 78,89 𝑔/𝑚𝑜𝑙
8.5. Desviación de la masa molecular, aplicando la Teoría de
Propagación del error
𝑆𝑚 2 𝑆𝜌 2
̅ √(
𝑆𝑀 = ±𝑀 ) +( )
𝑚̅ 𝜌̅
2 2
0,9609 × 10−4 9,62 × 10−2
𝑆𝑀 = ±78.89(𝑔/𝑚𝑜𝑙)√( ) +( )
0,1984 1,96
𝑆𝑀 = ±3,87𝑔/𝑚𝑜𝑙
𝑴 = 𝟕𝟖, 𝟖𝟗 ± 𝟑, 𝟖𝟕 𝒈/𝒎𝒐𝒍
8.6. % Error de la masa molecular experimental con la masa
molecular referencial
̅ − 𝑀 𝑟𝑒𝑓𝑒𝑟𝑒𝑛𝑐𝑖𝑎𝑙
𝑀
% 𝑒𝑟𝑟𝑜𝑟 𝑟𝑒𝑙𝑎𝑡𝑖𝑣𝑜 = | | × 100
𝑀 𝑟𝑒𝑓𝑒𝑟𝑒𝑛𝑐𝑖𝑎𝑙
𝑔 𝑔
78.89 − 86,18
% 𝑒𝑟𝑟𝑜𝑟 𝑟𝑒𝑙𝑎𝑡𝑖𝑣𝑜 = | 𝑚𝑜𝑙 𝑚𝑜𝑙 | × 100
𝑔
86,18
𝑚𝑜𝑙
% 𝑒𝑟𝑟𝑜𝑟 𝑟𝑒𝑙𝑎𝑡𝑖𝑣𝑜 = 8,46 %
9. Discusión
10. Conclusiones
11. Bibliografía
Gilbert Castellán, FISICOQUIMICA, 2ed, 1971, México, Capítulo 2.Ander
P
FACULTAD DE CIENCIAS QUÍMICAS
PROCESO PLAN CURRICULAR
CONTENIDO DEL INFORME DE LABORATORIO
Sonessa A., Principios de Química,1ed, Imprenta Técnica S.A , pg. (351-
354
Chang Raymond ,Química General, 7ed,Bogota, (MacGrawHill) 2009.
CASTELLAN Gilbert, Fisicoquímica. Segunda edición Páginas 16-17
Você também pode gostar
- Manual de Instrucciones GA 11+, 15+, 18+, 22+ - 26+ - 30 - Serie Desde API 295000Documento126 páginasManual de Instrucciones GA 11+, 15+, 18+, 22+ - 26+ - 30 - Serie Desde API 295000J Angel Martinez C80% (5)
- Mapa Conceptual LipidosDocumento1 páginaMapa Conceptual LipidosSebas Mena80% (5)
- Unidad 3 BalanceDocumento24 páginasUnidad 3 BalanceGrisel Coto67% (3)
- Ficha Toxicologica IbuprofenoDocumento15 páginasFicha Toxicologica IbuprofenoSebas MenaAinda não há avaliações
- Poe Rotavapor FinalDocumento7 páginasPoe Rotavapor FinalSebas Mena0% (1)
- Ayuda Didactica LiliDocumento1 páginaAyuda Didactica LiliSebas MenaAinda não há avaliações
- Ficha Toxicologica IbuprofenoDocumento15 páginasFicha Toxicologica IbuprofenoSebas MenaAinda não há avaliações
- Deber Centrifugacion Kevin MenaDocumento5 páginasDeber Centrifugacion Kevin MenaSebas MenaAinda não há avaliações
- INFORME DE INSTRU 11 CalculosDocumento5 páginasINFORME DE INSTRU 11 CalculosSebas MenaAinda não há avaliações
- Practica 10 Fosfolipidos FINALDocumento5 páginasPractica 10 Fosfolipidos FINALSebas MenaAinda não há avaliações
- Manual Diseño Factorial Anidado (Modelo Mixto) MenaDocumento10 páginasManual Diseño Factorial Anidado (Modelo Mixto) MenaSebas MenaAinda não há avaliações
- Manual Diseño Factorial Anidado (Modelo Mixto) MenaDocumento10 páginasManual Diseño Factorial Anidado (Modelo Mixto) MenaSebas MenaAinda não há avaliações
- Informe 14 Bioquimica 2 Parte Mena UnidoDocumento3 páginasInforme 14 Bioquimica 2 Parte Mena UnidoSebas MenaAinda não há avaliações
- Análisis Cualitativo Por FotometríaDocumento2 páginasAnálisis Cualitativo Por FotometríaSebas MenaAinda não há avaliações
- Preguntas Capitulo 1Documento3 páginasPreguntas Capitulo 1Sebas MenaAinda não há avaliações
- Análisis Cualitativo Por FotometríaDocumento2 páginasAnálisis Cualitativo Por FotometríaSebas MenaAinda não há avaliações
- INFORME DE INSTRU 11 CalculosDocumento5 páginasINFORME DE INSTRU 11 CalculosSebas MenaAinda não há avaliações
- Identificacion de AlcaloidesDocumento3 páginasIdentificacion de AlcaloidesSebas Mena100% (1)
- Identificacion de AlcaloidesDocumento3 páginasIdentificacion de AlcaloidesSebas Mena100% (1)
- Fisicoquimica-II.-Lab-.-VOLUMENES-MOLARES FINALDocumento10 páginasFisicoquimica-II.-Lab-.-VOLUMENES-MOLARES FINALSebas MenaAinda não há avaliações
- Ifnforme Nº12 Fundamento, Procedimiento, AnexosDocumento4 páginasIfnforme Nº12 Fundamento, Procedimiento, AnexosSebas MenaAinda não há avaliações
- Fisicoquimica-II.-Lab-.-VOLUMENES-MOLARES FINALDocumento10 páginasFisicoquimica-II.-Lab-.-VOLUMENES-MOLARES FINALSebas MenaAinda não há avaliações
- Instrumental Informe 5 y 6Documento9 páginasInstrumental Informe 5 y 6Sebas MenaAinda não há avaliações
- Trabajo de Farmacologia, EscopolaminaDocumento4 páginasTrabajo de Farmacologia, EscopolaminaSebas MenaAinda não há avaliações
- Vias ParenteralesDocumento6 páginasVias ParenteralesSebas MenaAinda não há avaliações
- Instrumental Informe 5 y 6Documento9 páginasInstrumental Informe 5 y 6Sebas MenaAinda não há avaliações
- Guia Practicas Bioquimica 2019Documento69 páginasGuia Practicas Bioquimica 2019Evelyn TapiaAinda não há avaliações
- Informe Bioqumica 2 Reconocimiento de DisacaridosDocumento2 páginasInforme Bioqumica 2 Reconocimiento de DisacaridosSebas MenaAinda não há avaliações
- ExercisesDocumento1 páginaExercisesSebas MenaAinda não há avaliações
- Trabajo de Farmacologia, EscopolaminaDocumento4 páginasTrabajo de Farmacologia, EscopolaminaSebas MenaAinda não há avaliações
- Vias ParenteralesDocumento6 páginasVias ParenteralesSebas MenaAinda não há avaliações
- Trabajo de Farmacologia, EscopolaminaDocumento4 páginasTrabajo de Farmacologia, EscopolaminaSebas MenaAinda não há avaliações
- Qué es la presión: tipos, unidades y medidoresDocumento24 páginasQué es la presión: tipos, unidades y medidoresJosue Cabrera WuirandiyoAinda não há avaliações
- Propueesta Titulacion NitrogenoDocumento11 páginasPropueesta Titulacion NitrogenoRF CCAinda não há avaliações
- Obtención de compuestos nitrogenados y propiedades del amoniacoDocumento5 páginasObtención de compuestos nitrogenados y propiedades del amoniacoNeber Sumire PpaccoAinda não há avaliações
- ArieteDocumento12 páginasArieteMatias StrossmanAinda não há avaliações
- Cuestionario 5Documento6 páginasCuestionario 5Marcos CabezasAinda não há avaliações
- Ecología 9 Y 10Documento2 páginasEcología 9 Y 10Gustavo MartínezAinda não há avaliações
- TERMITODocumento13 páginasTERMITOJose VelazcoAinda não há avaliações
- 4 - Durman Gas MT-GIDocumento10 páginas4 - Durman Gas MT-GIAlan Hernández100% (1)
- Simce 4°Documento11 páginasSimce 4°Patricio RiquelmeAinda não há avaliações
- Tema 5 Transferencia de CalorDocumento9 páginasTema 5 Transferencia de CalorRaion FYAinda não há avaliações
- SecadoDocumento65 páginasSecadoFelipeAinda não há avaliações
- Tratadores electrostáticos separan agua de crudoDocumento10 páginasTratadores electrostáticos separan agua de crudojmanuelbc100% (1)
- Practica 3 Laboratorio FisicoquimicaDocumento19 páginasPractica 3 Laboratorio FisicoquimicaItledf Del Águila DFAinda não há avaliações
- 14 Control de IncendioDocumento42 páginas14 Control de IncendioRobertoChávezAinda não há avaliações
- Propiedades de Los Fluidos PDFDocumento12 páginasPropiedades de Los Fluidos PDFEDGAR ORTIZ ARROYOAinda não há avaliações
- Taller de Laboratorio Sobre EstequiometríaDocumento11 páginasTaller de Laboratorio Sobre EstequiometríaYinny OrtizAinda não há avaliações
- Práctica de Laboratorio2 QuimicaDocumento2 páginasPráctica de Laboratorio2 QuimicaEmanuel SierraAinda não há avaliações
- Curso Barriles V1Documento30 páginasCurso Barriles V1Gustavo FalcoAinda não há avaliações
- Trabajo Grupal 2Documento3 páginasTrabajo Grupal 2Thalia RoblesAinda não há avaliações
- Itc-Icg 9Documento24 páginasItc-Icg 9alexsuit36hotmailcomAinda não há avaliações
- Actividad5 FísicaDocumento13 páginasActividad5 FísicaBraian Nicolas Camargo Gómez100% (1)
- Estados y Cambios de Estado de La MateriaDocumento3 páginasEstados y Cambios de Estado de La MateriaAdri RoblóxAinda não há avaliações
- Capitulo 3 Condiciones y Limites de OperacionDocumento41 páginasCapitulo 3 Condiciones y Limites de OperacionAlvaro Villalba TorresAinda não há avaliações
- Laboratorio N°3 CORRECIONDocumento36 páginasLaboratorio N°3 CORRECIONJhonatan V. Roque0% (1)
- Motores ExpoDocumento30 páginasMotores ExpoEsteban Prada SierraAinda não há avaliações
- Los Estados de La MateriaDocumento8 páginasLos Estados de La MateriaKrlosPeñaAinda não há avaliações
- Teoría Gases Medicinales 1.3Documento36 páginasTeoría Gases Medicinales 1.3Israel Santiago Vélez SisalimaAinda não há avaliações
- Jhordan Cardenas - Unidad 2 - Tarea 3-Estados de Agregación y DisolucionesDocumento17 páginasJhordan Cardenas - Unidad 2 - Tarea 3-Estados de Agregación y Disolucionesfacturacion ptogaitanAinda não há avaliações