Escolar Documentos
Profissional Documentos
Cultura Documentos
Balanceo Redox
Enviado por
Triana D. AlexTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Balanceo Redox
Enviado por
Triana D. AlexDireitos autorais:
Formatos disponíveis
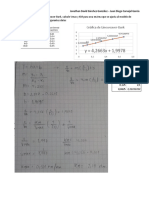
Alumno: Triana Flores Alejandro Antonio
Grupo: 506
Balanceo Redox
1.- Escribir correctamente la ecuación FeSO4 +H2SO4 + KMnO4 Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
2+ 6+ 2- 1+ 6+ 2- 1+ 7+ 2- 6+ 2- 1+ 6+ 2- 2+ 6+ 2- 1+ 2-
2.- Asignar números de oxidación a todos los FeSO4 +H2SO4 + KMnO4 3+
Fe2(SO4)3 + K2SO4 + MnSO4 + H2O
elementos.
3.-Identificar que átomos cambian su número de Oxidación: (2Fe
2+ 3+
-
Fe2 + 2e)
oxidación al pasar de reactivos a productos escribiendo 7+ 2+
las 2 semireacciones redox y calculando el número Reducción: (Mn + 5e- Mn)
total de cargas que se transfieren en cada átomo.
2+ 3+
4.- Los números calculados en el inciso anterior se Oxidación: (2Fe - (5)
Fe2 + 2e)
multiplican de manera cruzada para igualar cantidad de
2+
Reducción: (Mn + 5e- Mn) (2)
7+
electrones ganados y perdidos
1.- Metales
2.- No metales = “H” y “O”
3.- “H”
4.- “O”
5.- El resto de los elementos se balancea por tanteos 2 2-Mn-2 2
según ya está establecido 10 10-Fe-10 10
2 2-K-2 2
18 11-S-18 18
16 16-H-16 16
80 80-O-80 80
10FeSO4 + 8H2SO4 + 2KMnO4 5Fe2(SO4)3 + K2SO4 + 2MnSO4 + 8H2O
Você também pode gostar
- Lab 4, 'Determinación de Los Parámetros Cinéticos de La Enzima Fosfatasa Ácida de Gérmen de Trigo'. Bioquímica.Documento9 páginasLab 4, 'Determinación de Los Parámetros Cinéticos de La Enzima Fosfatasa Ácida de Gérmen de Trigo'. Bioquímica.Mauricio Andrés Gutiérrez BravoAinda não há avaliações
- QF Tomo2Documento22 páginasQF Tomo2Anais50% (2)
- Practica de Laboratorio de Quimica Nº5 (2023-1)Documento4 páginasPractica de Laboratorio de Quimica Nº5 (2023-1)Mayra Yashir Angel BarretoAinda não há avaliações
- 51 CuestionarioDocumento4 páginas51 Cuestionariojosue ramosAinda não há avaliações
- 4 - EnzimasDocumento41 páginas4 - EnzimasNaranjoAlvarezCristianAinda não há avaliações
- Tarea 4 - Reacciones QuimicasDocumento4 páginasTarea 4 - Reacciones QuimicasAndrea SánchezAinda não há avaliações
- Haluros de AlquiloDocumento42 páginasHaluros de AlquiloNatalia MartínAinda não há avaliações
- Capítulo 23Documento7 páginasCapítulo 23AgustinVenturaAinda não há avaliações
- Estequiometria de Las Reacciones QuimicasDocumento5 páginasEstequiometria de Las Reacciones QuimicasKléber Daniel Perez BustosAinda não há avaliações
- Primer Serie de ProblemasDocumento17 páginasPrimer Serie de ProblemasRuth HueyopaAinda não há avaliações
- Diseño ReacDocumento10 páginasDiseño ReacivanAinda não há avaliações
- Cinética Enzimática Jesaya Rios.mDocumento12 páginasCinética Enzimática Jesaya Rios.mJesaya RiosAinda não há avaliações
- Fundamentos de Diseño de Reactores: Ingenieria de Reacciones Quimicas IDocumento60 páginasFundamentos de Diseño de Reactores: Ingenieria de Reacciones Quimicas IPatriciaLlacsaLázaroAinda não há avaliações
- Resumen Reacciones Química Orgánica - Condensaciones y MásDocumento9 páginasResumen Reacciones Química Orgánica - Condensaciones y MásDana NelumboAinda não há avaliações
- Ejercicios - CINÉTICA QUÍMICADocumento6 páginasEjercicios - CINÉTICA QUÍMICAIrene HolmesAinda não há avaliações
- Actividad 9Documento3 páginasActividad 9Aby Ponce GonzálezAinda não há avaliações
- Sesión 03-Ecuación Química y Estequiometría 2022 IDocumento21 páginasSesión 03-Ecuación Química y Estequiometría 2022 ILuis FernandoAinda não há avaliações
- PREVIO NUMERO 4 SÍNTESIS DE p-NITROANILINA EN TRES ETAPASDocumento8 páginasPREVIO NUMERO 4 SÍNTESIS DE p-NITROANILINA EN TRES ETAPASJose Antonio Martinez MorenoAinda não há avaliações
- Ecuaciones RedoxDocumento2 páginasEcuaciones Redoxelicetmoreno0% (1)
- Desarrollo Actividad Bioquimica Tarea 3 ForoDocumento6 páginasDesarrollo Actividad Bioquimica Tarea 3 ForoAlejandra Lopez GarzonAinda não há avaliações
- ESTEQUIOMETRIADocumento3 páginasESTEQUIOMETRIAEspinoza Quinto100% (1)
- Vco8 BiocatalizadoresDocumento21 páginasVco8 BiocatalizadoresElio Alejandro Cala GonzálezAinda não há avaliações
- Práctica 4Documento7 páginasPráctica 4DianitaSalamancaAinda não há avaliações
- Articulopaeonilida EsDocumento6 páginasArticulopaeonilida EsAngie Victoria Lagos AndinoAinda não há avaliações
- Informe #6 (Cinética de La Invertasa)Documento16 páginasInforme #6 (Cinética de La Invertasa)Carlos100% (2)
- Taller Bioquimica, CineticaDocumento5 páginasTaller Bioquimica, CineticaDiego GarcíaAinda não há avaliações
- Q5-PAU Cinética 2023 - 24Documento7 páginasQ5-PAU Cinética 2023 - 24nikol.21abAinda não há avaliações
- Intro ABC Extensa PDFDocumento84 páginasIntro ABC Extensa PDFYunuen PMAinda não há avaliações
- Segundo Informe Laboratorio Reactores DJFVDocumento13 páginasSegundo Informe Laboratorio Reactores DJFVjaviera estebanAinda não há avaliações
- Otavalo, Gualacata, Morales LabQII PZB32Post INFORME3Documento9 páginasOtavalo, Gualacata, Morales LabQII PZB32Post INFORME3Vane MoralesAinda não há avaliações