Escolar Documentos
Profissional Documentos
Cultura Documentos
Ciclo de Cobre
Enviado por
Iván Marriott SaáTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Ciclo de Cobre
Enviado por
Iván Marriott SaáDireitos autorais:
Formatos disponíveis
Molaridad del Ácido Clorhídrico concentrado
37 𝑔 𝐻𝐶𝑙 1180 𝑔 𝐻𝐶𝑙 1 𝑚𝑜𝑙 𝐻𝐶𝑙
𝑥 𝑥 = 11,98 𝑀
100 𝑔 𝐻𝐶𝑙 1 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 36,45 𝑔 𝐻𝐶𝑙
Calculo de volumen de acido concentrado para 10 ml 6M
𝑉1 = 𝑉2 𝐶2
11.98 𝑀 𝑥 𝑉1 = 10 𝑚𝑙 𝑋 6𝑀
𝑉1 = 5 𝑚𝑙
Calculo de masa de NaOH para 30 ml de solución 3 M
3 𝑚𝑜𝑙 𝑁𝑎𝑂ℎ 40 𝑔 𝑁𝑎𝑂𝐻
0.03 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 𝑥 𝑥 = 3,6 𝑔 𝑁𝑎𝑂𝐻
1 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 1 𝑚𝑜𝑙 𝑁𝑎𝑂𝐻
Reacciones
𝐶𝑢(𝑠) + 4 𝐻𝑁𝑂3 (𝑐) → 𝐶𝑢(𝑁𝑂3 )2 (𝑎𝑐) + 2 𝑁𝑂2 (𝑔) + 2𝐻2 𝑂(𝑙)
𝑁𝑂(𝑔) + 𝑂2 (𝑔) → 𝑁𝑂2 (𝑔)
𝐶𝑢(𝑁𝑂3 )2 (𝑎𝑐) + 2 𝑁𝑎𝑂𝐻(𝑎𝑐) → 𝐶𝑢(𝑂𝐻)2 (𝑠) + 2 𝑁𝑎𝑁𝑂3 (𝑎𝑐)
⃗⃗⃗ 𝐶𝑢𝑂(𝑠) + 𝐻2 𝑂(𝑙)
𝐶𝑢(𝑂𝐻)2 (𝑠)∆
𝐶𝑢𝑂(𝑠) + 𝐻2 𝑆𝑂4 (𝑎𝑐) → 𝐶𝑢𝑆𝑂4 (𝑎𝑐) + 𝐻2 𝑂(𝑙)
𝐶𝑢𝑆𝑂4 (𝑎𝑐) + 𝑍𝑛(𝑠) → 𝐶𝑢 + 𝑍𝑛𝑆𝑂4 (𝑎𝑐)
Cálculos para preparación de reactivos
Molaridad del Ácido Clorhídrico concentrado
37 𝑔 𝐻𝐶𝑙 1180 𝑔 𝐻𝐶𝑙 1 𝑚𝑜𝑙 𝐻𝐶𝑙
𝑥 𝑥 = 11,98 𝑀
100 𝑔 𝐻𝐶𝑙 1 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 36,45 𝑔 𝐻𝐶𝑙
Calculo de volumen de ácido concentrado para 10 ml 6M
𝑉1 = 𝑉2 𝐶2
11.98 𝑀 𝑥 𝑉1 = 10 𝑚𝑙 𝑋 6𝑀
𝑉1 = 5 𝑚𝑙
Calculo de masa de NaOH para 30 ml de solución 3 M
3 𝑚𝑜𝑙 𝑁𝑎𝑂𝐻 40 𝑔 𝑁𝑎𝑂𝐻
0.03 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 𝑥 𝑥 = 3,6 𝑔 𝑁𝑎𝑂𝐻
1 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 1 𝑚𝑜𝑙 𝑁𝑎𝑂𝐻
Tabla n. 1.- Datos iniciales del ensayo
Compuesto Cantidad
Cu 0.4816 g
𝐻𝑁𝑂3 4 ml
𝑁𝑎𝑂𝐻 3M 30 ml
𝐶𝑢𝑂 1.0071 g
Calculo de masa teórica del CuO
1 𝑚𝑜𝑙 𝐶𝑢 1 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2
0.4816 𝑔 𝐶𝑢 𝑥 𝑥 = 7.58𝑥10−3 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2
63.53 𝑔 𝐶𝑢 1 𝑚𝑜𝑙 𝐶𝑢
1.5129 𝑔 𝐻𝑁𝑂3 1 𝑚𝑜𝑙 𝐻𝑁𝑂3 1 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2
4 𝑚𝑙 𝐻𝑁𝑂3 𝑥 𝑥 𝑥
𝑚𝑙 𝐻𝑁𝑂3 63.01 𝑔 𝐻𝑁𝑂3 4 𝑚𝑜𝑙 𝐻𝑁𝑂3
= 0.024 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2
Reactivo limitante 0.4816 𝑔 𝐶𝑢 generando 7.58𝑥10−3 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2
1 𝑚𝑜𝑙 𝐶𝑢(𝑂𝐻)2
7.58𝑥10−3 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2 𝑥 = 7.58𝑥10−3 𝑚𝑜𝑙𝑒𝑠 𝐶𝑢(𝑂𝐻)2
1 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2
3 𝑚𝑜𝑙 𝑁𝑎𝑂𝐻 1 𝑚𝑜𝑙 𝐶𝑢(𝑂𝐻)2
0.03 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖𝑜𝑛 𝑥 𝑥 = 0.045 𝑚𝑜𝑙𝑒𝑠 𝐶𝑢(𝑂𝐻)2
1 𝐿 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 2 𝑚𝑜𝑙 𝑁𝑎𝑂𝐻
Reactivo limitante 7.58𝑥10−3 𝑚𝑜𝑙 𝐶𝑢(𝑁𝑂3 )2 generando 7.58𝑥10−3 𝑚𝑜𝑙𝑒𝑠 𝐶𝑢(𝑂𝐻)2
1 𝑚𝑜𝑙 𝐶𝑢𝑂 79.545 𝑔 𝐶𝑢𝑂
7.58𝑥10−3 𝑚𝑜𝑙𝑒𝑠 𝐶𝑢(𝑂𝐻)2 𝑥 𝑥 = 0.60 𝑔 𝐶𝑢𝑂
1 𝑚𝑜𝑙 𝐶𝑢(𝑂𝐻)2 1 𝑚𝑜𝑙 𝐶𝑢𝑂
Calculo de masa recuperable del Cu
1 𝑚𝑜𝑙 𝐶𝑢𝑂 1 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
0.60 𝑔 𝐶𝑢𝑂 𝑥 𝑥 = 7.54𝑥10−3 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
79.545 𝑔 𝐶𝑢𝑂 1 𝑚𝑜𝑙 𝐶𝑢𝑂
1 𝑚𝑜𝑙 𝑍𝑛 1 𝑚𝑜𝑙 𝐶𝑢 63.53 𝑔 𝐶𝑢
7.54𝑥10−3 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4 𝑥 𝑥 𝑥 = 0.48 𝑔 𝐶𝑢
1 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4 1 𝑚𝑜𝑙 𝑍𝑛 1 𝑚𝑜𝑙 𝐶𝑢
Calculo de masa teórica del Cu a partir de 1.0071 g CuO
1 𝑚𝑜𝑙 𝐶𝑢𝑂 1 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
1.0071 𝑔 𝐶𝑢𝑂 𝑥 𝑥 = 0.012 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
79.545 𝑔 𝐶𝑢𝑂 1 𝑚𝑜𝑙 𝐶𝑢𝑂
98 𝑔 𝐻2 𝑆𝑂4 1.84 𝑔 𝐻2 𝑆𝑂4 1 𝑚𝑜𝑙 𝐻2 𝑆𝑂4 1 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
5 𝑚𝑙 𝐻2 𝑆𝑂4 𝑥 𝑥 𝑥 𝑥 = 0.092 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
100 𝑔 𝐻2 𝑆𝑂4 1 𝑚𝑙 𝑠𝑜𝑙𝑢𝑐𝑖ó𝑛 98 𝑔 𝐻2 𝑆𝑂4 1 𝑚𝑜𝑙 𝐻2 𝑆𝑂4
Reactivo limitante 1.0071 𝑔 𝐶𝑢𝑂 generando 0.012 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4
1 𝑚𝑜𝑙 𝑍𝑛 1 𝑚𝑜𝑙 𝐶𝑢 63.53 𝑔 𝐶𝑢
0.012 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4 𝑥 𝑥 𝑥 = 0.762 𝑔 𝐶𝑢
1 𝑚𝑜𝑙 𝐶𝑢𝑆𝑂4 1 𝑚𝑜𝑙 𝑍𝑛 1 𝑚𝑜𝑙 𝐶𝑢
1 𝑚𝑜𝑙 𝑍𝑛 1 𝑚𝑜𝑙 𝐶𝑢 63.53 𝑔 𝐶𝑢
1.960 𝑔 𝑍𝑛 𝑥 𝑥 𝑥 = 1.778 𝑔 𝐶𝑢
65.38 𝑔 𝑍𝑛 1 𝑚𝑜𝑙 𝑍𝑛 1 𝑚𝑜𝑙 𝐶𝑢
Tabla n. 2.- Resultados del ensayo
Compuesto Cantidad
Masa teórica del CuO 0.60 g
Masa recuperable del Cu 0.48 g
Masa teórica del Cu recuperable a 0.762 g
partir de 1.0071 g CuO
Observaciones
Al hacer reaccionar las láminas de cobre con el ácido nítrico esta se disolvió
formándose una solución de color verdoso con el desprendimiento de un gas café.
Al adicionar agua a la solución de 𝐶𝑢(𝑁𝑂3 )2 este cambio de color a turquesa que al
adicionarle la solución de hidróxido de sodio 3 M esta se volvió más opaca con un
aspecto gelatinoso.
Al calentar la solución esta cambia de color a negro observando cómo se precipita el
óxido de cobre II
Como la recuperación del óxido de cobre II es un proceso que toma demasiado tiempo
se tomó directamente 1.0071 de CuO
Conclusiones
Según los datos teóricos que se utilizaron el cobre pesado al inicio es casi la misma
masa que se tomó al inicio del ensayo por lo que es una manera de demostrar la
conservación de la masa en el proceso por lo que se puede inferir que el cobre puede
ser sometido a una serie de reacciones específicas y aun así poder ser recuperado en
su totalidad.
El hecho de que las reacciones del cobre ocurrieran en circunstancias extremas
(reactivos concentrados y de efecto fuerte) es evidencia de una baja reactividad del
cobre, por tal razón es fácilmente encontrado en estado puro en la naturaleza.
La reducción final del cobre, con lo cual se llega al metal puro nuevamente, debe
hacerse con zinc puesto que este metal presenta la reactividad adecuada para llevar a
cabo este proceso sin arriesgar el rendimiento del cobre.
El cobre es un metal industrial utilizado por el hombre desde hace bastantes años. Los
minerales de cobre contienen un porcentaje de metal bajo, por lo cual su primera fase de
producción es un proceso de concentración. El cobre es de color rojo, este metal es después
de la plata el mejor conductor de calor y electricidad, funde a 1100°C y es inalterable en
atmosfera de aire seco, si se encuentra expuesto a aire húmedo el cual contenga anhídrido
carbónico, este se cubre con una capa de hidróxido básico de cobre la cual se denomina
platina, esta protege al metal.
Você também pode gostar
- Indice de YodoDocumento64 páginasIndice de YodoPinkerton JD ICAinda não há avaliações
- Sasipa 06920 Rev 4Documento51 páginasSasipa 06920 Rev 4Lazaro73100% (4)
- Tipos de Empuje en YacimientosDocumento3 páginasTipos de Empuje en YacimientosGermanLuisCabreraAinda não há avaliações
- Obtencion de Pulpas InformeDocumento33 páginasObtencion de Pulpas InformeCesar QuesadaAinda não há avaliações
- Secado de MaterialesDocumento19 páginasSecado de MaterialesMauricio DiazAinda não há avaliações
- S10 AditivosDocumento39 páginasS10 AditivosArturo CeronAinda não há avaliações
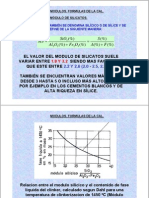
- Leccion11 CEMENTOS Modulos Formulascal aptitudCOCCIONDocumento23 páginasLeccion11 CEMENTOS Modulos Formulascal aptitudCOCCIONJorge AldoradinAinda não há avaliações
- Memorias de Calculo Alcantarillado TambopampaDocumento106 páginasMemorias de Calculo Alcantarillado Tambopampaamado2009Ainda não há avaliações
- Extraccion y Purificacion de MetabolitosDocumento50 páginasExtraccion y Purificacion de MetabolitosdeysiAinda não há avaliações
- Diseño de La Bobina:: Cañon de GaussDocumento4 páginasDiseño de La Bobina:: Cañon de GaussJean A. VasquezAinda não há avaliações
- Aqua TexDocumento2 páginasAqua TexCristal Far SaluAinda não há avaliações
- Protocolo HidrocicloDocumento9 páginasProtocolo HidrocicloCarlos Ulises IzquierdoAinda não há avaliações
- NC 345 Hormigon, Capilaridad y PorosidadDocumento9 páginasNC 345 Hormigon, Capilaridad y PorosidadFlorencia MüllerAinda não há avaliações
- Solucionario Cepru Grupo - ADocumento3 páginasSolucionario Cepru Grupo - AFrancisco Benavides SalazarAinda não há avaliações
- Fenómenos MolecularesDocumento6 páginasFenómenos MolecularesErick Serquen75% (4)
- Practica 13 de Quimica para Quinto de Sec Und AriaDocumento2 páginasPractica 13 de Quimica para Quinto de Sec Und AriasimplequimiquitaAinda não há avaliações
- Manual Limpieza y DesinfeccionDocumento29 páginasManual Limpieza y DesinfeccionRomel A. Lucero100% (1)
- TEMA Ácido - Base (ESP)Documento28 páginasTEMA Ácido - Base (ESP)diegoAinda não há avaliações
- Desarrollo Fase - 2 - AireDocumento16 páginasDesarrollo Fase - 2 - Aireyinet lopezAinda não há avaliações
- Practica de Sustitucion SimpleDocumento18 páginasPractica de Sustitucion SimpleRonaldo Escobar0% (1)
- Solución Cuestionario Practica 1Documento2 páginasSolución Cuestionario Practica 1Fernando LópezAinda não há avaliações
- Invernadero Construccion de InvernaderosDocumento37 páginasInvernadero Construccion de InvernaderosLorizar Ruiz100% (1)
- Pre 3 FQ2Documento8 páginasPre 3 FQ2Lesli RamirezAinda não há avaliações
- Materiales Radiactivos en El PetróleoDocumento7 páginasMateriales Radiactivos en El PetróleoMartin LertoraAinda não há avaliações
- Ciencia y Ambiente - 5to Primaria - III Trim PDFDocumento20 páginasCiencia y Ambiente - 5to Primaria - III Trim PDFMIRIAMAinda não há avaliações
- TL95Documento173 páginasTL95Hernan F Godoy78% (9)
- Tarea Nº5 (Química) OxígenoDocumento4 páginasTarea Nº5 (Química) Oxígenojaime perezAinda não há avaliações
- LyoQuest ManualDocumento61 páginasLyoQuest ManualByron LapoAinda não há avaliações
- Actividad Integradora 2 Como Se Contamina El AguaDocumento6 páginasActividad Integradora 2 Como Se Contamina El AguaEdgar Roel Acosta Carrillo100% (15)
- Ficha Tecnica MFI WIPERDocumento7 páginasFicha Tecnica MFI WIPERavillalobosgAinda não há avaliações