Escolar Documentos
Profissional Documentos
Cultura Documentos
CC Simples
Enviado por
Andrés QuitoraDireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
CC Simples
Enviado por
Andrés QuitoraDireitos autorais:
Formatos disponíveis
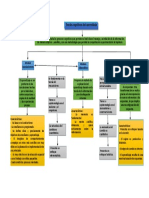
Existen diferentes tipos de enlaces, siendo el más fuerte, el enlace covalente, este enlace tiene la
particularidad de que los electrones de los átomos son compartidos y de este modo se forman las
distintas moléculas, desde la más básica, que es la que respiramos O2, hasta mucho mas complejas,
como grandes cadenas de carbono, por otro lado, en los enlaces iónicos, su fuerza es relativamente
en comparación con el covalente, es decir se necesita menor energía para romper dicho enlace, este
enlace generalmente, se presenta en sales, tal como, el cloruro de sodio, la formación de dicho enlace
se debe a las interacciones electrostáticas, que describen los procesos columbicos, entre las cargas
netas de los iones presentes en el proceso. Finalmente, se conoce que los metales se encuentran unidos
entre sí, a través de la existencia de un mar de electrones, que ocupan un espacio definido en el
espacio, dicho así es la agrupación de electrón-Huecos; a este fenómeno se le denomina como el
enlace metálico, que es lo que mantiene unido al Al2. (Cardenas, 2006).
Sin embargo, existe un tipo de compuestos, el cual no presenta ninguno de los enlaces previamente
mencionados, la formación de dichos compuestos no puede ser explicado mediante las teorías
convencionales de la repulsión de pares electrónicos en la capa de valencia, y su cercanía, con la
teoría de
Orbitales moleculares, no explica diversas propiedades de los enlaces que forman estos compuestos.
A estos se les conoce como compuestos de coordinación, y presentan enlaces entre metales y especies
capaces de donar pares de electrones, muy similar con la teoría acido base de Lewis, en la cual el
acido es el aceptor de electrones y la base es la donadora de electrones, en este caso el metal es el
átomo central que coordina, las diferentes especies conocidas como ligandos, dicho metal tiene la
capacidad de hibridar sus orbitales, para conseguir aceptar la mayor cantidad de pares de electrones
donados por los ligandos, de esta manera, se producen especies, cuya valencia primaria cumple la ley
del octeto, pero experimentalmente, se evidencia la formación de mas enlaces, que se explican
mediante la teoría de campo cristalino, que afirma, que cada metal, tiene dos tipos de valencia, y se
debe suplir ambas, siendo así, que este restante de enlaces corresponden a la valencia secundaria del
metal.
La formación de estos compuestos, tienen como característica principal, la aparición de soluciones
coloreadas, que corresponden a enlaces específicos, como en este caso, la sal de Mohr presenta una
coloración amarillosa, mientras, que el Triacuotrioxalatoferrato (III) de potasio, presenta un color
verde brillante, esto se debe a los desdoblamientos energéticos de cada uno de los orbitales de tipo D.
Você também pode gostar
- Anexo - Tarea 3Documento9 páginasAnexo - Tarea 3Andrés QuitoraAinda não há avaliações
- UVDocumento1 páginaUVAndrés QuitoraAinda não há avaliações
- JKJKJKKDocumento1 páginaJKJKJKKAndrés QuitoraAinda não há avaliações
- OxidosDocumento1 páginaOxidosAndrés QuitoraAinda não há avaliações
- Informe Del Sulfato de Tetraaminocobre (Ii)Documento4 páginasInforme Del Sulfato de Tetraaminocobre (Ii)Andrés QuitoraAinda não há avaliações
- HajsDocumento3 páginasHajsAndrés QuitoraAinda não há avaliações
- PendienteDocumento4 páginasPendienteAndrés QuitoraAinda não há avaliações
- JKJKJKKDocumento1 páginaJKJKJKKAndrés QuitoraAinda não há avaliações
- OxidosDocumento1 páginaOxidosAndrés QuitoraAinda não há avaliações
- HagatagaDocumento2 páginasHagatagaAndrés QuitoraAinda não há avaliações
- Informe III Compuestos-CoordinaciónDocumento6 páginasInforme III Compuestos-CoordinaciónDanielAngelPeñaBohorquezAinda não há avaliações
- TCCDocumento1 páginaTCCAndrés QuitoraAinda não há avaliações
- GagahshDocumento2 páginasGagahshAndrés QuitoraAinda não há avaliações
- Preinforme Yoduro de Diacuabis (Etilendiamina) Cobre (LL)Documento3 páginasPreinforme Yoduro de Diacuabis (Etilendiamina) Cobre (LL)Andrés QuitoraAinda não há avaliações
- NTC 3651 Medicion Del PHDocumento14 páginasNTC 3651 Medicion Del PHarodassanchez100% (1)
- TallerDocumento3 páginasTallerAndrés QuitoraAinda não há avaliações
- Código Sustantivo Del TrabajoDocumento4 páginasCódigo Sustantivo Del TrabajoJOMOMUAinda não há avaliações
- Síntesis y caracterización del sulfato de tetraaminocobre (IIDocumento1 páginaSíntesis y caracterización del sulfato de tetraaminocobre (IIAndrés QuitoraAinda não há avaliações
- Código Sustantivo Del TrabajoDocumento4 páginasCódigo Sustantivo Del TrabajoJOMOMUAinda não há avaliações
- Uy Muchacho Ustedes Si Escucharon Ese RempalagoDocumento1 páginaUy Muchacho Ustedes Si Escucharon Ese RempalagoAndrés QuitoraAinda não há avaliações
- Nuevo Documento de Microsoft WordDocumento1 páginaNuevo Documento de Microsoft WordAndrés QuitoraAinda não há avaliações
- Nuevo Documento de Microsoft WordDocumento1 páginaNuevo Documento de Microsoft WordAndrés QuitoraAinda não há avaliações
- El Futuro Gobierno Mundial de La BestiaDocumento42 páginasEl Futuro Gobierno Mundial de La BestiaLuar Rojas100% (1)
- El Arte de La Guerra - Sun TzuDocumento1 páginaEl Arte de La Guerra - Sun TzuAndrés QuitoraAinda não há avaliações
- Expo Tasas de InterésDocumento2 páginasExpo Tasas de InterésAndrés QuitoraAinda não há avaliações
- Nuevo Documento de TextoDocumento1 páginaNuevo Documento de TextoAndrés QuitoraAinda não há avaliações
- Curso de Hipnosis PDFDocumento29 páginasCurso de Hipnosis PDFAlbert GarciaAinda não há avaliações
- Nuevo Documento de TextoDocumento1 páginaNuevo Documento de TextoAndrés QuitoraAinda não há avaliações
- Diagrama IncertidumbreDocumento1 páginaDiagrama IncertidumbreAndrés QuitoraAinda não há avaliações
- Los AmorososDocumento2 páginasLos AmorososAlekzPlayAinda não há avaliações
- Funciones de Las Ciencias SocialesDocumento4 páginasFunciones de Las Ciencias Socialesd881372Ainda não há avaliações
- Control de Accesos Cap 5 3 RNDS 172WDocumento4 páginasControl de Accesos Cap 5 3 RNDS 172WCamilo Quiroga ArroyoAinda não há avaliações
- Celaya Gabriel Cantos Iberos PDFDocumento52 páginasCelaya Gabriel Cantos Iberos PDFGabriel AstudilloAinda não há avaliações
- Práctica Calificada 1 UnidoDocumento9 páginasPráctica Calificada 1 UnidoOmar Joel Castro AgurtoAinda não há avaliações
- 63 Extraccin de ColorantesDocumento5 páginas63 Extraccin de ColorantesVictor AcostaAinda não há avaliações
- Teorías CognitivasDocumento1 páginaTeorías CognitivasJonha GuevaraAinda não há avaliações
- 1 Exposicion de AbastecimientoDocumento40 páginas1 Exposicion de AbastecimientoFrank Bonzano BonzanoAinda não há avaliações
- El Chico Perfecto. Becca DevereuxDocumento204 páginasEl Chico Perfecto. Becca DevereuxVictor Ticllasuca QuispeAinda não há avaliações
- 2talleres Cuestion SocialDocumento3 páginas2talleres Cuestion Socialsantiago castilloAinda não há avaliações
- Uci Manejo Del Paciente Critico Covid - 19Documento130 páginasUci Manejo Del Paciente Critico Covid - 19Evanns Vela RuizAinda não há avaliações
- Diálogo intercultural y religioso: definiciones, religiones, semejanzas y diferenciasDocumento6 páginasDiálogo intercultural y religioso: definiciones, religiones, semejanzas y diferenciasKamille SánchezAinda não há avaliações
- Guía para El Diseño... Fibra OpticaDocumento36 páginasGuía para El Diseño... Fibra OpticaOctavio CharryAinda não há avaliações
- Instructor-Module-1 Resumen Del ProgramaDocumento21 páginasInstructor-Module-1 Resumen Del ProgramaOFICINA AREQUIPAAinda não há avaliações
- FT Guante Latex NaturalDocumento4 páginasFT Guante Latex NaturalPRODUCTOSNTDAinda não há avaliações
- El Cono Dinámico de PenetraciónDocumento13 páginasEl Cono Dinámico de PenetraciónDanilo ArguelloAinda não há avaliações
- E10MPET Duraplate 235 - 2013 PDFDocumento4 páginasE10MPET Duraplate 235 - 2013 PDFJorge NavarroAinda não há avaliações
- Normas técnicas bloques concretoDocumento10 páginasNormas técnicas bloques concretoEngel AmaruAinda não há avaliações
- Trabajo Final Fiscalizacion AmbientalDocumento70 páginasTrabajo Final Fiscalizacion AmbientalA Moisés Velasquez100% (1)
- Metrado I.E. Maria Del HuallagaDocumento9 páginasMetrado I.E. Maria Del HuallagaOmar InAvAinda não há avaliações
- Aplicaciones de Las Funciones A La Vida DiariaDocumento6 páginasAplicaciones de Las Funciones A La Vida Diariadefv.14Ainda não há avaliações
- HUESO ALVEOLAR - Presentacion JosueDocumento3 páginasHUESO ALVEOLAR - Presentacion Josueapi-3723571100% (9)
- Extracción de aceite esencial de eucaliptoDocumento44 páginasExtracción de aceite esencial de eucaliptoShedy BustinzaAinda não há avaliações
- Sueños LucidosDocumento2 páginasSueños LucidosSebastian LarrahondoAinda não há avaliações
- INOCUIDADDocumento36 páginasINOCUIDADRosita E. Viena HernándezAinda não há avaliações
- EXTRACCIONESDocumento6 páginasEXTRACCIONESArthas17Ainda não há avaliações
- Migración de Una Central Telefónica Analógica A Una Central Telefónica IpDocumento4 páginasMigración de Una Central Telefónica Analógica A Una Central Telefónica IpJonathan DelgadoAinda não há avaliações
- 7mo Historia Guía6Documento15 páginas7mo Historia Guía6jessica ortegaAinda não há avaliações
- Nutritivo Agar: Medio de cultivo no selectivoDocumento5 páginasNutritivo Agar: Medio de cultivo no selectivopaulaAinda não há avaliações
- Mi Negocio Verde EcobricksDocumento9 páginasMi Negocio Verde EcobricksAndrésAinda não há avaliações