Escolar Documentos
Profissional Documentos
Cultura Documentos
Labo de Fsicoquimica 2
Enviado por
Alexis navarro0 notas0% acharam este documento útil (0 voto)
8 visualizações2 páginastitulacion conductietrica
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
DOCX, PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentotitulacion conductietrica
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
8 visualizações2 páginasLabo de Fsicoquimica 2
Enviado por
Alexis navarrotitulacion conductietrica
Direitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato DOCX, PDF, TXT ou leia online no Scribd
Você está na página 1de 2
Fundamento Teórico
Para determinar la condición de equilibrio de una condición de equilibrio en un sistema
heterogéneo se recurre a la regla de las fases
𝑉 = 𝐶 + 𝑃 − 2 (Peña, 2005) …Ecuacion (1)
Donde:
V: Número de grados de libertad o variables independientes del sistema
C: Número de componentes
P: Número de fases
Un método experimental para determinar diagramas de fase es el análisis térmico, la cual
consiste en situar la disolución liquida o fundida en un recipiente y luego se procede a
eliminar el calor (enfriar a una velocidad estable y se mide la temperatura del sistema en
función del tiempo obteniendo la denominada curva de enfriamiento del sistema
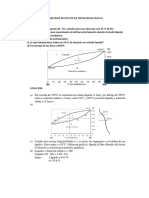
Figura 1: Diagrama de fase de un sistema binario
La Figura 1 muestra el diagrama de fases temperatura-composición a presión constante
típico de un sistema de dos líquidos totalmente miscibles que forman eutéctico simple.
Para poder construir un diagrama de este tipo se utilizan las curvas de enfriamiento de
sistemas de diferente composición.
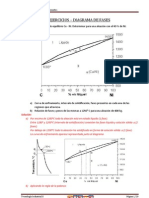
Figura 2: Curva de enfriamiento de una fase Binaria
La Figura 2 representa la curva de enfriamiento de una mezcla simple. La solución líquida
comienza a enfriarse, disminuyendo su temperatura a cierta velocidad (a1). A cierta
temperatura comienza a separarse un sólido formado por alguno de los componentes
puros. El congelamiento es un fenómeno exotérmico y por eso la velocidad de
enfriamiento disminuye (a2). A medida que el sólido se separa, la composición del líquido
se hace más rica en el otro componente y su temperatura de fusión disminuye. Cuando la
solución alcanza una cierta composición (la composición eutéctica) el sistema se congela
como si se tratase de una sustancia pura y la temperatura se mantiene constante (a3).
(Atkins, 1985)
Donde “TA” y “TB” son las temperaturas de fusión de los sólidos A y B puros. Las distintas
curvas separan las regiones donde el sistema presenta una o más fases. En la Región I,
cualquier punto corresponde al sistema formado por una solución homogénea. En la
región II, un punto corresponde a una situación en la que el sólido A puro coexiste en
equilibrio con una solución líquida de B disuelto en A. Una situación análoga corresponde
a la región III, con el sólido B en equilibrio con una solución de A disuelto en B. Por debajo
de la temperatura “Te”, en la región IV, existen los sólidos A y B y no puede observarse
ninguna solución líquida. A la temperatura Te se la llama temperatura eutéctica. Las
curvas “a” y “b” dan la dependencia de la composición de la solución líquida con la
temperatura. En términos generales, estas curvas indican cómo varía la solubilidad de A
en B o B en A en función de la temperatura. (Atkins, 1985)
Você também pode gostar
- Webmasterucss, SegoviaDocumento16 páginasWebmasterucss, SegoviaAlexis navarroAinda não há avaliações
- Práctica de Interés Simple - Jorge PaucarDocumento9 páginasPráctica de Interés Simple - Jorge PaucarAlexis navarroAinda não há avaliações
- Ahorro de Energia en Los Campos de Aplicacion de La Ingenieria QuimicaDocumento5 páginasAhorro de Energia en Los Campos de Aplicacion de La Ingenieria QuimicaAlexis navarroAinda não há avaliações
- 1era Clase - Ejecucion PenalDocumento6 páginas1era Clase - Ejecucion PenalAlexis navarroAinda não há avaliações
- Informe Del BoroDocumento5 páginasInforme Del BoroAlexis navarroAinda não há avaliações
- Informe N°9Documento25 páginasInforme N°9Alexis navarroAinda não há avaliações
- Fichas bibliográficas-SOBRE LA PENADocumento2 páginasFichas bibliográficas-SOBRE LA PENAAlexis navarro100% (1)
- Fichte Johann - Fundamentos Del Derecho Natural Segun Los Principios de La Doctrina de La Ciencia PDFDocumento418 páginasFichte Johann - Fundamentos Del Derecho Natural Segun Los Principios de La Doctrina de La Ciencia PDFAlexis navarroAinda não há avaliações
- Colaboracion Eficaz MonografiaDocumento10 páginasColaboracion Eficaz MonografiaAlexis navarroAinda não há avaliações
- El Problema de La Creación Del DerechoDocumento55 páginasEl Problema de La Creación Del DerechoAlexis navarro60% (5)
- Introducción A La Teoria Del DerechoDocumento230 páginasIntroducción A La Teoria Del DerechoAlexis navarro100% (2)
- TCHNDocumento77 páginasTCHNAlexis navarroAinda não há avaliações
- La Ética Protestante y El Espíritu Del CapitalismoDocumento7 páginasLa Ética Protestante y El Espíritu Del CapitalismoAlexis navarroAinda não há avaliações
- COLEMAN, Jules - Riesgos y DañosDocumento496 páginasCOLEMAN, Jules - Riesgos y DañosAlexis navarro100% (2)
- 5) NAKHNIKIAN, George. El Derecho y Las Teorías Éticas ContemporáneasDocumento78 páginas5) NAKHNIKIAN, George. El Derecho y Las Teorías Éticas ContemporáneasRuck CésarAinda não há avaliações
- Resumen de Derecho de Las ObligacionesDocumento25 páginasResumen de Derecho de Las ObligacionesAlexis navarroAinda não há avaliações
- Sesión 10 - Endurecimiento Por Segunda Fase y Diagramas de Fase EutécticosDocumento38 páginasSesión 10 - Endurecimiento Por Segunda Fase y Diagramas de Fase EutécticosJuan Manuel Galindo MAinda não há avaliações
- Curvas de CongelacionDocumento19 páginasCurvas de CongelacionTony100% (1)
- Modulo V Unidad I Endurecimiento Por DispersionDocumento8 páginasModulo V Unidad I Endurecimiento Por DispersionMoises De SedasAinda não há avaliações
- Liofilizacion - Ope 3Documento30 páginasLiofilizacion - Ope 3Daniela Caballero FioriloAinda não há avaliações
- 2-Dep Fecl3, Cucl, Tecl4Documento14 páginas2-Dep Fecl3, Cucl, Tecl4Diego GonzálezAinda não há avaliações
- Sublimacion y Punto de FusiónDocumento8 páginasSublimacion y Punto de FusiónJorgeJiménezAinda não há avaliações
- Suarez-Equilibrio de FasesDocumento14 páginasSuarez-Equilibrio de FasesSusan Jeny Suarez AbadAinda não há avaliações
- Informe 2Documento15 páginasInforme 2Piero MirandaAinda não há avaliações
- DF 04 Sistemas Binarios EutecticosDocumento26 páginasDF 04 Sistemas Binarios EutecticosLUIS ENRIQUE VILCA ESPINOZAAinda não há avaliações
- Practica 8 - DifusiónDocumento19 páginasPractica 8 - DifusiónJuan Francisco JácomeAinda não há avaliações
- 5 - Deformacion PlasticaDocumento23 páginas5 - Deformacion Plasticamarcuadrado5342Ainda não há avaliações
- Problemas Hoja2-Tema3Documento5 páginasProblemas Hoja2-Tema3ismaneytor2872000Ainda não há avaliações
- 6.1 Diagrama Fe-Fe3CDocumento53 páginas6.1 Diagrama Fe-Fe3CFrida MartinezAinda não há avaliações
- Un Grano y Como Se FormaDocumento5 páginasUn Grano y Como Se FormaValentina Paz Lineros BoschAinda não há avaliações
- Laboratorio de Fisicoquímica Grupo 3 Ing. Federico YujraDocumento10 páginasLaboratorio de Fisicoquímica Grupo 3 Ing. Federico YujraGuidoAinda não há avaliações
- Introduccion Ciencia Ingenieria Materiales CallisterDocumento11 páginasIntroduccion Ciencia Ingenieria Materiales CallisterJulian DiazAinda não há avaliações
- GRAFICAS 3.10 y 3.11Documento6 páginasGRAFICAS 3.10 y 3.11Cesar GarciaAinda não há avaliações
- Trabajo Final Reproduccion AvanzadaDocumento17 páginasTrabajo Final Reproduccion AvanzadaNELSON FONTALVO50% (2)
- Libro Del Tratamiento TermicoDocumento166 páginasLibro Del Tratamiento Termicopetete83% (12)
- Punto de FusionDocumento23 páginasPunto de FusionMichael Müller100% (1)
- Diagrama de Fases - Diagrama. Fe CDocumento85 páginasDiagrama de Fases - Diagrama. Fe CEnrique Diaz Rubio100% (1)
- ChemixDocumento10 páginasChemixErnesto FloresAinda não há avaliações
- Ejercicios de Metalurgia Fisica IIDocumento7 páginasEjercicios de Metalurgia Fisica IIGelbert Pedro Alzamora ValleAinda não há avaliações
- Ejercicios Resueltos Diagrama de Fases - Daniel Gomariz - Ingeniería IndustrialDocumento20 páginasEjercicios Resueltos Diagrama de Fases - Daniel Gomariz - Ingeniería IndustrialDaniel Gomariz63% (8)
- Diagrama de Fases de Un Sistema BinarioDocumento9 páginasDiagrama de Fases de Un Sistema BinarioJohn MontellanosAinda não há avaliações
- Examen 10 Por Ciento Segundo Corte 2022... 1Documento6 páginasExamen 10 Por Ciento Segundo Corte 2022... 1maria jose moretty MendozaAinda não há avaliações
- Ciencia e Ingenieria de Materia Askeland (2) - 429-431Documento3 páginasCiencia e Ingenieria de Materia Askeland (2) - 429-431michelleAinda não há avaliações
- CaracterizacionDocumento6 páginasCaracterizacion000yasAinda não há avaliações
- Tecnología de Procesos de Fundición de Aluminio Parte 2Documento90 páginasTecnología de Procesos de Fundición de Aluminio Parte 2Rodrigo MontalvoAinda não há avaliações
- Diagramas Tipo IIIDocumento5 páginasDiagramas Tipo IIIBrandon ArceAinda não há avaliações