Escolar Documentos
Profissional Documentos
Cultura Documentos
Tarea 7
Enviado por
Alberto Rosas SilvaDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Tarea 7
Enviado por
Alberto Rosas SilvaDireitos autorais:
Formatos disponíveis
Profesional
Evidencia
Nombre: Gastón Alberto Rosas Matricula: 2849700
Silva
Curso: Química industrial y Nombre del profesor: Cristina
sostenibilidad. Alejandra Rubio Guzmán
Modulo: Actividad: Tarea 7
Fecha: 21–02 -2018 Equipo: N/A
Bibliografía:
Manahan, S. (2006). Introducción a la química ambiental. México: Reverte.
ISBN: 968670860X
Capítulo 2. Química ambiental de la hidrósfera
Desarrolla los siguientes ejercicios:
1. Escribe en una tabla los nombres y símbolos de cuatro elementos de cada una
de las siguientes categorías:
a. Metal: Zinc (Zn), Cobre (Cu), Oro (Au), Hierro (Fe).
b. No metal: Carbono (C), Oxigeno (O), Nitrógeno (N), Fosforo (P), Selenio (Se).
c. Metaloide: Boro (B), Silicio (Si), Germanio (Ge), Arsénico (As).
2. Menciona en una tabla dos ejemplos de los siguientes grupos de elementos:
a. Metales alcalinos: Litio (Li), sodio (Na), potasio (K).
b. Metales alcalinotérreos: Berilio (Be), Magnesio (Mg), Calcio (Ca).
c. Halógenos: Flúor(F), Cloro(Cl), Bromo(Br).
d. Gases nobles: Helio (He), Neón (Ne), Argón (Ar).
3. Agrupa los siguientes elementos por pares, según sus propiedades químicas
semejantes: K, F, P, Na, Cl y N.
(F y Cl), (N y K) Y (P y N)
4. Acomoda los siguientes átomos en orden decreciente de su radio atómico:
Na (186), Mg (160), Al (143), P (128), Cl (99), VALORES EN PICOMETRO.
Profesional
Evidencia
5. Acomoda los elementos de cada uno de los siguientes grupos en orden
creciente, según la afinidad electrónica más positiva:
a. Li, Na, K. Respuesta: K, Na, Li.
b. F, Cl, Br, I Respuesta: I, Br, Ci, F.
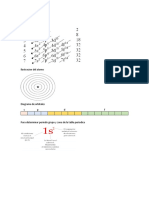
6. Enumera los posibles subniveles y orbitales asociados al número cuántico
principal n, si n=5.
Si n=5, hay 5 subniveles, que corresponden a l=0, l=1, l=2, l=3 y l=4, el número de
orbitales viene dado por nˆ2, luego 5ˆ2= 25 orbitales 2nˆ2, por lo tanto 2 x 5ˆ2=50
electrones.
7. Escribe la configuración electrónica de los siguientes elementos: O, C, Fe, F, Cu,
S, Ar, Ba, Cs, Po.
Configuración Electrónica.
Oxigeno 8= 1s2 2s2 2p4
Carbono 6 = 1s2 2s2 2p2
Fluor 9 = 1s2 2s2 2p2
Azufre 16 = 1s2 2s2 2p6 3s2 3p4
Você também pode gostar
- Guia de Ejercicios PropiedadesDocumento1 páginaGuia de Ejercicios Propiedadesgerardo carrasquilla8b carrasquilla8bAinda não há avaliações
- Taller Tabla PeriodicaDocumento2 páginasTaller Tabla PeriodicaAnonymous iMeuiHWzP6Ainda não há avaliações
- Instrumento Ideas Previas Reacciones QuímicasDocumento1 páginaInstrumento Ideas Previas Reacciones QuímicasAndrea LopezAinda não há avaliações
- Evaluacion de QuimicaDocumento4 páginasEvaluacion de Quimicamprm2579Ainda não há avaliações
- Temario BiologiaDocumento3 páginasTemario BiologiaCésar Ortiz BravoAinda não há avaliações
- Guia Estudio 3 - Inorganica - Reacciones Quimicas y EstequiometriaDocumento4 páginasGuia Estudio 3 - Inorganica - Reacciones Quimicas y EstequiometriaRicardo Joya Jaimes100% (1)
- Preguntas para 10Documento4 páginasPreguntas para 10Adriana LeónAinda não há avaliações
- Composicion PorcentualDocumento1 páginaComposicion PorcentualPamela Barahona0% (2)
- Guia 8 Compuestos Ternarios Acidos Oxacidos-Juan Jose Barco PachecoDocumento7 páginasGuia 8 Compuestos Ternarios Acidos Oxacidos-Juan Jose Barco PachecoJuan Jose Barco PachecoAinda não há avaliações
- Taller Hidruros Metalicos e Hidroxidos 04-09-2020Documento2 páginasTaller Hidruros Metalicos e Hidroxidos 04-09-2020wendyAinda não há avaliações
- Planeacion Semestral Ibio Enero14Documento20 páginasPlaneacion Semestral Ibio Enero14David SanchezAinda não há avaliações
- Guia 3 - Quimica 10° 2021Documento8 páginasGuia 3 - Quimica 10° 2021JR ÃêAinda não há avaliações
- Taller de DisolucionesDocumento3 páginasTaller de DisolucionesAndrea GomezAinda não há avaliações
- Guia para Planificacion Quimica OrganicaDocumento8 páginasGuia para Planificacion Quimica OrganicaRicardo SierraAinda não há avaliações
- Lista de Cotejo para SociodramaDocumento1 páginaLista de Cotejo para SociodramaLeo MontalvoAinda não há avaliações
- Trabajo Práctico Integrador Introducción A La QuímicaDocumento10 páginasTrabajo Práctico Integrador Introducción A La QuímicaMarisa RobertsAinda não há avaliações
- Ficha de Trabajo Sales OxisalesDocumento6 páginasFicha de Trabajo Sales OxisalesEnver Garcia100% (1)
- Guía de Aprendizaje-Nomenclatura de Compuestos OrganicosDocumento5 páginasGuía de Aprendizaje-Nomenclatura de Compuestos OrganicosVeronica Carrillo HernandezAinda não há avaliações
- Ficha Informativa Mol Tercer AñoDocumento2 páginasFicha Informativa Mol Tercer AñoPercy Gianmarco Acosta SalazarAinda não há avaliações
- 10o ACTIVIDAD QUIZ 2P PERIODICIDAD Y TABLA PERIODICA cyGB8DLDocumento4 páginas10o ACTIVIDAD QUIZ 2P PERIODICIDAD Y TABLA PERIODICA cyGB8DLDylan SalazarAinda não há avaliações
- Guia de Las Reacciones QuímicasDocumento14 páginasGuia de Las Reacciones QuímicasJoel ArismendiAinda não há avaliações
- ÓxidosDocumento7 páginasÓxidosOscar Reluz MuroAinda não há avaliações
- Lectura ALCOHOLESDocumento2 páginasLectura ALCOHOLESAlexander Daza100% (1)
- Guía de Diagnóstico - Química - 3°medio Diferenciado - 2020Documento2 páginasGuía de Diagnóstico - Química - 3°medio Diferenciado - 2020Juampa San Martín100% (1)
- Actividades de Apoyo 9° Quimica III Periodo PDFDocumento2 páginasActividades de Apoyo 9° Quimica III Periodo PDFhixemb100% (1)
- S03 - FT01 - Materia-1 Ficha de TrabajoDocumento10 páginasS03 - FT01 - Materia-1 Ficha de Trabajosashbelana100% (1)
- IAGR-2010-214 Agroquimica PDFDocumento11 páginasIAGR-2010-214 Agroquimica PDFjesus ricardo sanchezAinda não há avaliações
- Los Hidrocarburos para Tercero de SecundariaDocumento5 páginasLos Hidrocarburos para Tercero de SecundariaHansAguilarMendoza0% (1)
- Plan Destreza 9-10-11Documento7 páginasPlan Destreza 9-10-11Angel Vicente Sanchez PilcoAinda não há avaliações
- Problemas Tema 1 y 2Documento8 páginasProblemas Tema 1 y 2Elena Azaña FrancoAinda não há avaliações
- Actividades-Elementos-Quimicos SEM 1Documento2 páginasActividades-Elementos-Quimicos SEM 1Miguel PerezAinda não há avaliações
- Informe El Poder Amortiguador de Los AminoacidosDocumento7 páginasInforme El Poder Amortiguador de Los AminoacidosNicolle Arevalo0% (1)
- 1 Guía Estructura y Modelos Atómicos.Documento3 páginas1 Guía Estructura y Modelos Atómicos.Liliana HernándezAinda não há avaliações
- Configuracion Electronica Del CarbonoDocumento5 páginasConfiguracion Electronica Del CarbonoErika NapaAinda não há avaliações
- BIO 4 Comun Sistema InmuneDocumento2 páginasBIO 4 Comun Sistema InmuneInox94Ainda não há avaliações
- Guía Modelos AtómicosDocumento2 páginasGuía Modelos AtómicosLisi Gómez100% (1)
- Practica QuímicaDocumento15 páginasPractica Químicaheidi monestelAinda não há avaliações
- Ejercicios-Configuracion ElectronicaDocumento5 páginasEjercicios-Configuracion Electronicaomar aro criollo fabrisio100% (1)
- Guia 3 Tab Periodica P2Documento3 páginasGuia 3 Tab Periodica P2Nicol JaimesAinda não há avaliações
- Taller 1 Resuelto PDFDocumento14 páginasTaller 1 Resuelto PDFAngel HoyosAinda não há avaliações
- Cuaderno de LaboratorioDocumento1 páginaCuaderno de LaboratorioKathia CubillaAinda não há avaliações
- Taller de Enlace Quimico H H GDocumento11 páginasTaller de Enlace Quimico H H GJULLY MARCELA PACHON HUERTASAinda não há avaliações
- GUIA DEL ESTUDIANTE #1 DE 11° 2periodo.Documento9 páginasGUIA DEL ESTUDIANTE #1 DE 11° 2periodo.Didier IbarguenAinda não há avaliações
- Trabajo Práctico Oxido AcidoDocumento1 páginaTrabajo Práctico Oxido AcidomoonmassAinda não há avaliações
- TP 3 Lab SolubilidadDocumento2 páginasTP 3 Lab SolubilidadagrappaAinda não há avaliações
- Rubrica para Evaluar Un Proyecto de Ciencias para Imprimir OkDocumento4 páginasRubrica para Evaluar Un Proyecto de Ciencias para Imprimir OkMarcela Emilia Burgos MirandaAinda não há avaliações
- Semana 8 - Alcoholes, Fenoles y Éteres. Química OrgánicaDocumento50 páginasSemana 8 - Alcoholes, Fenoles y Éteres. Química OrgánicaAlejandro RomeroAinda não há avaliações
- Tarea7 Quimica IndustrialDocumento3 páginasTarea7 Quimica IndustrialrichipiAinda não há avaliações
- Balotario de Tabla PeriodicaDocumento10 páginasBalotario de Tabla PeriodicaOliver Malpartida CustodioAinda não há avaliações
- TEMA I Enlace QuimicoDocumento12 páginasTEMA I Enlace QuimicoEmely YoveraAinda não há avaliações
- Guia para Extraordinario Quimica I Prepa 128 2016Documento8 páginasGuia para Extraordinario Quimica I Prepa 128 2016GuadalupeAinda não há avaliações
- Tarea 7-1Documento4 páginasTarea 7-1Ximena Ramirez SorianoAinda não há avaliações
- TP de Quimica ElianDocumento6 páginasTP de Quimica Elianvalentina sanchezAinda não há avaliações
- Tema I Guia Quimica GeneralDocumento61 páginasTema I Guia Quimica GeneralAugusto Vasquez100% (1)
- GUIA Quimica UCVDocumento64 páginasGUIA Quimica UCVManuelDezaAinda não há avaliações
- Mario Reyes Mauricio G4 EAS3Documento4 páginasMario Reyes Mauricio G4 EAS3David Reyes MauricioAinda não há avaliações
- Evaluación Final de Quimica II-periodo - 2Documento3 páginasEvaluación Final de Quimica II-periodo - 2FernandaAinda não há avaliações
- Actividad de QuímicaDocumento8 páginasActividad de QuímicaNatalia Andrea GONZALEZ ZULETAAinda não há avaliações
- Semana 4 Tabla PeriódicaDocumento20 páginasSemana 4 Tabla PeriódicaJhon EspinozaAinda não há avaliações
- Evidencia Final 2022Documento8 páginasEvidencia Final 2022Alberto Rosas SilvaAinda não há avaliações
- Actividad 1Documento9 páginasActividad 1Alberto Rosas SilvaAinda não há avaliações
- Evidencia-Final AnalisisDocumento14 páginasEvidencia-Final AnalisisAlberto Rosas SilvaAinda não há avaliações
- Evidencia 2Documento7 páginasEvidencia 2Alberto Rosas SilvaAinda não há avaliações
- Evidencia 1Documento6 páginasEvidencia 1Alberto Rosas SilvaAinda não há avaliações
- TAREA 6 QuimicaDocumento2 páginasTAREA 6 QuimicaAlberto Rosas SilvaAinda não há avaliações
- Evidencia 1Documento6 páginasEvidencia 1Alberto Rosas SilvaAinda não há avaliações
- Evidencia 1Documento5 páginasEvidencia 1Alberto Rosas SilvaAinda não há avaliações
- Tarea 3Documento4 páginasTarea 3Alberto Rosas SilvaAinda não há avaliações
- Tarea 9Documento1 páginaTarea 9Alberto Rosas Silva100% (1)
- Quimica Evidencia 1Documento5 páginasQuimica Evidencia 1Alberto Rosas SilvaAinda não há avaliações
- Tarea 8 Quimica IndustrialDocumento2 páginasTarea 8 Quimica IndustrialAlberto Rosas SilvaAinda não há avaliações
- Quimica Industrial Tarea 4Documento2 páginasQuimica Industrial Tarea 4Alberto Rosas Silva100% (1)
- Evidencia 2 Quimica.Documento6 páginasEvidencia 2 Quimica.Alberto Rosas SilvaAinda não há avaliações
- Actividad 8Documento3 páginasActividad 8Alberto Rosas SilvaAinda não há avaliações
- Informe Técnico (Rueda Dentada Seridme)Documento7 páginasInforme Técnico (Rueda Dentada Seridme)Aura Milena Casseres RodriguezAinda não há avaliações
- Defectos Del PrensadoDocumento22 páginasDefectos Del PrensadoRaybert MartinezAinda não há avaliações
- Practica 1 Perfil SueloDocumento1 páginaPractica 1 Perfil SueloJuan Manuel Salazar MataAinda não há avaliações
- Matriz de LeopoldDocumento3 páginasMatriz de LeopoldYaneth Aranda100% (2)
- Instituto Universitario Politecnico Santiago MariñoDocumento3 páginasInstituto Universitario Politecnico Santiago MariñoFelipe Santiago Rincon100% (1)
- SIMULACIONDocumento3 páginasSIMULACIONEddy De la CruzAinda não há avaliações
- Chirajara Final Presentation SP 4-24-18pdfDocumento45 páginasChirajara Final Presentation SP 4-24-18pdfCristian OrozcoAinda não há avaliações
- Mando Directo e Indirecto Regulación de Velocidad V2 PDFDocumento17 páginasMando Directo e Indirecto Regulación de Velocidad V2 PDFRonald Cuenta MamaniAinda não há avaliações
- A2-2-Cuadernillo Diseño Urbano 2014Documento6 páginasA2-2-Cuadernillo Diseño Urbano 2014Maqui FabioAinda não há avaliações
- FDS Dynatrans AC SAE 30-01 PDFDocumento8 páginasFDS Dynatrans AC SAE 30-01 PDFGerardo Pizarro NaveasAinda não há avaliações
- Acido 35 DinitrosaliclicoDocumento5 páginasAcido 35 DinitrosaliclicoImanol Cuevas MedinaAinda não há avaliações
- Cotizacion Proyecto Arquitectonico Piedrancha-NariñoDocumento5 páginasCotizacion Proyecto Arquitectonico Piedrancha-NariñoStiven ParedesAinda não há avaliações
- Compresores ReciprocantesDocumento11 páginasCompresores ReciprocantesOyuki Maqueda100% (1)
- Práctica Calificada 2 Integrantes:: I. Dop - DapDocumento5 páginasPráctica Calificada 2 Integrantes:: I. Dop - Dapestrella coralAinda não há avaliações
- Ejercicios 03 Voraz LabDocumento3 páginasEjercicios 03 Voraz LabEmanuel ChusgoAinda não há avaliações
- M.A ÓpticaDocumento31 páginasM.A ÓpticaTobe CabreraAinda não há avaliações
- Funcionamiento Del Sistema de Abastecimiento Urbano Del Estado LaraDocumento3 páginasFuncionamiento Del Sistema de Abastecimiento Urbano Del Estado LaraStephany DiasAinda não há avaliações
- Norma NTG 41085-Gua Instalacin de Adoquines PDFDocumento43 páginasNorma NTG 41085-Gua Instalacin de Adoquines PDFLuis JimenezAinda não há avaliações
- Topografía Agrícola I Clase 1Documento9 páginasTopografía Agrícola I Clase 1Cristina AlcaAinda não há avaliações
- Resumen Mecanismo Físico de EbulliciónDocumento2 páginasResumen Mecanismo Físico de EbulliciónWilTolosaAinda não há avaliações
- Diapos de Sedimentacion Meneses Falta GraficosDocumento28 páginasDiapos de Sedimentacion Meneses Falta GraficosClaudiaPalominoZelayaAinda não há avaliações
- Aplicaciones de Los PLC en La IndustriaDocumento9 páginasAplicaciones de Los PLC en La IndustriaOn Sale100% (1)
- Practica 3-Extraccion de Aceite de CocoDocumento24 páginasPractica 3-Extraccion de Aceite de CocoStefany FG42% (12)
- Capítulo III. Manual de Construcción de Vivienda en Madera.Documento87 páginasCapítulo III. Manual de Construcción de Vivienda en Madera.Franco MauricioAinda não há avaliações
- Copia de FC-SAS-005 Informe Diario 15.10Documento104 páginasCopia de FC-SAS-005 Informe Diario 15.10wendy shulay mejia huallpaAinda não há avaliações
- Asignación para Arquitectura Del ComputadorDocumento4 páginasAsignación para Arquitectura Del ComputadorGeorge MoraAinda não há avaliações
- Unidad 3 - 2021Documento147 páginasUnidad 3 - 2021MIGUEL DIOGENES RAMOS RODRIGUEZAinda não há avaliações
- Factores Preponderantes en La Localización de PlantaDocumento20 páginasFactores Preponderantes en La Localización de PlantaCristian Camilo Rico BallesterosAinda não há avaliações
- Subconsultas SQL ServerDocumento7 páginasSubconsultas SQL ServerYefferson Socla Urbano0% (1)
- Manual de Operacion y MantenimientoDocumento2 páginasManual de Operacion y MantenimientoYIMY YANQUEAinda não há avaliações