Escolar Documentos
Profissional Documentos
Cultura Documentos
.Discusión de Resultados
Enviado por
CARLADireitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
.Discusión de Resultados
Enviado por
CARLADireitos autorais:
Formatos disponíveis
Discusión de Resultados
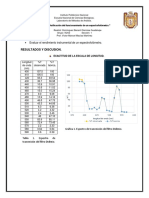
Otro factor que influye en este método es el tiempo de duración de la reacción ( del producto
colorido), las lecturas se realizaron en intervalos de 30 minutos obteniéndose una
disminución de la absorbancia de tal modo que esto nos indica que la reacción presenta
inestabilidad, dicho comportamiento se podría asociar a que la reacción es reversible por la
inestabilidad completa de la molécula, por lo tanto el tiempo optimo para hacer las lecturas
es al minuto 0, ya que es cuando la absorbancia obtenida se acerca mas al punto centra de
la curva de calibración y donde se presenta el error fotométrico mínimo.
La concentración del cromógeno es otro mecanismo que también hay que tomar en cuenta
ya que de este depende que haya una máxima absorbancia. Se observó un comportamiento
lineal que después la pendiente de dicho comportamiento se fue reduciendo, el porqué de
esto se explica en que la ley de Beer es ideal para poder describir la absorción de soluciones
las cuales no tengan un alto contenido de nuestra, debido a que la absorción que presentan
estos analitos se ven afectadas por la distribución de las moléculas de manera que si hay
muchas moléculas interactuando, la interacción interferiría en la capacidad de absorción de
cada molécula disminuyéndola y esto a su vez se refleja en una desviación a la ley de Beer.
Cabe mencionar que este efecto no solo se refiere a grandes concentraciones del analito
si no también incluye que existan altas concentraciones de alguna otra especie. Debido a
esto es importante saber el punto de saturación.
El pH puede llegar a afectar la reacción por lo cual hay que saber en cual se desempeña
mejor la reacción, en nuestro caso pudimos darnos cuenta de que la reacción se debe llevar
a cabo en un pH acido de alrededor de 2 (pH ácido se mantiene el sistema colorido.
Conforme aumenta el valor de pH, el sistema pierde la capacidad de absorción de la
radiación y se obtienen absorbancias muy bajas.) porque en pH alcalino el cromógeno
(SCN-) se neutraliza evitando la reacción con el ion Fe3+ haciendo que no haya desarrollo
de color y por lo tanto nos de falsos negativos.
Y por último pudimos notar que la presencia de ciertos aniones en la reacción logra interferir
y modificar el desarrollo de dicha reacción (modificación en el color) lo que ocasiona que
haya una disminución en cuanto a los valores de absorbancia. De modo que existe una
competencia entre algunos aniones, como el fluoruro o el oxalato por el hierro. Ya que el
fluoruro al ser muy electronegativo se ve atraído por las cargas positivas del hierro, y el
oxalato tiende a formar un nuevo complejo de tres moléculas de oxalato por un catión
férrico.
Você também pode gostar
- Bioquímica Informe N°8 y 9 - Cinética EnzimáticaDocumento22 páginasBioquímica Informe N°8 y 9 - Cinética EnzimáticaMestizo Sinalefa50% (6)
- Metodo Lowry proteínasDocumento7 páginasMetodo Lowry proteínasAracely Sandalio100% (1)
- Modelamiento y casos especiales de la cinética química heterogéneaNo EverandModelamiento y casos especiales de la cinética química heterogéneaNota: 3 de 5 estrelas3/5 (1)
- Materiales Ópticos y OptoelectrónicosDocumento9 páginasMateriales Ópticos y OptoelectrónicosginyAinda não há avaliações
- Factores que afectan método espectrofotométrico Fe3Documento10 páginasFactores que afectan método espectrofotométrico Fe3Jose Manuel Miranda Onofre67% (3)
- Actividad EnzimaticaDocumento16 páginasActividad EnzimaticaDano DinoAinda não há avaliações
- Isomería geométrica cis-transDocumento4 páginasIsomería geométrica cis-transElusaAinda não há avaliações
- PRÁCTICA N 3 QMC-104 LabDocumento11 páginasPRÁCTICA N 3 QMC-104 LabGunnar Leonardo Gutiérrez Quisbert0% (1)
- Métodos quelométricos y otros métodos volumétricos de análisis clínicosNo EverandMétodos quelométricos y otros métodos volumétricos de análisis clínicosAinda não há avaliações
- Separación de Una Mezcla de Azul de Metileno y Fluoresceína Usando Cromatografía Por Adsorción.Documento6 páginasSeparación de Una Mezcla de Azul de Metileno y Fluoresceína Usando Cromatografía Por Adsorción.Jose Manuel Miranda OnofreAinda não há avaliações
- Métodos de Análisis. Práctica 3Documento2 páginasMétodos de Análisis. Práctica 3Scourge BlackthornAinda não há avaliações
- Concentracion de Enzima y PHDocumento2 páginasConcentracion de Enzima y PHGuillermoAinda não há avaliações
- AdsorciónDocumento3 páginasAdsorciónotro masAinda não há avaliações
- Labo 3 Orga2Documento16 páginasLabo 3 Orga2Fabbian ZegarraAinda não há avaliações
- Determinación de CA Por AADocumento8 páginasDeterminación de CA Por AA9991529Ainda não há avaliações
- Practica 5 Cinetica Custionario, Conclusion y ObservacionesDocumento2 páginasPractica 5 Cinetica Custionario, Conclusion y ObservacionesCarlos JimenezAinda não há avaliações
- Informe de NitraciónDocumento6 páginasInforme de Nitraciónandres guerreroAinda não há avaliações
- Desviaciones de La Ley de LambertDocumento4 páginasDesviaciones de La Ley de Lambertjhudit100% (1)
- Informe Alfa AmilasaDocumento4 páginasInforme Alfa Amilasajuan diego espitia suarezAinda não há avaliações
- Práctica 1 - Cinética Por EspectrofotometríaDocumento9 páginasPráctica 1 - Cinética Por EspectrofotometríaSoniaAinda não há avaliações
- Determinacion Del PH y Temperatura Optimos de Una AmilasaDocumento5 páginasDeterminacion Del PH y Temperatura Optimos de Una AmilasajimenezquinterosAinda não há avaliações
- Practica 5 Discusiones y ConclusionesDocumento1 páginaPractica 5 Discusiones y ConclusionesLizeth SánchezAinda não há avaliações
- Informe de Laboratorio 3Documento6 páginasInforme de Laboratorio 3Nataly Hxijani Olaya Camelo100% (1)
- Determinación de Acción EnzimáticaDocumento10 páginasDeterminación de Acción Enzimáticalicanoxd100% (1)
- ApuntesDocumento2 páginasApuntesSolange RiveraAinda não há avaliações
- Discusion de Resultados en Otro DocumentoDocumento4 páginasDiscusion de Resultados en Otro DocumentoSELENAAinda não há avaliações
- Informe Laboratorio Reacciones Quimicas Grupo 5Documento4 páginasInforme Laboratorio Reacciones Quimicas Grupo 5Dianelis SanchezAinda não há avaliações
- Trabajo Final ViverosDocumento7 páginasTrabajo Final ViverosBig PoppaAinda não há avaliações
- Regulación EnzimáticaDocumento9 páginasRegulación EnzimáticaJl HmAinda não há avaliações
- Determinación de Peroxidasa de RábanoDocumento10 páginasDeterminación de Peroxidasa de Rábanojhonder VelozAinda não há avaliações
- Cinetica Enzimatica (Bioquimica)Documento17 páginasCinetica Enzimatica (Bioquimica)Carlos DíazAinda não há avaliações
- Metodo de JobDocumento9 páginasMetodo de JobDaniela Orozco CardonaAinda não há avaliações
- Borrador Lab 4 ChemDocumento4 páginasBorrador Lab 4 ChemYuliana TagleAinda não há avaliações
- Estequiometría, Reactivo Límite, Punto Estequiométrico y PurezaDocumento5 páginasEstequiometría, Reactivo Límite, Punto Estequiométrico y PurezaanaAinda não há avaliações
- Tipos de interferencias en espectroscopia de absorción atómica y sus métodos de correcciónDocumento2 páginasTipos de interferencias en espectroscopia de absorción atómica y sus métodos de correcciónLeandroFuentesMedinaAinda não há avaliações
- Reporte Practica 1 Lab ReactoresDocumento20 páginasReporte Practica 1 Lab ReactoreslazaroAinda não há avaliações
- α-amilasa pH efectoDocumento2 páginasα-amilasa pH efectoNick Renzo Barzola YauceAinda não há avaliações
- Metodos CinéticosDocumento7 páginasMetodos CinéticosBeto0893Ainda não há avaliações
- Manual Práctica R. Catalitico PDFDocumento19 páginasManual Práctica R. Catalitico PDFAndrea ArenalesAinda não há avaliações
- ESTUDIO DE LA CINETICA DE OXIDACION DEL ION YODURO CON PERSULFATODocumento10 páginasESTUDIO DE LA CINETICA DE OXIDACION DEL ION YODURO CON PERSULFATOEdwin Roger AranibarAinda não há avaliações
- Informe RedoxDocumento6 páginasInforme RedoxMaria Paula Bastidas JAinda não há avaliações
- INFORME Reacciones Quimicas en Disolucion AcuosaDocumento14 páginasINFORME Reacciones Quimicas en Disolucion AcuosaJhon William Fabricio Hurtado ToledoAinda não há avaliações
- Ed Quim RelojDocumento7 páginasEd Quim RelojFalcondrackAinda não há avaliações
- Informe Cambios Físicos y QuímicosDocumento8 páginasInforme Cambios Físicos y QuímicosStephany Rodríguez MosqueraAinda não há avaliações
- Practica QuimicaDocumento1 páginaPractica Quimicagillmanbeltre19Ainda não há avaliações
- Grado de Conversión de Una ReacciónDocumento7 páginasGrado de Conversión de Una ReacciónUbeiden Cifuentes0% (1)
- Efecto concentración enzima y pH actividad sacarosaDocumento2 páginasEfecto concentración enzima y pH actividad sacarosaObed Hurtado CervantesAinda não há avaliações
- Estudio factores espectrofotométrico Fe3Documento10 páginasEstudio factores espectrofotométrico Fe3Jordan Josue TorresAinda não há avaliações
- Cromatografía de capa fina UNAM Facultad de QuímicaDocumento8 páginasCromatografía de capa fina UNAM Facultad de QuímicaGarcia Ortiz Juan PabloAinda não há avaliações
- Prueba de LowryDocumento4 páginasPrueba de LowryErick Amador GaytánAinda não há avaliações
- Enzimas OxidoreduccionDocumento3 páginasEnzimas OxidoreduccionJan Alexis Cedillo AlcantaraAinda não há avaliações
- Práctica 5. Factores Que Afectan La Actividad EnzimáticaDocumento14 páginasPráctica 5. Factores Que Afectan La Actividad EnzimáticaSara Chacon BernalAinda não há avaliações
- P4.Cinética de Halogenación de La AcetonaDocumento5 páginasP4.Cinética de Halogenación de La Acetonalindapao07Ainda não há avaliações
- Laboratorio 4 BQDocumento13 páginasLaboratorio 4 BQLEONARDO V�CTOR EUGENIO PACHAS QUISPEAinda não há avaliações
- Enzima CatalasaDocumento4 páginasEnzima CatalasaSebas RamosAinda não há avaliações
- Cuestionario Q.A. 12Documento3 páginasCuestionario Q.A. 12Monica VasquezAinda não há avaliações
- Descomposición Catalítica Del Peróxido de HidrógenoDocumento5 páginasDescomposición Catalítica Del Peróxido de HidrógenoHugo Cruz GalindoAinda não há avaliações
- Determinación de proteínas LowryDocumento8 páginasDeterminación de proteínas LowryEduardo LobitoAinda não há avaliações
- Cinética EnzimáticaDocumento17 páginasCinética EnzimáticaGianny SRAinda não há avaliações
- Cinética reacción verde brillante NaOHDocumento9 páginasCinética reacción verde brillante NaOHKarina OvalleAinda não há avaliações
- Quimica General II Laboratorio n4 (Autoguardado)Documento13 páginasQuimica General II Laboratorio n4 (Autoguardado)Jazmin Flores MondragónAinda não há avaliações
- Evaluar El Rendimiento Instrumental de Un EspectrofotómetroDocumento7 páginasEvaluar El Rendimiento Instrumental de Un EspectrofotómetroCARLAAinda não há avaliações
- PlagioDocumento2 páginasPlagioCARLAAinda não há avaliações
- TincionsimpleDocumento2 páginasTincionsimpleCARLAAinda não há avaliações
- HPLCDocumento2 páginasHPLCCARLAAinda não há avaliações
- Objetiv oDocumento2 páginasObjetiv oCARLAAinda não há avaliações
- 4 Practica QuimicaDocumento7 páginas4 Practica QuimicaCARLAAinda não há avaliações
- 4 Practica QuimicaDocumento7 páginas4 Practica QuimicaCARLAAinda não há avaliações
- La Cromatografía Por Intercambio Iónico Es Logísticamente Similar A La Cromatografía Por AfinidadDocumento1 páginaLa Cromatografía Por Intercambio Iónico Es Logísticamente Similar A La Cromatografía Por AfinidadCARLAAinda não há avaliações
- Características EstructuralesDocumento14 páginasCaracterísticas EstructuralesCARLAAinda não há avaliações
- Smallseotools 1570164767Documento2 páginasSmallseotools 1570164767CARLAAinda não há avaliações
- Presentación 1Documento2 páginasPresentación 1CARLAAinda não há avaliações
- Características EstructuralesDocumento14 páginasCaracterísticas EstructuralesCARLAAinda não há avaliações
- 1 SM PDFDocumento8 páginas1 SM PDFRenato Guzman MurgaAinda não há avaliações
- Discusión de ResultadosDocumento1 páginaDiscusión de ResultadosCARLAAinda não há avaliações
- Reporte PRÁCTICA 2Documento4 páginasReporte PRÁCTICA 2CARLA100% (1)
- Alergia SDocumento9 páginasAlergia SCARLAAinda não há avaliações
- Smallseotools 1570412931Documento2 páginasSmallseotools 1570412931CARLAAinda não há avaliações
- Casein Glue ActivityDocumento6 páginasCasein Glue Activitymaya9613Ainda não há avaliações
- Smallseotools 1570164767Documento2 páginasSmallseotools 1570164767CARLAAinda não há avaliações
- Smallseotools 1570164767Documento2 páginasSmallseotools 1570164767CARLAAinda não há avaliações
- HojaDocumento2 páginasHojaCARLAAinda não há avaliações
- Smallseotools 1568938539Documento1 páginaSmallseotools 1568938539CARLAAinda não há avaliações
- Quimica Del CafeDocumento9 páginasQuimica Del CafeCARLA100% (1)
- TemperaturaDocumento2 páginasTemperaturaCARLAAinda não há avaliações
- En ZimasDocumento1 páginaEn ZimasCARLAAinda não há avaliações
- ComprobanteHorarioDocumento1 páginaComprobanteHorarioCARLAAinda não há avaliações
- Practica KunitzDocumento6 páginasPractica KunitzCARLAAinda não há avaliações
- DiscusionDocumento1 páginaDiscusionCARLAAinda não há avaliações
- Guía de Ejercicios Ciclo de Otto y DieselDocumento3 páginasGuía de Ejercicios Ciclo de Otto y DieselCesar Rodriigzz' Bracho100% (1)
- Práctica No 4Documento9 páginasPráctica No 4Maria JimenezAinda não há avaliações
- Biol 01Documento4 páginasBiol 01davidAinda não há avaliações
- INTEGRACIÓN DE LA SEGURIDAD DE PROCESOS EN UN PLAN DE Ingeniería QuímicaDocumento10 páginasINTEGRACIÓN DE LA SEGURIDAD DE PROCESOS EN UN PLAN DE Ingeniería QuímicaRaúlAinda não há avaliações
- 3RP15601SP30 Datasheet EsDocumento5 páginas3RP15601SP30 Datasheet EsDionisio Ivan Martinez MercadoAinda não há avaliações
- Ejercicios de DinamicaDocumento11 páginasEjercicios de DinamicaJulio Serrano Tornell40% (5)
- Reactores y Termodinàmica. 1ra EvaluaciònDocumento2 páginasReactores y Termodinàmica. 1ra EvaluaciònSotilllo Yerbes UbencioAinda não há avaliações
- Diseño torre destilación crudoDocumento9 páginasDiseño torre destilación crudoAndres PerezAinda não há avaliações
- Práctica de Laboratorio No. 2-Operaciones Analíticas FundamentalesDocumento6 páginasPráctica de Laboratorio No. 2-Operaciones Analíticas FundamentalesMirtha Ochoa Gamarra100% (2)
- AMONOLISISDocumento25 páginasAMONOLISISMicaela Gómez Beauvoir80% (10)
- Formulario de Física (Repaso)Documento3 páginasFormulario de Física (Repaso)Alan AlfonsoAinda não há avaliações
- Estructura molecular-OrganiGramaDocumento5 páginasEstructura molecular-OrganiGramaDewis Duar Moreno CottaAinda não há avaliações
- Informe Medicion de Campo TerrestreDocumento4 páginasInforme Medicion de Campo TerrestreAngelaAinda não há avaliações
- 5.1 Sesion 08 Circuitos - Series - DiagramasDocumento51 páginas5.1 Sesion 08 Circuitos - Series - DiagramasMinion WeedAinda não há avaliações
- Cultivo Por Lotes PichiaDocumento53 páginasCultivo Por Lotes PichiaJavier Farfán ZapataAinda não há avaliações
- User Manual Acer 1.0 A ADocumento29 páginasUser Manual Acer 1.0 A AHumberto GarciaAinda não há avaliações
- Compuestos BinariosDocumento7 páginasCompuestos BinariosSanti Obando100% (2)
- Producción de CiclohexanolDocumento13 páginasProducción de CiclohexanolPaula Andrea Diaz CastiblancoAinda não há avaliações
- Cap06 Registros ResistivosDocumento43 páginasCap06 Registros ResistivosNes SuarezAinda não há avaliações
- Cambio de Fases en Sustancias Puras Unidad 2Documento39 páginasCambio de Fases en Sustancias Puras Unidad 2kevinmc 181Ainda não há avaliações
- 114934tema6 CMN Marzo 2021 (16343)Documento23 páginas114934tema6 CMN Marzo 2021 (16343)Laura Salvatierra MonfortAinda não há avaliações
- 04 Presa Limon-Olmos Analisis de Filtracion-Riesgos e IncertidumbresDocumento10 páginas04 Presa Limon-Olmos Analisis de Filtracion-Riesgos e IncertidumbresGRESSELINAinda não há avaliações
- 3 Estática-2Documento7 páginas3 Estática-2M A Parra CaperaAinda não há avaliações
- CalorEspecAlumDocumento4 páginasCalorEspecAlumIván Cruz PacaraAinda não há avaliações
- Los Componentes Del Suelo, Fase Sólida PDFDocumento45 páginasLos Componentes Del Suelo, Fase Sólida PDFAzly VasquEzAinda não há avaliações
- Informe 6 Organica 2 Fiqt UniDocumento14 páginasInforme 6 Organica 2 Fiqt UniLeo Alexander VAAinda não há avaliações
- Trabajo de f2Documento64 páginasTrabajo de f2Therock JayoAinda não há avaliações
- Valoraciones Acido-Base PDFDocumento43 páginasValoraciones Acido-Base PDFLAURA GABIR VERGARAAinda não há avaliações
- Agua: solvente vitalDocumento5 páginasAgua: solvente vitalMiguel GlzAinda não há avaliações