Escolar Documentos
Profissional Documentos
Cultura Documentos
JJJ
Enviado por
MARIO JULIAN DELGADO GELVESTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
JJJ
Enviado por
MARIO JULIAN DELGADO GELVESDireitos autorais:
Formatos disponíveis
Universidad Industrial de Santander
Facultad de Ciencias
Escuela de Química
Biología Celular (24720)
Taller de estudio # 1: pH y soluciones amortiguadoras
1. La niacina, una de las vitaminas del complejo B, tiene la estructura molecular siguiente:
Una solución 0.020M de Niacina tiene un pH de 3.26, determine:
a. ¿Cuál es la constante de disociación ácida, Ka, de la niacina? (Rta:1.5x10-5)
b. Determine la base conjugada para éste ácido (la niacina es capaz de
ceder un sólo protón, el cual está unido al grupo carboxilo)
2. La Ka (constante ácida) de la niacina es 1.5x10-5. ¿Cuál es el pH de una solución 0.01M de
niacina? (Rta. pH=3.41)
3. Calcule el porcentaje de moléculas de HF (ácido débil, Ka=6.8x10-4) ionizadas en:
a. Una solución 0.1M de HF (Rta. 8.2%)
b. Una solución 0.01M de HF
4. Calcule el porcentaje de moléculas ionizadas de niacina en:
a. La solución de niacina 0.2 M (Respuesta: 0,86%)
b. La solución de niacina 1x10-3M
5. La solubilidad del CO2 en agua pura a 25°C y 0.1 atmosferas de presión es 0.0037M. Es
práctica común suponer que todo el dióxido de carbono disuelto está en forma de ácido
carbónico, H2CO3 (ácido diprótico), el cual se produce por la reacción entre el CO2 y el agua:
CO2 (g) + H2O H2CO3
¿Cuál es el pH de una solución 0.0037M de ácido carbónico? (Respuesta: pH =4.40)
Nota: El ácido carbónico tiene dos constantes de disociación, Ka1=4.3x10-7 y Ka2=5.6x10-11.
6. Calcule la concentración [OH] en una solución 0.15M de NH3 (amoniaco, Kb=1.8x10-5).
(Respuesta: [OH]=1.6x10-3M])
7. Calcule el pH de la solución anterior. (Rta. pH=11.21)
8. ¿Cuál de los compuestos siguientes deberían producir el pH más alto cuando están en solución
0.05M?
a. Piridina (C5H5N, Kb= 1.7x10-9)
b. Metilamina (CH3NH2, Kb= 4.4x10-4)
c. Ácido nitroso (HNO2, Ka= 4.5x10-4)
9. Una solución de amoniaco (NH3) en agua tiene un pH de 10.50 ¿Cuál es la molaridad (M) de la
solución?
10. Calcule el pH de una solución que contiene ácido nitroso 0.15M (HNO2, ácido débil,
Ka=4.5x10-4) y nitrito de potasio, KNO2, 0.1M. Recuerde efecto del ión común. (Respuesta:
pH=3.14)
11. Compare el pH de la solución anterior con el pH de una solución de ácido nitroso 0.1M.
¿Observa algún cambio de [H+] en las soluciones preparadas?
12. Calcule la concentración del ión fluoruro y el pH de una solución que contiene 0.1mol de HCl y
0.2 moles de HF en 1 litro de solución.
William Hidalgo Bucheli, M.Sc. Ph.D
Profesor Asistente – Escuela de Química
Universidad Industrial de Santander
Facultad de Ciencias
Escuela de Química
Biología Celular (24720)
13. Calcule la concentración del ión formiato (HCOO-) y el pH de una solución que es 0.05M
respecto al ácido fórmico, HCOOH (Ka=1.8x10-4), y 0.1M respecto al ácido nítrico (HNO3.
Recuerde ácido nítrico es un ácido fuerte) (Respuesta: [HCOO-]=9X10-5M, pH=1.0)
14. Calcule el pH de un amortiguador compuesto de ácido benzoico 0.12M y benzoato de sodio
0.2M. (Rta: pH =4.41)
15. Cuántos moles de NH4Cl es necesario agregar a 2.0 Litros de NH3 0.1M para formar una
solución amortiguadora cuyo pH sea 9.0 (Kb= 1.8x10-5).
16. Calcule la concentración de benzoato de sodio que debe estar presente en una solución 0.20M
de ácido benzoico, HC7H5O2, para producir un pHde 4.0 (Respuesta: 0.13M)
17. Explique porqué una mezcla de HCl y KCl no funciona como amortiguador, en tanto que una
mezcla de HC2H3O2 y NaC2H3O2 sí lo hace.
18. Se prepara una solución amortiguadora adicionando 20 gramos de ácido acético y 20 gramos de
acetato de sodio, en agua suficiente para formar 2 litros de solución.
a. Determine el pH de la solución amortiguadora
b. Escriba la ecuación iónica completa de la reacción que se lleva a cabo cuando se adicionan
unas cuantas gotas de ácido clorhídrico a la solución amortiguadora
c. Escriba la ecuación iónica completa de la reacción que se lleva a cabo cuando se adicionan
unas cuantas gotas de solución de hidróxido de sodio a la solución amortiguadora.
19. Una solución amortiguadora contiene 0.11 mol de ácido acético y 0.15 mol de acetato de sodio
en 1 litro.
a. ¿Cuál es el pH de esta solución amortiguadora? (Respuesta: pH=4.88)
b. ¿Cuál es el pH de la solución amortiguadora después de la adición de 0.02 mol de KOH?
c. ¿Cuál es el pH de la solución amortiguadora después de la adición de 0.02 mol de HCl?
(Respuestas: a) pH=4.88; b) pH=5.0; c) pH=4.74)
20. ¿Cuál será el pH y el porcentaje de ionización de una solución 0.20 M de amoniaco, NH 3 (ac)?
El valor de Kb para el amoniaco es 1.8x10-5 (Rta. pH=11.28; % ionización=0.95%)
21. Calcule el pH de una solución que contiene 7.80 g de CH3NH2 en 0.50 L de solución
(Kb=5.0x10-4)
22. ¿Cuántos gramos de amoniaco se requieren para preparar 3.0 L de solución de pH= 10.0?
William Hidalgo Bucheli, M.Sc. Ph.D
Profesor Asistente – Escuela de Química
Universidad Industrial de Santander
Facultad de Ciencias
Escuela de Química
Biología Celular (24720)
23. ¿Cuál será el pH de una solución 0.10 M de formiato de sodio, HCOONa? El valor de la
constante de ionización del ácido fórmico, HCOOH, es 1.8x10-4.
24. Calcule el pH de una solución 0.25 M de nitrito de sodio, NaNO2. El valor de la constante de
ionización de ácido nitroso, HNO2, es 4.5x10-4.
25. Calcule el pH de una solución 0.10 M de amoniaco acuoso y 0.10 M de cloruro de amonio,
NH4Cl (ac). El valor de Kb para el amoniaco es 1.8x10-5.
26. Calcule el pH de una solución 0.10 M de ácido fórmico, HCOOH (ac), y 0.10 M de formiato de
sodio, HCOONa (ac).
27. Calcule el pH de la solución que resulta después de adicional 100 mL de solución 0.10 M de
NaOH (ac) a 1.0 L de la solución preparada en el numeral 26.
28. Calcule el pH de la solución que resulta después de adicionar 100 mL de solución 0.10 M de
HCl (ac) a 1.0 L de la solución preparada en el numeral 26.
William Hidalgo Bucheli, M.Sc. Ph.D
Profesor Asistente – Escuela de Química
Você também pode gostar
- Serie Ácidobase Versión RevDocumento3 páginasSerie Ácidobase Versión Reveduardo3000Ainda não há avaliações
- Informe Práctica #1 Qa IDocumento10 páginasInforme Práctica #1 Qa IAldair Orozco UlloaAinda não há avaliações
- Examen LabDocumento2 páginasExamen LabMónica VargasAinda não há avaliações
- Volumetría de Oxido - Reducción IDocumento10 páginasVolumetría de Oxido - Reducción IingrossAinda não há avaliações
- Guia Ejercicios 1 AB 531324 1S 2019 Con Resolucion de Algunos EjDocumento15 páginasGuia Ejercicios 1 AB 531324 1S 2019 Con Resolucion de Algunos EjKristofer BonillaAinda não há avaliações
- Taller 1 - Soluciones Amortiguadoras. BioQm TeoriaDocumento9 páginasTaller 1 - Soluciones Amortiguadoras. BioQm TeoriaBrandon CaballeroAinda não há avaliações
- PrecipitaciónDocumento1 páginaPrecipitaciónIsa MarAinda não há avaliações
- Teorema de BayesDocumento4 páginasTeorema de BayesJuan SdAinda não há avaliações
- Tema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Documento17 páginasTema 6, Tema 7 Alquinos SN1 y SN2 20 Mayo 2020Alan YañezAinda não há avaliações
- Concentración de Cu2Documento2 páginasConcentración de Cu2sarahi guillenAinda não há avaliações
- Titulación de Ácidos PolipróticosDocumento14 páginasTitulación de Ácidos PolipróticosRIVERA LOZANO ENRIQUE ULISESAinda não há avaliações
- Taller 6 EquilibrioDocumento3 páginasTaller 6 Equilibrioliz100% (1)
- Serie 5 SqiDocumento4 páginasSerie 5 SqiEduardo ValenzuelaAinda não há avaliações
- Lab NDocumento23 páginasLab Nanon_18033708Ainda não há avaliações
- NUEVO....... Serie2 Respuestas 2mayo2012 19946Documento4 páginasNUEVO....... Serie2 Respuestas 2mayo2012 19946laura valentinaAinda não há avaliações
- Informe Coeficiente de Reparto RealDocumento20 páginasInforme Coeficiente de Reparto RealDaniel MoralesAinda não há avaliações
- Informe 8 - Disoluciones Amortiguadoras de PHDocumento14 páginasInforme 8 - Disoluciones Amortiguadoras de PHJessica Fernanda Coaricona OrtegaAinda não há avaliações
- 4.3 Disociación de Especies Débiles y Cálculo de PHDocumento24 páginas4.3 Disociación de Especies Débiles y Cálculo de PHNaolin TorresAinda não há avaliações
- 2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFDocumento4 páginas2p Cinetica de Oxidacion de La Vitamina C Con Ferricianuro de Potasio PDFRuben FelipeAinda não há avaliações
- Tarea 7 - Revisión Del IntentoDocumento11 páginasTarea 7 - Revisión Del Intentokagura gintokiAinda não há avaliações
- Práctica 6. Predicciòn de La Espontaniedad de Las Reacciones RedoxDocumento3 páginasPráctica 6. Predicciòn de La Espontaniedad de Las Reacciones RedoxIrving GarciaAinda não há avaliações
- Taller de Enlaces Químicos Geometría Resonancia PolaridadDocumento2 páginasTaller de Enlaces Químicos Geometría Resonancia PolaridadLili OliverosAinda não há avaliações
- Pruebas Bioquímicas, Practica 12Documento6 páginasPruebas Bioquímicas, Practica 12Aaron De JesusAinda não há avaliações
- Práctica 3 Laboratorio de Equilibrio y CineticaDocumento4 páginasPráctica 3 Laboratorio de Equilibrio y CineticaDany PandaAinda não há avaliações
- Practica 3 Cromo ViDocumento12 páginasPractica 3 Cromo ViFranco Pretto GarciaAinda não há avaliações
- Equilibrio en Sistemas Homogeneos PDFDocumento22 páginasEquilibrio en Sistemas Homogeneos PDFAngélica MontalvoAinda não há avaliações
- Determinación de La Constante de EquilibrioDocumento2 páginasDeterminación de La Constante de EquilibrioChiran Alexis0% (1)
- Práctica 6. Identificación de Grupos Funcionales (Alcoholes, Dobles Enlaces, Aminas, Aldehídos, Cetonas Ácidos Carboxílicos)Documento31 páginasPráctica 6. Identificación de Grupos Funcionales (Alcoholes, Dobles Enlaces, Aminas, Aldehídos, Cetonas Ácidos Carboxílicos)yukyAinda não há avaliações
- Analisis Elemental Cualitativo Omarambi 2011Documento15 páginasAnalisis Elemental Cualitativo Omarambi 2011Oscar G. Marambio100% (1)
- TitulaciónDocumento7 páginasTitulaciónOscar ArdilaAinda não há avaliações
- Reacciones de Condensación Del Grupo CarboniloDocumento3 páginasReacciones de Condensación Del Grupo CarboniloGeraldine Bobadilla PastorAinda não há avaliações
- Determinacion de Una Constante de Equilibrio Lab PracticeDocumento7 páginasDeterminacion de Una Constante de Equilibrio Lab PracticeEugenia GuilliodAinda não há avaliações
- Manual Met Cuanti P1 y P2Documento36 páginasManual Met Cuanti P1 y P2Esteban RicoAinda não há avaliações
- Informe Laboratorio 2 ConductimetríaDocumento16 páginasInforme Laboratorio 2 ConductimetríaClaudio DíazAinda não há avaliações
- Diseño Experimental Acido Base 2Documento5 páginasDiseño Experimental Acido Base 2Emilio SecruAinda não há avaliações
- Uso Del Multimetro01Documento11 páginasUso Del Multimetro01Gaby Cortés 7u7Ainda não há avaliações
- Van AdioDocumento4 páginasVan AdioLinda CastroAinda não há avaliações
- Problemas Volumetrías Ácido-BaseDocumento6 páginasProblemas Volumetrías Ácido-BasepepeAinda não há avaliações
- 531.243 Sesion 10Documento7 páginas531.243 Sesion 10Felipe CidAinda não há avaliações
- Ejercicios AnaliticaDocumento2 páginasEjercicios AnaliticaAle SalazarAinda não há avaliações
- Practica 4 Cinetica Enzimatica de La Fosfatasa Alcalina.-.Documento9 páginasPractica 4 Cinetica Enzimatica de La Fosfatasa Alcalina.-.Leion UchihaAinda não há avaliações
- INFORME-Solucion de Tiosulfato de SodioDocumento8 páginasINFORME-Solucion de Tiosulfato de SodioJosé MolinaAinda não há avaliações
- Calor de CombustiónDocumento13 páginasCalor de CombustiónSaul HernándezAinda não há avaliações
- Informe Practica 2Documento6 páginasInforme Practica 2Abi CorreaAinda não há avaliações
- Estandarizacion D Kmno4Documento3 páginasEstandarizacion D Kmno4Willy MelgarejoRmroAinda não há avaliações
- Informe Inorganica II Prectica Complejos Octaedricos CorregidoDocumento9 páginasInforme Inorganica II Prectica Complejos Octaedricos Corregidozaira aguirre100% (1)
- Práctica Conductimetría PDFDocumento2 páginasPráctica Conductimetría PDFWendy Núñez BedollaAinda não há avaliações
- Informe 13N ConductividadDocumento17 páginasInforme 13N ConductividadNICK MARALLANOAinda não há avaliações
- Informe Practica 10Documento7 páginasInforme Practica 10Roberto SánchezAinda não há avaliações
- Lab NeutralizacionDocumento19 páginasLab Neutralizacionapi-3802357100% (7)
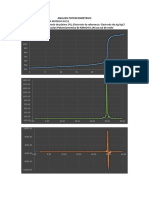
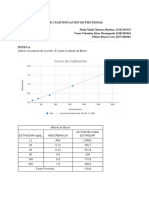
- Cuantificacion de Proteinas PDFDocumento6 páginasCuantificacion de Proteinas PDFNataly JimenezAinda não há avaliações
- Práctica Ionicos y CovalentesDocumento4 páginasPráctica Ionicos y CovalentesOscar UrielAinda não há avaliações
- Práctica 10 Laboratorio de Química Orgánica 1Documento3 páginasPráctica 10 Laboratorio de Química Orgánica 1CarlosArturoCruzCervantesAinda não há avaliações
- Informe Valoracion Potenciometrica Acido-BaseDocumento16 páginasInforme Valoracion Potenciometrica Acido-BasePaola Valverde100% (1)
- Antecedentes Alcoholes PrimariosDocumento5 páginasAntecedentes Alcoholes PrimariosHumberto Flores LealAinda não há avaliações
- Aq 12 2019-Ii UnmsmDocumento22 páginasAq 12 2019-Ii UnmsmmeryAinda não há avaliações
- Practica 2 Fuerzas IntermolecularesDocumento9 páginasPractica 2 Fuerzas IntermolecularesF.Melisa Rulfo BeltránAinda não há avaliações
- TALLER PH y Amortiguadores 2020-2Documento10 páginasTALLER PH y Amortiguadores 2020-2VANESSA LEONOR PRIETOAinda não há avaliações
- TALLER PH y Amortiguadores PDFDocumento4 páginasTALLER PH y Amortiguadores PDFPedro Pablo Perez GonsalezAinda não há avaliações
- Taller # 1 - QA - UdeA - 02-2019Documento7 páginasTaller # 1 - QA - UdeA - 02-2019CATALINA BUITRAGO OROZCOAinda não há avaliações
- Entomopathogenic Fungi For TickDocumento18 páginasEntomopathogenic Fungi For TickMARIO JULIAN DELGADO GELVESAinda não há avaliações
- 3er Papaer - Tick Impact Cattle13Documento17 páginas3er Papaer - Tick Impact Cattle13MARIO JULIAN DELGADO GELVESAinda não há avaliações
- Guía 3. Tejido Conectivo EspecializadoDocumento5 páginasGuía 3. Tejido Conectivo EspecializadoMARIO JULIAN DELGADO GELVESAinda não há avaliações
- 5to - Amitraz Poisong1Documento9 páginas5to - Amitraz Poisong1MARIO JULIAN DELGADO GELVESAinda não há avaliações
- Taller #1Documento2 páginasTaller #1MARIO JULIAN DELGADO GELVESAinda não há avaliações
- Taller No. 1 Principales Normas Ambientales en ColombiaDocumento15 páginasTaller No. 1 Principales Normas Ambientales en ColombiaMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Normativa Sobre SueloDocumento2 páginasNormativa Sobre SueloMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Matriz EIA - Microcuenca Aguas Calientes FinalDocumento10 páginasMatriz EIA - Microcuenca Aguas Calientes FinalMARIO JULIAN DELGADO GELVESAinda não há avaliações
- GFPI-F-019 - GUIA - DE - APRENDIZAJE ResiduosDocumento13 páginasGFPI-F-019 - GUIA - DE - APRENDIZAJE ResiduosMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Lista de Chequeo Enc. y EntrevistaDocumento4 páginasLista de Chequeo Enc. y EntrevistaMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Desarrollo Guía de Aprendizaje Ecosistemas de ColombiaDocumento49 páginasDesarrollo Guía de Aprendizaje Ecosistemas de ColombiaMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Phyllobates TerribilisDocumento2 páginasPhyllobates TerribilisMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Desarrollo Taller Semana 2Documento3 páginasDesarrollo Taller Semana 2MARIO JULIAN DELGADO GELVES100% (1)
- Phyllobates TerribilisDocumento3 páginasPhyllobates TerribilisMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Tipos de ComunicaciónDocumento18 páginasTipos de ComunicaciónMARIO JULIAN DELGADO GELVESAinda não há avaliações
- Fisica Parcial UtnDocumento7 páginasFisica Parcial UtnMalu MaciAinda não há avaliações
- Clima DesbocadoDocumento5 páginasClima DesbocadoLuis Enrique FigueroaAinda não há avaliações
- Tarea 3 - Presentar Evaluación Ecuaciones Diferenciales de Primer Orden y Orden Superior 3Documento10 páginasTarea 3 - Presentar Evaluación Ecuaciones Diferenciales de Primer Orden y Orden Superior 3Ledherzon ContrerasAinda não há avaliações
- Captulo 8 - Envejecimiento y Control PosturalDocumento13 páginasCaptulo 8 - Envejecimiento y Control PosturalXime González0% (1)
- Lógica, Conjuntos, Funciones y RelacionesDocumento99 páginasLógica, Conjuntos, Funciones y RelacionesAxpaal YatazAinda não há avaliações
- Huellas de Calzado FBIDocumento17 páginasHuellas de Calzado FBIEmmanuel LadoAinda não há avaliações
- Cálculo InfinitesimalDocumento9 páginasCálculo InfinitesimalIVANCI123Ainda não há avaliações
- ApuDocumento33 páginasApuSergio Ramirez0% (1)
- Licenciatura PDFDocumento7 páginasLicenciatura PDFYamil VelázquezAinda não há avaliações
- Puesta en Estación y Calado Del Teodolito (B)Documento6 páginasPuesta en Estación y Calado Del Teodolito (B)Diego AlvarezAinda não há avaliações
- Diseño y Construcción de Circuitos ImpresosDocumento15 páginasDiseño y Construcción de Circuitos Impresosninoghg100% (2)
- Taller 1 Ecuaciones Diferenciales - Willian Alexander Vélez Moreno - 084900112020Documento3 páginasTaller 1 Ecuaciones Diferenciales - Willian Alexander Vélez Moreno - 084900112020willianAinda não há avaliações
- Cambios en El Ekg en El IamDocumento17 páginasCambios en El Ekg en El IamHector Alejo CervantesAinda não há avaliações
- Movimiento en Una DimensiónDocumento2 páginasMovimiento en Una DimensiónRebecca Lucas100% (1)
- Circuitos AdministrativosDocumento6 páginasCircuitos AdministrativosVerittoEikonAinda não há avaliações
- Plan de Asignatura Fisicoquimica.Documento8 páginasPlan de Asignatura Fisicoquimica.Jose OlivellaAinda não há avaliações
- Propiedades Químicas y Su VariaciónDocumento4 páginasPropiedades Químicas y Su VariaciónNora MatherAinda não há avaliações
- Manual MT Nivel I y IIDocumento169 páginasManual MT Nivel I y IIRodolfo GarciaAinda não há avaliações
- Nivel Basico Ing. NavaDocumento97 páginasNivel Basico Ing. NavaMaria ReyesAinda não há avaliações
- Laboratorio Cba N°6Documento7 páginasLaboratorio Cba N°6sinexAinda não há avaliações
- 152 Ezine 152 PDFDocumento385 páginas152 Ezine 152 PDFAlfredo Juillet FrascaraAinda não há avaliações
- Guía Plano CartesianoDocumento7 páginasGuía Plano CartesianoAna Gicela Betancurt LloveraAinda não há avaliações
- Memoria de Cálculo de Electrodos A Utilizar Unión Por Soldadura en Estructura (Entre Mares)Documento12 páginasMemoria de Cálculo de Electrodos A Utilizar Unión Por Soldadura en Estructura (Entre Mares)Franck Salazar MontesAinda não há avaliações
- Termodinamica 7Documento11 páginasTermodinamica 7Matías De León Jimenez100% (1)
- Criminalistica Basica Conocimiento GeneralDocumento43 páginasCriminalistica Basica Conocimiento GeneralmenssesAinda não há avaliações
- Primer Examen GN 2017-Ivan Pino FigueroaDocumento23 páginasPrimer Examen GN 2017-Ivan Pino FigueroaIvan Pino FigueroaAinda não há avaliações
- Normas IEC y NEMADocumento21 páginasNormas IEC y NEMADaniel100% (1)
- Medidores de Nivel de LíquidosDocumento6 páginasMedidores de Nivel de LíquidosElian Andres Diaz VargasAinda não há avaliações