Escolar Documentos
Profissional Documentos
Cultura Documentos
Informee 5
Enviado por
luis arces sanchezTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Informee 5
Enviado por
luis arces sanchezDireitos autorais:
Formatos disponíveis
Cuestionario N°5
1. En las determinaciones cuantitativas con permanganato ¿Qué otros cationes se pueden
determinar?. Indique con reacciones químicas.
Los permanganatos son las sales del ácido permangánico o permanganésico, de fórmula HMnO
Las valoraciones redox están basadas en la transferencia cuantitativa de electrones entre un electrolito
valorante y la sustancia problema .El método de permanganometría (también conocido como
permanganimetría o permanganatometría)se basa en las reacciones de oxidación de reductores por
elión permanganato .La oxidación puede efectuarse tanto en medio ácido como en alcalino(o
neutro).Las permanganimetrías son valoraciones o volumetrías de oxidación-reducción, es decir, en
las que la reacción principal es una reacción en la que una sustancia se oxida y otra se reduce. Las
permanganimetrías tienen todas en común que el agente oxidante es el permanganato potásico:
KMnO4.Las Permanganimetrías son valoraciones de agentes que pueden oxidarse con permanganato.
Se emplean en valoración de agua oxigenada, nitritos, materia orgánica, La reacción de reducción del
permanganato es:
(MnO4)-+ 8H++ 5e- --->Mn2++ 4H2O
Si la disolución no es suficientemente ácida (pH>4), neutra o débilmente alcalina la reacción que tiene
lugar es:
(MnO4)+2H2O+3e- ---> MnO2(s) + 4OH-
El permanganato es un oxidante muy potente, de un color muy intenso. Esta última propiedad hace
que sea posible utilizarlo como auto indicador. El punto final de la valoración se detecta por una
aparición de un tono rosáceo en las disoluciones. Cuando no se puede utilizar el propio permanganato
como indicador (por utilizarse muy diluido) se utiliza el ácido difenilaminoso sulfónico el complejo
ortofenantrolina de hierro (II). El principal problema es la tendencia a oxidar el ioncloruro así como la
inestabilidad de la disolución. Para preparar una disolución aproximadamente 0,1N de permanganato
se siguen las siguientes instrucciones: Se disuelven unos 3,2g de permanganato potásico en
aproximadamente 1 litro de agua destilada. Se hierve ligeramente y se mantiene a
esa temperatura durante 1 hora. Se elimina el MnO2
Formado por filtración a vacío. La disolución se guarda en un frasco limpio y en la oscuridad .El KMnO4
no es patrón primario pues, aunque puede obtenerse puro sus disoluciones se descomponen en
protones parcialmente dando MnO2 y debe ser valorado frente a un patrón primario como Na2C2O4.
Las permanganimetrías se pueden utilizar para valorar gran cantidad de sustancias. Dos ejemplos
básicos son: determinación del hierro en un mineral: el fundamento es disolver
la muestra de minerales hierro, hacer reaccionar el hierro para garantizar que el estado de oxidación
es (II) y valorar el hierro con el permanganato. Otro ejemplo es la determinación de calcio en una piedra
caliza: el fundamento consiste en precipitar el calcio del mineral disuelto con ácido oxálico, filtrarlo y
disolverlo con ácido sulfúrico diluido. La valoración se realiza sobre el ácido oxálico liberado .En estas
valoraciones no es necesario utilizar un indicador para detectar el punto final ya que el mismo KMnO4
actúa como tal pues en la forma oxidada es de color violeta rojizo e incoloro en la reducida.
Reacciones
El anión permanganato tiene un potencial normal de electrodo muy alto, lo que lo convierte en un
oxidante muy fuerte capaz de oxidar al agua a oxígeno
2 MnO-4 + 2 H+ ? 2 O2 + H2 + 2 MnO2
Sin embargo, esta reacción es muy lenta, sobre todo en ausencia de luz y en medios neutros y
alcalinos, lo que hace que esta sustancia sea cinéticamente estable en disolución acuosa. En disolución
ácida, aunque lenta, la reducción del permanganto por el agua es observable.
Esta reacción también se puede ver activada aumentando la temperatura. Así, calentando
permanganato en disolución alcalina se libera oxígeno elemental y se forma el anión
manganato, MnO2-4, de color verde:
4 MnO-4 + 4 OH- ? 4 MnO2-4 + O2 + 2 H2O
En contacto con sustancias orgánicas provoca incendios. Así una gota de glicerina aplicada a un cono
de 2-3 g de permanganato de potasio en polvo lleva rápidamente primero a la generación de humo y
luego a una llama violácea por la presencia del potasio.
En disolución ácida su reducción suele llegar hasta el manganeso (2+), un catión casi incoloro o rosa
muy pálido en disoluciones concentradas. La reacción es acelerada por la presencia de cationes
manganeso (II) (reacción autocatalítica) y aprovechada en la permanganometría.
En disolución neutra o ligeramente básica la reducción sólo lleva hasta el óxido de manganeso
(IV), MnO2, que precipita como un sólido marrón.
En disoluciones fuertemente alcalinas, el MnO-4 se reduce hasta manganeso (VI) en forma de anión
manganato, de color verde
2 MnO-4 + H2O2 + 2 OH-? 2 MnO2-4 + O2 + 2 H2O
Sin embargo, con un exceso de una sustancia de gran poder reductor, incluso en medios fuertemente
básicos se consigue la reducción hasta Mn (IV):
2 MnO-4 + 3 SO2-3 + H2O ? 2 MnO2 + SO2-4 + 2 OH-
El anión manganato, estable en disolución altamente alcalina, cuando se acidifica la disolución para
dar manganeso en estados de oxidación (VII) y (IV)
3 MnO-4 + 4 H+ ? 2 MnO-4 + MnO2 + 2 H2O
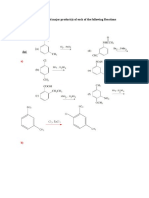
2. Diga si es posible aplicar este método para la determinación del plomo. Explique
Si utilizando los mismos procedimientos anteriores
3. Escriba la reacción ionica de la valorización que se efectuó
4. ¿Qué ocurriría con la no separación del hierro en la solución que contiene la muestra?
SE BUELVE A FILTAR
5. ¿Cuál es la normalidad redox de la solución de permanganato que se utilizo en el
experimento?
0.1N
6. ¿Por qué es necesario mantener la solución caliente durante la titulación en la
determinación permangenométrica del calcio?
Para tener resultados más aproximados
7. En presente práctica, ¿con que tipo de indicador se determino el punto final de la
valorización?. Explique
La fenolftaleína es un compuesto orgánico, descubierto en 1871 por Adolf Von
Baeyer y utilizado como indicador del pH. Es incoloro en medio ácido y tiene un
tono rosado en medio básic. Quimicamente la fenolftaleína proviene de la
condensación de una molécula de anhidrído ftálico y de dos moléculas de fenol
8. ¿en que consiste la determinación de Mn por el método de volhard?
• Método de Volhard:
Iones de plata se titulan con una solución patrón de tiocianato.Ag
+SCN-AgSCN
(s)
El indicador es el Fe (III) que se vuelve roja con un ligero exceso de SCN
.La titulación se debe realizar en un medio ácido para evitar que el Fe precipite.
• Método de Mohr:
Se utiliza en determinaciones argentométricas (con Ag+) de iones Cl,Br
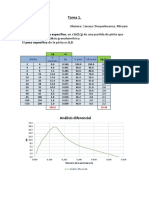
9. Muestre mediante una gráfica general la curva de valorización de la presente práctica, asi
sus parámetros de ploteo.
Você também pode gostar
- Obtencion de Amoniaco Por KWDocumento9 páginasObtencion de Amoniaco Por KWMoises AlarconAinda não há avaliações
- Informe Del Manjar BlancoDocumento9 páginasInforme Del Manjar BlancoMarco Chuhui RojasAinda não há avaliações
- Corrosion MetalicaDocumento3 páginasCorrosion MetalicaAnonymous Q74k7AGAinda não há avaliações
- Ciclorankineagua MercurioDocumento11 páginasCiclorankineagua MercurioJuliana HeronAinda não há avaliações
- Metodos Con PermanganatoDocumento18 páginasMetodos Con PermanganatoKatyAinda não há avaliações
- Trans de MasaDocumento13 páginasTrans de Masajuan carlosAinda não há avaliações
- Clase 9 Fabricación de AmoniacoDocumento20 páginasClase 9 Fabricación de AmoniacoFernando Renzo Alzamora CastilloAinda não há avaliações
- P04-Obtención de YodoformoDocumento5 páginasP04-Obtención de Yodoformoeliogp96Ainda não há avaliações
- P. Lab. 03 - Determinación de GammaDocumento11 páginasP. Lab. 03 - Determinación de GammaLUIS ALBERTO PEREZ GARCIA100% (1)
- Balance de Materia y Energía de Un Quemador.Documento5 páginasBalance de Materia y Energía de Un Quemador.Grecia MontejoAinda não há avaliações
- PERVAPORACIONDocumento27 páginasPERVAPORACIONLuis100% (1)
- La Síntesis Del AmoniacoDocumento3 páginasLa Síntesis Del AmoniacojoseahilarrazamAinda não há avaliações
- Sintesis HBRDocumento5 páginasSintesis HBRKaren Inostroza VásquezAinda não há avaliações
- Tarea EquilibrioDocumento5 páginasTarea Equilibriofrancisco ruizAinda não há avaliações
- Dependencia de La Fuerza Electromotriz Con La Temperatura Fico II XDDocumento13 páginasDependencia de La Fuerza Electromotriz Con La Temperatura Fico II XDChristian Cesar Alcantara JuarezAinda não há avaliações
- Control SO2Documento5 páginasControl SO2Rakuen 23Ainda não há avaliações
- Calcio VolumetricoDocumento12 páginasCalcio VolumetricoLuis CamargoAinda não há avaliações
- Ejemplo 16. de FoustDocumento3 páginasEjemplo 16. de FoustGustavo MayenAinda não há avaliações
- Exámen de III Unidad P.U.M - Sanchez Alfaro NestorDocumento10 páginasExámen de III Unidad P.U.M - Sanchez Alfaro NestorNestor SanchezAinda não há avaliações
- Borrador Informe TCTBADocumento13 páginasBorrador Informe TCTBAAlejandro MartinezAinda não há avaliações
- Practica Calificada - Martinez Garcia LuceroDocumento14 páginasPractica Calificada - Martinez Garcia LuceroclarivethAinda não há avaliações
- Labo de Fico 2 Valoraciones ConductometricasDocumento15 páginasLabo de Fico 2 Valoraciones ConductometricasJoseAinda não há avaliações
- IQ 09 01 - Clase2021-12-01Documento51 páginasIQ 09 01 - Clase2021-12-01Adolfo LazoAinda não há avaliações
- Practica 6 MetodosDocumento4 páginasPractica 6 MetodosEfrain CuellarAinda não há avaliações
- BalanceDocumento4 páginasBalanceandres9410Ainda não há avaliações
- Industria de La SalDocumento7 páginasIndustria de La SalAnderson Rodriguez Torres100% (1)
- Bases de La Ingenieria Quimica 015Documento3 páginasBases de La Ingenieria Quimica 015AliciaAinda não há avaliações
- Ejercicios Propuestos de Efecto MultiplesDocumento1 páginaEjercicios Propuestos de Efecto MultiplesRafael RamirezAinda não há avaliações
- Laboratorio - Destilación de Dos Líquidos InmisciblesDocumento4 páginasLaboratorio - Destilación de Dos Líquidos InmisciblesIvan TillaAinda não há avaliações
- Info Organica-INTERACCIONES MOLECULARESDocumento4 páginasInfo Organica-INTERACCIONES MOLECULARESFabian SigchaAinda não há avaliações
- PRACTICA No.7 QaDocumento7 páginasPRACTICA No.7 QaCRISTIAN MACIASAinda não há avaliações
- Practica Aniones 4Documento7 páginasPractica Aniones 4Grecia Hernandez ReyesAinda não há avaliações
- PRÁCTICA 2. Determinación de Cloro Activo en Una Muestra de BlanqueadorDocumento4 páginasPRÁCTICA 2. Determinación de Cloro Activo en Una Muestra de BlanqueadorYessyMedinaAinda não há avaliações
- Preparacion de Una Solucion Estandar y Determinacion de Vitamina C en Tabletas ComercialesDocumento2 páginasPreparacion de Una Solucion Estandar y Determinacion de Vitamina C en Tabletas ComercialesDennis ShawAinda não há avaliações
- Preguntas Examen Proyectos IndustrialesDocumento3 páginasPreguntas Examen Proyectos IndustrialeszuridaiAinda não há avaliações
- Bomba CalorimetricaDocumento8 páginasBomba CalorimetricaJOSE ERAZO100% (2)
- Practica 3Documento3 páginasPractica 3Alexandra MolinaAinda não há avaliações
- Tarea Flujo Estable1Documento3 páginasTarea Flujo Estable1Jeffry Eduardo ZaldivarAinda não há avaliações
- Cinetica Quimica FinalDocumento28 páginasCinetica Quimica Finallaura lucia cereso mmaniAinda não há avaliações
- Informe Exp2 Sintesis Medina-SolisDocumento5 páginasInforme Exp2 Sintesis Medina-SolisSimón MedinaAinda não há avaliações
- PRACTICA N.1docx PDFDocumento3 páginasPRACTICA N.1docx PDFBeymar ContrerasAinda não há avaliações
- Ejercicio-2 BDM y BdEDocumento3 páginasEjercicio-2 BDM y BdEalba sarabiaAinda não há avaliações
- Problem As Org ADocumento29 páginasProblem As Org AMoises Aguirre MuñozAinda não há avaliações
- Problemas T15 - 14-01-2019Documento6 páginasProblemas T15 - 14-01-2019Miguel Garcia0% (1)
- DFP Acido SulfuricoDocumento24 páginasDFP Acido SulfuricoKimberly AndradeAinda não há avaliações
- Tarea 1Documento2 páginasTarea 1meryAinda não há avaliações
- Baz RucoDocumento12 páginasBaz RucoE Leonel Leonel Gonzales BarrionuevoAinda não há avaliações
- Ejemplo de Practica 1Documento12 páginasEjemplo de Practica 1Ximena GonzálezAinda não há avaliações
- Actividad 4Documento2 páginasActividad 4Candela Denise BaccoAinda não há avaliações
- Torre de EnfriamientoDocumento7 páginasTorre de EnfriamientoEduardo LeijaAinda não há avaliações
- Uso de Los Microorganismos en La Minería y Biorremediación PDFDocumento29 páginasUso de Los Microorganismos en La Minería y Biorremediación PDFDani SantoyoAinda não há avaliações
- EtanolDocumento15 páginasEtanolReyna NolascoAinda não há avaliações
- Informe Laboratorio 5 de Transferencia de Calor Convectivo ForzadoDocumento76 páginasInforme Laboratorio 5 de Transferencia de Calor Convectivo ForzadoNapolyAinda não há avaliações
- TEF Primer Examen Parcial Parte BDocumento6 páginasTEF Primer Examen Parcial Parte BEstefanía Angel ClavijoAinda não há avaliações
- Vianny VillalobosDocumento8 páginasVianny Villalobosronni bermudezAinda não há avaliações
- Caracterización de SólidosDocumento8 páginasCaracterización de SólidosJesicaCarrascalAinda não há avaliações
- Absorcion No IsotermicaDocumento6 páginasAbsorcion No IsotermicaNatalia Moreno MorenoAinda não há avaliações
- Dimetil EterDocumento2 páginasDimetil EterLuis Siller AlmazanAinda não há avaliações
- Informe 9 Medina - MuzzioDocumento15 páginasInforme 9 Medina - MuzzioMarcelaDenisseMuzzio100% (1)
- Permanganometrias PDFDocumento4 páginasPermanganometrias PDFSantiago AndramuñoAinda não há avaliações
- Evaluación Diagnóstica 5° - Personal Social 2023 (2465)Documento12 páginasEvaluación Diagnóstica 5° - Personal Social 2023 (2465)luis arces sanchez100% (1)
- Evaluación Diagnóstica 3° - Matemática 2023 (2456)Documento13 páginasEvaluación Diagnóstica 3° - Matemática 2023 (2456)luis arces sanchezAinda não há avaliações
- Evaluación Diagnóstica 3° - Comunicación 2023 (2460)Documento18 páginasEvaluación Diagnóstica 3° - Comunicación 2023 (2460)luis arces sanchezAinda não há avaliações
- Destilador de Aceites Esenciales CaseroDocumento5 páginasDestilador de Aceites Esenciales Caseroluis arces sanchezAinda não há avaliações
- Laboratorio de Quimica n01 II ADocumento31 páginasLaboratorio de Quimica n01 II Aluis arces sanchezAinda não há avaliações
- Informe de TCMDocumento36 páginasInforme de TCMluis arces sanchezAinda não há avaliações
- Enfoques Transversales para La Gestion de Convivencia EscolarDocumento2 páginasEnfoques Transversales para La Gestion de Convivencia Escolarluis arces sanchez100% (2)
- Modulos EstandaresDocumento31 páginasModulos EstandaresDayana MedinaAinda não há avaliações
- Clase 5. Sistemas de IniciaciónDocumento26 páginasClase 5. Sistemas de IniciacióncarlaleivaAinda não há avaliações
- Comparación Entre RUP y Métrica 3 V 3Documento6 páginasComparación Entre RUP y Métrica 3 V 3BVeronica RAAinda não há avaliações
- GUIA ULTRASONIDO (HAZ ANGULAR) .PpsDocumento34 páginasGUIA ULTRASONIDO (HAZ ANGULAR) .Ppswilivaldo2892% (26)
- Capítulo II Procesos de La Ingeniería de RequerimientosDocumento3 páginasCapítulo II Procesos de La Ingeniería de RequerimientosLuis Angel RAinda não há avaliações
- Máquinas Herramientas para Metales - N. N. Chernov - 1ra EdiciónDocumento228 páginasMáquinas Herramientas para Metales - N. N. Chernov - 1ra Edicióndiego100% (3)
- Rep. AFA Falla Rodamiento Lado Acople Del Motor de Bomba VogelDocumento2 páginasRep. AFA Falla Rodamiento Lado Acople Del Motor de Bomba VogelRafael Padilla YauricasaAinda não há avaliações
- Curricula de Estudios de Ingenieria metalúrgica-UNSAAC IIDocumento2 páginasCurricula de Estudios de Ingenieria metalúrgica-UNSAAC IIAldo Sabino Flores SapacayoAinda não há avaliações
- Proyecto de AutomatizacionDocumento7 páginasProyecto de AutomatizacionCristobal Nicolas Pelliza GonzalezAinda não há avaliações
- Saint ContableDocumento16 páginasSaint ContableBryanRamrzAinda não há avaliações
- Proyecto Integrador (Perdida de Producción)Documento20 páginasProyecto Integrador (Perdida de Producción)Mustang PanueraAinda não há avaliações
- Evolución de La MercadotecniaDocumento6 páginasEvolución de La MercadotecniaGaby Pérez OlveraAinda não há avaliações
- Mantenimiento de Tanques de Agua PotableDocumento2 páginasMantenimiento de Tanques de Agua PotableHumberto Fuchs HAinda não há avaliações
- PR-SST-14 - Procedimiento Trabajo en AlturaDocumento51 páginasPR-SST-14 - Procedimiento Trabajo en AlturaHector HBmix HbmAinda não há avaliações
- La Logística de Aprovisionamiento: Una Aproximación Al Estado Del ArteDocumento33 páginasLa Logística de Aprovisionamiento: Una Aproximación Al Estado Del ArteigomezeAinda não há avaliações
- Caso Refrescos @johanDocumento2 páginasCaso Refrescos @johanLeo de la CruzAinda não há avaliações
- Memoria I Foro Desarrollo de Software IngInfDocumento126 páginasMemoria I Foro Desarrollo de Software IngInfRubén Darío Rivera MejíaAinda não há avaliações
- Cuaderno de Informe 01 - Jhunior Arón Chilón LlicoDocumento13 páginasCuaderno de Informe 01 - Jhunior Arón Chilón LlicoJhunior LlicoAinda não há avaliações
- 08 - 0273 - CS Utilizacion de Tecnicas de Auditoria Asistidas Por ComputadorDocumento92 páginas08 - 0273 - CS Utilizacion de Tecnicas de Auditoria Asistidas Por Computadorsalmo83:18Ainda não há avaliações
- Bienes y ServiciosDocumento4 páginasBienes y ServiciosKATDLIN JULIETA RIOS CHAVEZAinda não há avaliações
- Kraftwerk 2021Documento180 páginasKraftwerk 2021David FalcónAinda não há avaliações
- Cuestionario de Reseña Historica de I.O.Documento3 páginasCuestionario de Reseña Historica de I.O.Duvan Rodriguez100% (1)
- U1 - Operaciones de EnsambleDocumento21 páginasU1 - Operaciones de EnsambleLEONARDO FABIO MADRID SANCHEZAinda não há avaliações
- Teoria Control InternoDocumento23 páginasTeoria Control InternoVELMOR14Ainda não há avaliações
- TDR-talabaya CORREGIDO CementerioDocumento36 páginasTDR-talabaya CORREGIDO CementerioLuis Fernandez100% (1)
- Guía Madera de Usos y Aplicaciones de La MaderaDocumento99 páginasGuía Madera de Usos y Aplicaciones de La MaderaSergio Enrique Melgar LazoAinda não há avaliações
- Procedimiento de RevestimientoDocumento3 páginasProcedimiento de RevestimientoLennyAinda não há avaliações
- TDR CocinaDocumento6 páginasTDR CocinaGerson Andre Morales Ramirez0% (1)
- NCH 933 y 934Documento20 páginasNCH 933 y 934Nicole P. SanchezAinda não há avaliações
- Turbomaquinas Trabajo OficialDocumento43 páginasTurbomaquinas Trabajo OficialFelix Hernández ZapataAinda não há avaliações