Escolar Documentos
Profissional Documentos
Cultura Documentos
Rliqua PDF
Enviado por
FelipeTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Rliqua PDF
Enviado por
FelipeDireitos autorais:
Formatos disponíveis
ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A 41
Nestor Cezar Heck - DEMET / UFRGS
13. LIQÜAÇÃO
13.1 INTRODUÇÃO
É a remoção seletiva de impurezas pela fusão de uma fase ‘impura’, de modo que o
líquido esteja em equilíbrio com uma fase sólida onde a concentração das impurezas seja
muito maior, sem a adição de um reagente, mas exclusivamente pela variação e ajuste da
temperatura do processo. Pelas características mencionadas, a liqüação se enquadra na classe
de métodos físicos de refino.
O metal ‘impuro’ deve apresentar propriedades adequadas, que se refletem em seu
diagrama de equilíbrio de fases. O caso mais favorável à liqüação se dá quando: (i) o
diagrama de equilíbrio mostra uma composição eutética de elevado grau de pureza, (ii) e o
líquido está em equilíbrio com um composto intermetálico contendo uma fração elevada do
elemento considerado ‘impureza’(Figura 13.1). Normalmente o ponto de fusão do metal de
valor é pequeno, muito menor do que o da impureza; note que o teor da impureza no metal é
maior do que aquela do eutético.
Durante a liqüação o metal a ser purificado é aquecido em um forno até uma
temperatura adequada (pouco acima daquela do eutético – normalmente próxima ao seu ponto
de fusão), mas somente a parte mais ‘pura’ da fase se liqüefaz. Ao escorrer para fora do forno,
com a ajuda de uma soleira inclinada, ela separa-se do restante da massa metálica.
Alternativamente, o metal ‘impuro’ no estado líquido pode ser resfriado até a temperatura
ideal, onde as ‘impurezas’ se solidificam; após o quê devem ser coletadas. A descrição do
‘verdadeiro’ processo de liqüação – que deu origem ao nome do processo – corresponde ao
primeiro caso. Exemplo dele é a eliminação do Fe no estanho e, do segundo caso, a
eliminação do Cu no chumbo.
Uma espécie de liqüação inversa ocorre quando a composição do metal a ser
purificado é tal que o teor da impureza é menor que o aquele do eutético (Figura 13.2). Nesse
caso, o metal é resfriado até uma temperatura adequada (pouco acima do eutético) e o metal
de valor se solidifica essencialmente ‘puro’, enquanto que a fase líquida restante vai
coletando as impurezas. O processo Pattison, hoje em desuso, para a extração da prata do
chumbo ‘bruto’ pode ser citado como um exemplo. O chumbo ‘impuro’, contendo 0,3% de
prata, ao ser resfriado lentamente se cristaliza com grau elevado de pureza, deixando uma liga
líquida com uma concentração crescente em prata até a composição final (eutética) de 2,5%
Ag. O fato da liga impura assumir um papel com relevância econômica é, nesta análise,
secundário.
Exemplos clássicos desse processo são a eliminação do Fe no Sn ‘bruto’ e do Cu no
Pb ‘bruto’.
A liqüação é feita, ou em ‘panelões’, ou em fornos com soleira inclinada.
13.2 CONSIDERAÇÕES TERMODINÂMICAS
A liqüação depende exclusivamente da presença de condições favoráveis de equilíbrio
termodinâmico, que são: (i) existência uma grande diferença nas composições das fases em
equilíbrio, determinadas pelas linhas ‘solidus’ e ‘liquidus’, (ii) concentração das impurezas na
fase (sólida ou líquida) ‘metal de valor’ muito baixa. Outras condições favoráveis como, por
exemplo, existência de uma diferença significativa na densidade das duas fases – para facilitar
a sua separação física – facilitam em muito o processo.
Essas características termodinâmicas importantes não são passíveis de serem
produzidas intencionalmente, mas podem ser previstas pela observação de diagramas de
equilíbrio de fases.
ENG06632-Metalurgia Extrativa dos Metais Não-Ferrosos II-A 42
Nestor Cezar Heck - DEMET / UFRGS
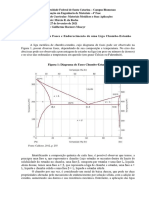
Fig. 13.1 Liquação do metal ‘impuro’ A pelo seu aquecimento até pouco
acima da temperatura do eutético; 1: concentração original; 2 teor da
impureza no metal purificado; 3: teor da impureza no material
descartado
Fig. 13.2 Liquação inversa do metal ‘impuro’ A pelo resfriamento até pouco
acima da temperatura do eutético; 1: concentração original; 2 teor da
impureza no metal purificado; 3: teor da impureza no material
descartado
Você também pode gostar
- Conversão de mates de cobre em dois estágiosDocumento23 páginasConversão de mates de cobre em dois estágiospaulohm_Ainda não há avaliações
- Fusao A MatteDocumento3 páginasFusao A MatteCaio César MeloAinda não há avaliações
- Decomposição térmica de metais não-ferrososDocumento2 páginasDecomposição térmica de metais não-ferrososNatália XavierAinda não há avaliações
- P1 Questionário PMFDocumento6 páginasP1 Questionário PMFKarolina NetoAinda não há avaliações
- Relatorio Experimento 10 & 11Documento4 páginasRelatorio Experimento 10 & 11lucas67% (3)
- Metalurgia dos AçosDocumento11 páginasMetalurgia dos AçosHugo Carvalho AmorimAinda não há avaliações
- Resumo de Tecnologia Dos MateriaisDocumento8 páginasResumo de Tecnologia Dos MateriaisldmoreiraAinda não há avaliações
- Trabalho de Ligas para Fundi - oDocumento48 páginasTrabalho de Ligas para Fundi - oCristina Gomes da SilvaAinda não há avaliações
- 9 Redução MetalotérmicaDocumento6 páginas9 Redução MetalotérmicaquelfisicaAinda não há avaliações
- Resumo de Metais Nao FerrososDocumento11 páginasResumo de Metais Nao FerrososAnedito ArmandoAinda não há avaliações
- Mecanismos básicos de corrosão: Cap 6 do Vicente GentilDocumento2 páginasMecanismos básicos de corrosão: Cap 6 do Vicente GentilbubysrderfAinda não há avaliações
- Relatório Metais AlcalinosDocumento9 páginasRelatório Metais AlcalinosGeovana Stafin100% (1)
- Resumo Analise Geral Dos MetaisDocumento6 páginasResumo Analise Geral Dos MetaisLuana VieiraAinda não há avaliações
- Metais AlcalinosDocumento8 páginasMetais AlcalinosLIVIA CORREIA MOUZINHOAinda não há avaliações
- Experimento 7. Oxidação e ReduçãoDocumento6 páginasExperimento 7. Oxidação e ReduçãoVanessaAinda não há avaliações
- Processo pirometalúrgico de cobreDocumento4 páginasProcesso pirometalúrgico de cobreBarbaraSricaAinda não há avaliações
- Determinação do Cobre em LatãoDocumento13 páginasDeterminação do Cobre em LatãoThyrone MartinsAinda não há avaliações
- Oxidação de depósitos de minériosDocumento11 páginasOxidação de depósitos de minériosAurélio FagundesAinda não há avaliações
- CaldeiraDocumento21 páginasCaldeirawalter moreiraAinda não há avaliações
- APOST - EletroquímicaDocumento9 páginasAPOST - EletroquímicaMelvin RainenAinda não há avaliações
- Processamento de Pós Metálicos e CerâmicosDocumento112 páginasProcessamento de Pós Metálicos e CerâmicosAlan SantosAinda não há avaliações
- Controle de Processo em Fundições de Ferro Fundido com Análise TérmicaDocumento71 páginasControle de Processo em Fundições de Ferro Fundido com Análise TérmicaCesar Alencar MendesAinda não há avaliações
- Lista de eletroquímica e corrosãoDocumento16 páginasLista de eletroquímica e corrosãoGracielly Mandelli0% (1)
- Prod Aço 2013Documento94 páginasProd Aço 2013Vanessa RamosAinda não há avaliações
- Quimica Pratica12Documento10 páginasQuimica Pratica12Ingrid WendlingAinda não há avaliações
- Trabalho - Qúimica - Tipos de Corrosão EletroquímicaDocumento17 páginasTrabalho - Qúimica - Tipos de Corrosão Eletroquímicamath13Ainda não há avaliações
- 03 - Alto Forno - Obtenção Do Ferro Gusa - Processo Siderúrgico - Aço - Processos de Fabricação - Aços & Ligas - InfometDocumento7 páginas03 - Alto Forno - Obtenção Do Ferro Gusa - Processo Siderúrgico - Aço - Processos de Fabricação - Aços & Ligas - InfometCristianeAinda não há avaliações
- 9.0 - Cap.09 DIAGRAMA DE FASES RES. 16.1.pptx (Salvo Automaticamente)Documento78 páginas9.0 - Cap.09 DIAGRAMA DE FASES RES. 16.1.pptx (Salvo Automaticamente)Carlos Eugenio Fortes TeixeiraAinda não há avaliações
- Materiais de Construção Mecânica: AçoDocumento5 páginasMateriais de Construção Mecânica: AçoArtur PinheiroAinda não há avaliações
- Aula 02 - Marcha AnalíticaDocumento41 páginasAula 02 - Marcha AnalíticaJ. Messias Britto0% (1)
- Estudo Da ArteDocumento4 páginasEstudo Da ArteMateus MariniAinda não há avaliações
- EletrogravimetriaDocumento7 páginasEletrogravimetriaericaAinda não há avaliações
- Obtenção do Ferro Gusa no Alto FornoDocumento7 páginasObtenção do Ferro Gusa no Alto FornoKatia Ruiz Antonio Do NascimentoAinda não há avaliações
- Relatório Quimica Organica II - Aromatizante ArtificialDocumento8 páginasRelatório Quimica Organica II - Aromatizante ArtificialMariele Correia LucrecioAinda não há avaliações
- Notas de AulaDocumento73 páginasNotas de AulaAloide MoreiraAinda não há avaliações
- Redução Carbotérmica de Oxido de CobreDocumento4 páginasRedução Carbotérmica de Oxido de CobreDiego Alfonso Godoy Perez100% (1)
- CorrosaoDocumento47 páginasCorrosaoIara DaherAinda não há avaliações
- PiroNF Aula 07 Processos de Refino 2015-01Documento24 páginasPiroNF Aula 07 Processos de Refino 2015-01Carlos CarvalhalAinda não há avaliações
- Diagrama de FasesDocumento20 páginasDiagrama de FasesDenilsonRobertoAinda não há avaliações
- Prevenção de Corrosão em CaldeirasDocumento21 páginasPrevenção de Corrosão em Caldeirasvital1607100% (1)
- ELETROQUÍMICADocumento6 páginasELETROQUÍMICAMichele_Olivei_7778Ainda não há avaliações
- Causas de deterioração de vasosDocumento73 páginasCausas de deterioração de vasosCleber AntônioAinda não há avaliações
- Produção de cobre metálico: extração e refinoDocumento3 páginasProdução de cobre metálico: extração e refinomarcelo.echterhoff8041Ainda não há avaliações
- Aços - Tratamentos TérmicosDocumento9 páginasAços - Tratamentos Térmicossergioeq2000Ainda não há avaliações
- Extração por solvente: processos e aplicações na metalurgia extrativaDocumento3 páginasExtração por solvente: processos e aplicações na metalurgia extrativaMarjara MaquinéAinda não há avaliações
- Transformação de Fases e Endurecimento da Liga Chumbo-EstanhoDocumento4 páginasTransformação de Fases e Endurecimento da Liga Chumbo-EstanhoSasquia sasuAinda não há avaliações
- Relatório METAIS ALCALINOSDocumento9 páginasRelatório METAIS ALCALINOSluana1203Ainda não há avaliações
- Diagramas TTT e TAC - Recozimento - TêmperaDocumento10 páginasDiagramas TTT e TAC - Recozimento - TêmperaJotaAinda não há avaliações
- Projeto de Sistema de Limpeza de Gases de Convertedor LD 100tDocumento17 páginasProjeto de Sistema de Limpeza de Gases de Convertedor LD 100tBrender VictorAinda não há avaliações
- Alumínio e Suas LigasDocumento15 páginasAlumínio e Suas LigasAirton SouzaAinda não há avaliações
- Refino de AçoDocumento31 páginasRefino de AçoArtur DinizAinda não há avaliações
- Corrosão em caldeirasDocumento15 páginasCorrosão em caldeirasRafaela DóreaAinda não há avaliações
- Volumetria de Precipitação - Métodos de Vollhard, Mohr e FajansDocumento12 páginasVolumetria de Precipitação - Métodos de Vollhard, Mohr e FajansEvandro Serafim Morais100% (1)
- Produção de ferro gusa e açoDocumento48 páginasProdução de ferro gusa e açogiselechavesAinda não há avaliações
- Relatorio 06-Do Cobre Ao CobreDocumento4 páginasRelatorio 06-Do Cobre Ao CobreMaria Elizabeth GuarinoAinda não há avaliações
- Curso Eletroquímica PilhasDocumento24 páginasCurso Eletroquímica PilhasWilson AbreuAinda não há avaliações
- Cap 4 Hidrometalurgia FinalizadoDocumento18 páginasCap 4 Hidrometalurgia FinalizadoCleidsonSantosAinda não há avaliações
- Catalogo Produtos Contagem PDFDocumento28 páginasCatalogo Produtos Contagem PDFFábio MartinsAinda não há avaliações
- Resumo Produtos ArcelorMittalDocumento24 páginasResumo Produtos ArcelorMittalbaixar_tutoriaisAinda não há avaliações
- Contato Entre Corpos RolantesDocumento19 páginasContato Entre Corpos Rolantesbaixar_tutoriaisAinda não há avaliações
- Vinhos para Lasanha e Pinot NoirDocumento5 páginasVinhos para Lasanha e Pinot Noirbaixar_tutoriaisAinda não há avaliações
- Ligacoes Soldadas PDFDocumento3 páginasLigacoes Soldadas PDFbaixar_tutoriaisAinda não há avaliações
- Tabela de ConversãoDocumento17 páginasTabela de ConversãoJorge Loiola100% (2)
- Dados Rolamento 6005 PDFDocumento1 páginaDados Rolamento 6005 PDFbaixar_tutoriaisAinda não há avaliações
- Armazenamento de Arame TubularDocumento1 páginaArmazenamento de Arame Tubularbaixar_tutoriaisAinda não há avaliações
- CaligrafiaDocumento3 páginasCaligrafiabaixar_tutoriaisAinda não há avaliações
- Determinação dos esforços de cisalhamento, momentos fletores e deformaçãoDocumento9 páginasDeterminação dos esforços de cisalhamento, momentos fletores e deformaçãoEdercleyMouraAinda não há avaliações
- Armazenamento e Secagem de Fluxo de Arco SubmersoDocumento1 páginaArmazenamento e Secagem de Fluxo de Arco Submersobaixar_tutoriaisAinda não há avaliações
- Dirigindo EconomicamenteDocumento17 páginasDirigindo Economicamentebaixar_tutoriaisAinda não há avaliações
- EaD - SW SimulationDocumento2 páginasEaD - SW Simulationbaixar_tutoriaisAinda não há avaliações
- Determinação dos esforços de cisalhamento, momentos fletores e deformaçãoDocumento9 páginasDeterminação dos esforços de cisalhamento, momentos fletores e deformaçãoEdercleyMouraAinda não há avaliações
- Combinações de CargaDocumento2 páginasCombinações de Cargabaixar_tutoriaisAinda não há avaliações
- Dirigindo EconomicamenteDocumento17 páginasDirigindo Economicamentebaixar_tutoriaisAinda não há avaliações
- CSegurançaDocumento6 páginasCSegurançaPaulo AfonsoAinda não há avaliações
- Visao Sobre NBR8800Documento7 páginasVisao Sobre NBR8800baixar_tutoriaisAinda não há avaliações
- Combinações de CargaDocumento2 páginasCombinações de Cargabaixar_tutoriaisAinda não há avaliações
- Dimensionamento TransformadorDocumento5 páginasDimensionamento TransformadorAlice MattesAinda não há avaliações
- Pinos ElasticosDocumento2 páginasPinos Elasticosbaixar_tutoriaisAinda não há avaliações
- Diagramas de EsforçosDocumento19 páginasDiagramas de EsforçosBruno Guidi100% (1)
- Células eletroquímicas e tipos de eletrodosDocumento10 páginasCélulas eletroquímicas e tipos de eletrodosleandra benittzAinda não há avaliações
- Portal de Engenharia Quimica - Destilação MulticomponenteDocumento9 páginasPortal de Engenharia Quimica - Destilação Multicomponentesabrina amaralAinda não há avaliações
- Simulado ItaDocumento31 páginasSimulado ItaCRISTAL PLAYERAinda não há avaliações
- Teste de Química sobre Alcoolemia e Titulação de ÁcidoDocumento9 páginasTeste de Química sobre Alcoolemia e Titulação de ÁcidotesteAinda não há avaliações
- Aula 2 - Secagem de GrãosDocumento74 páginasAula 2 - Secagem de GrãosJoemar Mendes RegoAinda não há avaliações
- RespostasExercíciosCapítulos1523Documento10 páginasRespostasExercíciosCapítulos1523Adryana SousaAinda não há avaliações
- Diagrama de fases ternárioDocumento10 páginasDiagrama de fases ternárioJosé MatheusAinda não há avaliações
- Cálculo de equilíbrio químico e constantes de equilíbrio KcDocumento20 páginasCálculo de equilíbrio químico e constantes de equilíbrio KcSchwarzer The Twisted OneAinda não há avaliações
- Mecânica de Construção II - Treliças IsostáticasDocumento36 páginasMecânica de Construção II - Treliças IsostáticasApvs Wamarita100% (1)
- 11ano Q 1 2 3 Principio de Le ChatelierDocumento19 páginas11ano Q 1 2 3 Principio de Le ChatelierBruna PeixotoAinda não há avaliações
- Equilíbrio Químico em Soluções AquosasDocumento57 páginasEquilíbrio Químico em Soluções AquosasLílian Barreto Gonçalves100% (1)
- Equilíbrio químico: conceitos e perturbaçõesDocumento43 páginasEquilíbrio químico: conceitos e perturbaçõesLucas MarcelinoAinda não há avaliações
- Ae q11 Sol TestesDocumento5 páginasAe q11 Sol TestesGabriela SaraivaAinda não há avaliações
- Aula Equilíbrio QuímicoDocumento32 páginasAula Equilíbrio QuímicoRodrigo LuizAinda não há avaliações
- A capacidade tamponante da água de coco, leite e solução tampão de fosfatoDocumento12 páginasA capacidade tamponante da água de coco, leite e solução tampão de fosfatoCarol AgostiniAinda não há avaliações
- Calculo Margem ContribuiçãoDocumento6 páginasCalculo Margem ContribuiçãogomesgvpgAinda não há avaliações
- Equilíbrio químico e propriedades ácido-baseDocumento4 páginasEquilíbrio químico e propriedades ácido-baselucas_cmaAinda não há avaliações
- 02 Eq11 Teste Aval 1 Equilibrio Quimico v1Documento12 páginas02 Eq11 Teste Aval 1 Equilibrio Quimico v1Rita DuarteAinda não há avaliações
- O Jogo Da CorrupçãoDocumento34 páginasO Jogo Da CorrupçãoJoão Navarro100% (1)
- Equilíbrio QuímicoDocumento5 páginasEquilíbrio QuímicoMarina PiresAinda não há avaliações
- Bioquímica - Aula 3 sobre metabolismo energético e leis da termodinâmicaDocumento17 páginasBioquímica - Aula 3 sobre metabolismo energético e leis da termodinâmicabrunomoreira1234Ainda não há avaliações
- Ficha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQDocumento4 páginasFicha de Trabalho 7 - Aspetos Quantitativos Das RQ e Equilíbrio Químico e Extensão Das RQFranciscaAinda não há avaliações
- AbsorçãoDocumento17 páginasAbsorçãoBruna PrezottiAinda não há avaliações
- Termodinâmica - Problemas de compressão gasosa e transições de faseDocumento2 páginasTermodinâmica - Problemas de compressão gasosa e transições de faseVinicius Ribeiro VelosoAinda não há avaliações
- Equilíbrio Ácido-Básico e AlimentosDocumento3 páginasEquilíbrio Ácido-Básico e AlimentosEdlenecslAinda não há avaliações
- Alfa - Módulo 43 PDFDocumento31 páginasAlfa - Módulo 43 PDFjparatyAinda não há avaliações
- JP11 NL (Teste CC) 04 2022Documento4 páginasJP11 NL (Teste CC) 04 2022carla_noronha7812Ainda não há avaliações
- Modulo 2 SolucoesDocumento110 páginasModulo 2 SolucoesThays AlvesAinda não há avaliações
- Química - Exercícios cinética, equilíbrio e eletroquímicaDocumento7 páginasQuímica - Exercícios cinética, equilíbrio e eletroquímicaIgor Ferreira da SilvaAinda não há avaliações
- Proposta de Programa de ExamDocumento18 páginasProposta de Programa de ExamNaty FelixAinda não há avaliações