Escolar Documentos
Profissional Documentos
Cultura Documentos
1ºteste - CTeSP Análises Laboratoriais
Enviado por
Luísa LopesDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
1ºteste - CTeSP Análises Laboratoriais
Enviado por
Luísa LopesDireitos autorais:
Formatos disponíveis
INSTITUTO POLITÉCNICO DE VISEU
Departamento de Ambiente ESCOLA SUPERIOR DE TECNOLOGIA
Curso:
CTeSP Análises Laboratoriais Disciplina Química
Docente
Tipo de Prova: 1º Teste Profª Doutora Luísa Paula Valente
Responsável
Época: Normal Ano 1º Semestre 1º
Ano lectivo: 2019-2020 Data 2019-10-28 Duração 1 h 30
Nome ____________________________________________________ Nº Mecanográfico________
Classificação:______________________________ Docente: _______________________________
1. Um feixe de radiação electromagnética de comprimento de onda 10-7 m pode transportar por
segundo uma energia de 10-3 J. Sabendo que a energia de remoção do metal é 12,375×10-19 J.
Qual a energia cinética que cada eletrão ejetado possui? (h=6,6×10-34 Js; c=3×108 ms-1)
2. Considere o quadro seguinte, que representa uma parte da Tabela Periódica dos elementos (as
letras não correspondem aos símbolos químicos).
B H
C G F
D I
Compara justificando
2.1. Os valores de raios iónicos dos elementos C e G. Os valores de raios iónicos dos elementos B e
D.
2.2. Para o elemento A, os valores dos raios atómico e iónico. Os valores dos raios atómico e iónico
para o elemento F.
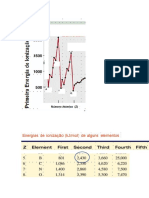
2.3. Os valores da 1ª energia de ionização dos elementos G e F; dos elementos A e C; e dos
elementos H e C.
INSTITUTO POLITÉCNICO DE VISEU
Departamento de Ambiente ESCOLA SUPERIOR DE TECNOLOGIA
Disciplina: Química Data: 2019-10-28
Tipo de Prova: 1º Teste Época: Normal
3. Ao eletrão do átomo de hidrogénio descrito pela função de onda 1,0,0 corresponde uma energia
superior do que o eletrão do átomo de oxigénio (8O) descrito pela função de onda 2,1,-1.
Justifique. Sabendo que: En=(-2,18×10-18×Z2)/n2
4. O propano (CH3CH2CH3, massa molar 44,0 gmol-1) é insolúvel em HClO4, mas o etanol
(CH3CH2OH, massa molar 46,0 gmol-1) é solúvel. Justifique porquê.
5. Qual a entalpia padrão de formação do propano ?
C(grafite) O 2 (g) CO 2 (g) H of 393 kJ(molCO 2 ) 1
H (g) 1 2 O 2 (g) H 2 O(l) H of 286 kJ(molH 2 O) 1
2
C H (g) 5O 2 (g) 3CO 2 (g) 4H 2 O(l) H of 2452 kJ(molC3 H 8 ) 1
3 8
6. A densidade de uma solução de H2SO4 é 1,82. Sabendo que a concentração daquela solução é
5,8 moldm-3. Determine:
6.1. A molalidade da solução.
6.2. A fração molar do soluto
6.3. A percentagem de solvente, em massa.
Dados: M.M. (H2SO4) = 98,08 g mol-1; M.M. (H2O) = 18,0 g mol-1.
Você também pode gostar
- Seleção PPG Química UFPE 2012Documento6 páginasSeleção PPG Química UFPE 2012Rafaela FreitasAinda não há avaliações
- Provas NiteróiDocumento8 páginasProvas NiteróiLeonardoAinda não há avaliações
- Prova de Conhecimentos em Química Geral para Mestrado em QuímicaDocumento11 páginasProva de Conhecimentos em Química Geral para Mestrado em QuímicarobsonssoutoAinda não há avaliações
- Prova de Mestrado em Química UFPRDocumento9 páginasProva de Mestrado em Química UFPRMarcelo VitóriaAinda não há avaliações
- Química: Raio atômico, reatividade e pares galvânicosDocumento9 páginasQuímica: Raio atômico, reatividade e pares galvânicosKelita CoimbraAinda não há avaliações
- Física e Química: Energias de Ionização e LigaçãoDocumento7 páginasFísica e Química: Energias de Ionização e Ligaçãocosmos35Ainda não há avaliações
- Correção Teste Fisico Quimica 10 AnoDocumento7 páginasCorreção Teste Fisico Quimica 10 AnoFábio Ferreira100% (1)
- Exame Final de QuimicaDocumento6 páginasExame Final de QuimicavivaldoAinda não há avaliações
- 2o Minificha 2 v2 10oano 2019 2020Documento2 páginas2o Minificha 2 v2 10oano 2019 2020SolangeAlmeidaAinda não há avaliações
- Teste de QuimicaDocumento6 páginasTeste de QuimicamarcelinoAinda não há avaliações
- Qr10 Teste GlobalDocumento9 páginasQr10 Teste GlobalAna MartinsAinda não há avaliações
- Teste de Avaliação 10-Qui0004Documento9 páginasTeste de Avaliação 10-Qui0004JoaoAinda não há avaliações
- Ficha Global 1 - LeyaDocumento3 páginasFicha Global 1 - LeyaFrancisco MendesAinda não há avaliações
- Agrupamento de Escolas de Alcácer Do SalDocumento8 páginasAgrupamento de Escolas de Alcácer Do SalMárciaValenteValenteAinda não há avaliações
- Prova de Seleção Do Mestrado em Química - UFMA - 20231Documento2 páginasProva de Seleção Do Mestrado em Química - UFMA - 20231Gabriel PereiraAinda não há avaliações
- Prova 1 V1Documento5 páginasProva 1 V1Fradique6Ainda não há avaliações
- Teste de Avaliação de Química Elementos químicosDocumento10 páginasTeste de Avaliação de Química Elementos químicosJoão RibeiroAinda não há avaliações
- Lista de Exercícios QuímicaDocumento3 páginasLista de Exercícios QuímicaRonanMendonçaAinda não há avaliações
- Teste 1 (2017)Documento5 páginasTeste 1 (2017)Maria João LoureiroAinda não há avaliações
- Quimica GeralDocumento15 páginasQuimica GeralLuis Fernando PereiraAinda não há avaliações
- Velocidade Das Reações - ÍtaloDocumento8 páginasVelocidade Das Reações - ÍtaloItalo PiresAinda não há avaliações
- Ligação Química e Propriedades dos CompostosDocumento5 páginasLigação Química e Propriedades dos CompostosBia100% (2)
- EXAME FINAL NACIONAL DO ENSINO SECUNDÁRIO Prova Escrita de Física e Química ADocumento13 páginasEXAME FINAL NACIONAL DO ENSINO SECUNDÁRIO Prova Escrita de Física e Química ALara MouraAinda não há avaliações
- Teste de Avaliação de Química Elementos químicosDocumento10 páginasTeste de Avaliação de Química Elementos químicosDavid MrspAinda não há avaliações
- Teste Química 10o AnoDocumento7 páginasTeste Química 10o AnoMiguel AntonioAinda não há avaliações
- Disciplina de Química 11 Classe - Variante A Duração: 40 MinutosDocumento2 páginasDisciplina de Química 11 Classe - Variante A Duração: 40 MinutosEtelvino A. AntonioAinda não há avaliações
- Chave de Respostas - Exame OBQ Fase VI-2017 PDFDocumento37 páginasChave de Respostas - Exame OBQ Fase VI-2017 PDFAlicia LoboAinda não há avaliações
- 02 - Teste 10 - Elementos - Quimicos - Sua - Organizacao - v1 Nov 2018Documento12 páginas02 - Teste 10 - Elementos - Quimicos - Sua - Organizacao - v1 Nov 2018Rodrigo Correia100% (1)
- Cópia de FQ A I 10 (Q) - Fich Trab N08Documento4 páginasCópia de FQ A I 10 (Q) - Fich Trab N08Meiline DantasAinda não há avaliações
- 2020 2021 Eq10 02 Teste Elem Quim Sua Organiz v1Documento10 páginas2020 2021 Eq10 02 Teste Elem Quim Sua Organiz v1matildeAinda não há avaliações
- III Lista de Exercícios FQ GeralDocumento2 páginasIII Lista de Exercícios FQ GeralMaria BotterAinda não há avaliações
- Trabalho Química Equilíbrio ReaçõesDocumento2 páginasTrabalho Química Equilíbrio ReaçõesPaula BronzeAinda não há avaliações
- Exercicios de Química - VunespDocumento32 páginasExercicios de Química - VunespDio Jose0% (1)
- QA - Dominio 2Documento8 páginasQA - Dominio 2Francisco MendesAinda não há avaliações
- Espectroscopia atómica revela novo gás argónDocumento11 páginasEspectroscopia atómica revela novo gás argónAlda Maria Dinis GinjaAinda não há avaliações
- FilDocumento6 páginasFilKika AmorimAinda não há avaliações
- Recuperação Paralela 2º AnosDocumento2 páginasRecuperação Paralela 2º AnoskhaiuktAinda não há avaliações
- FF02 FQDocumento4 páginasFF02 FQAndré MatosAinda não há avaliações
- Ciências Físico-Químicas 10º Ano Ficha de Trabalho Preparação Teste 1Documento14 páginasCiências Físico-Químicas 10º Ano Ficha de Trabalho Preparação Teste 1Lu LopesAinda não há avaliações
- Ae rq10 Teste 2Documento9 páginasAe rq10 Teste 2zava0% (1)
- FF 04Documento4 páginasFF 04Pedro GonzagaAinda não há avaliações
- 2020 2021 Eq10 02 Teste Propriedades Transf Materia v1Documento11 páginas2020 2021 Eq10 02 Teste Propriedades Transf Materia v1Vera TavaresAinda não há avaliações
- Resolução de Exame de Admissão de ISCISA 2015Documento2 páginasResolução de Exame de Admissão de ISCISA 2015Tony Matusse86% (21)
- Testes Q10Documento9 páginasTestes Q10Susana ChavesAinda não há avaliações
- Fu1.8 - U1-Elementos Químicas e A Sua OrganizaçãoDocumento3 páginasFu1.8 - U1-Elementos Químicas e A Sua OrganizaçãoiolaAinda não há avaliações
- Teste 1 10ºano 20-21Documento9 páginasTeste 1 10ºano 20-21Leticia PlescoAinda não há avaliações
- Novo 10Q Teste3)Documento7 páginasNovo 10Q Teste3)Tomás SilveiraAinda não há avaliações
- 2019 2020 Eq10 02 Teste Propriedades Transf Materia v1Documento10 páginas2019 2020 Eq10 02 Teste Propriedades Transf Materia v1Vera TavaresAinda não há avaliações
- Gab-2019 1Documento9 páginasGab-2019 1Gracieth SebastiãoAinda não há avaliações
- Enunciado Química 12 CL 2013-Extra PDFDocumento5 páginasEnunciado Química 12 CL 2013-Extra PDFJonathan FrancoAinda não há avaliações
- Marista - Química - 2 Série - 1 Etapa - Atividade 1 - Tipos de MassasDocumento2 páginasMarista - Química - 2 Série - 1 Etapa - Atividade 1 - Tipos de MassasRenan Barcelos MendesAinda não há avaliações
- Gabaritoms 2018.1 19.01 1Documento9 páginasGabaritoms 2018.1 19.01 1Wilkins BarrosAinda não há avaliações
- Apostila Química Orgânica: Carbono, Dienos E AromáticosNo EverandApostila Química Orgânica: Carbono, Dienos E AromáticosAinda não há avaliações
- Ácidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteNo EverandÁcidos e Bases de Brönsted e Lowry: Uma visão aplicada ao meio ambienteAinda não há avaliações
- Apostila Química Orgânica: Terpenos E Rotas De SínteseNo EverandApostila Química Orgânica: Terpenos E Rotas De SínteseAinda não há avaliações
- Aprendendo a mecânica quântica: equação de Schrödinger em 1DNo EverandAprendendo a mecânica quântica: equação de Schrödinger em 1DAinda não há avaliações
- Cinética QuímicaDocumento20 páginasCinética QuímicaLuísa LopesAinda não há avaliações
- Estado GasosoDocumento67 páginasEstado GasosoLuísa LopesAinda não há avaliações
- Capítulo 9 Reações RedoxDocumento15 páginasCapítulo 9 Reações RedoxLuísa LopesAinda não há avaliações
- Cinética QuímicaDocumento20 páginasCinética QuímicaLuísa LopesAinda não há avaliações
- Cap 3Documento26 páginasCap 3Luísa LopesAinda não há avaliações
- 1º Teste - GSTA PDFDocumento1 página1º Teste - GSTA PDFLuísa LopesAinda não há avaliações
- ExercíciosDocumento1 páginaExercíciosLuísa LopesAinda não há avaliações
- Cap2 PDFDocumento21 páginasCap2 PDFLuísa LopesAinda não há avaliações
- QueatãoAula QG LEA 2019 PDFDocumento1 páginaQueatãoAula QG LEA 2019 PDFLuísa LopesAinda não há avaliações
- Cinética QuímicaDocumento20 páginasCinética QuímicaLuísa LopesAinda não há avaliações
- 1ºteste - CTeSP Análises LaboratoriaisDocumento2 páginas1ºteste - CTeSP Análises LaboratoriaisLuísa LopesAinda não há avaliações
- Estado GasosoDocumento67 páginasEstado GasosoLuísa LopesAinda não há avaliações
- SoluçõesDocumento18 páginasSoluçõesLuísa LopesAinda não há avaliações
- Cap 3Documento26 páginasCap 3Luísa LopesAinda não há avaliações
- Exame 2008&2009Documento3 páginasExame 2008&2009Luísa LopesAinda não há avaliações
- Operações Unitárias e Reactores prova exameDocumento3 páginasOperações Unitárias e Reactores prova exameLuísa LopesAinda não há avaliações
- Cap 3Documento26 páginasCap 3Luísa LopesAinda não há avaliações
- Cinética QuímicaDocumento20 páginasCinética QuímicaLuísa LopesAinda não há avaliações
- Cap 3Documento26 páginasCap 3Luísa LopesAinda não há avaliações
- Cap2 PDFDocumento21 páginasCap2 PDFLuísa LopesAinda não há avaliações
- Estado GasosoDocumento67 páginasEstado GasosoLuísa LopesAinda não há avaliações
- Sistemas Terra e seus componentesDocumento12 páginasSistemas Terra e seus componentesMaria ResendeAinda não há avaliações
- MN - Pd.e.001 - Manual de Instalação Módulo FV Bifacial - 2020 - 01Documento24 páginasMN - Pd.e.001 - Manual de Instalação Módulo FV Bifacial - 2020 - 01Bruno SlongoAinda não há avaliações
- Apresentação QSK-60Documento64 páginasApresentação QSK-60CELSON HENRIQUE GOMES DE RESENDE100% (1)
- Projeto de Molas Helicoidais e Barras de TorçãoDocumento27 páginasProjeto de Molas Helicoidais e Barras de TorçãofeltofsnakeAinda não há avaliações
- Determinação de Cr6+ por espectrofotometriaDocumento12 páginasDeterminação de Cr6+ por espectrofotometriaJuliane Froncheti de MouraAinda não há avaliações
- Ensaio Ii - Ensaio de Tração em Barra de Aço Sae 1020 Objetivos Deste EnsaioDocumento5 páginasEnsaio Ii - Ensaio de Tração em Barra de Aço Sae 1020 Objetivos Deste EnsaioGustavo TrevenzoliAinda não há avaliações
- Modelos de Equilíbrio de ForçasDocumento22 páginasModelos de Equilíbrio de ForçasPEDRO HENRIQUEAinda não há avaliações
- SensoresDocumento1 páginaSensoresRobertoLuizAinda não há avaliações
- Lista Cap Tulo 4Documento4 páginasLista Cap Tulo 4Vinícius PradaAinda não há avaliações
- Manutenção de equipamento de corte a gásDocumento16 páginasManutenção de equipamento de corte a gásJoão Victor MachadoAinda não há avaliações
- Fusos de esferas: tipos, cálculos de vida útil e capacidade de cargaDocumento11 páginasFusos de esferas: tipos, cálculos de vida útil e capacidade de cargavagnersgAinda não há avaliações
- FichaGlobal Física10anoDocumento16 páginasFichaGlobal Física10anoKika AmaralAinda não há avaliações
- 01 Eletroq Ionica WMDocumento17 páginas01 Eletroq Ionica WMSimony SôniaAinda não há avaliações
- EnsaioporultrasomDocumento78 páginasEnsaioporultrasomThiago Vianna100% (1)
- Separação de Misturas Exercícios QuímicaDocumento3 páginasSeparação de Misturas Exercícios QuímicaRayane SantosAinda não há avaliações
- Maximos Vest. Eletrostática ExerciciosDocumento3 páginasMaximos Vest. Eletrostática ExerciciosDhenison CarlosAinda não há avaliações
- Tabelas de Perfis - Walter PfeilDocumento55 páginasTabelas de Perfis - Walter PfeilTamirisAinda não há avaliações
- GazzinelliDocumento22 páginasGazzinellimeujael28Ainda não há avaliações
- Apostila CalorimetriaDocumento3 páginasApostila CalorimetriaPatrick OliveiraAinda não há avaliações
- Relatorio Experimento 5 PDFDocumento11 páginasRelatorio Experimento 5 PDFLeonardo FrançaAinda não há avaliações
- Diesel Mercedes Motor MR códigos de defeito tabelaDocumento13 páginasDiesel Mercedes Motor MR códigos de defeito tabelagustavo silvaAinda não há avaliações
- Atividases DanDocumento5 páginasAtividases DanNilza SouzaAinda não há avaliações
- 2015 - Cumbe, Vasconcelos CamõesDocumento49 páginas2015 - Cumbe, Vasconcelos Camõeslito fastudoAinda não há avaliações
- Aula 01 - Geografia FísicaDocumento63 páginasAula 01 - Geografia FísicaArthur R RochaAinda não há avaliações
- Calculo NBR 8800 - Perfil MistoDocumento13 páginasCalculo NBR 8800 - Perfil MistoHerick LemosAinda não há avaliações
- Case Ih Motor Cursor 9 MT - F2ce - BRDocumento170 páginasCase Ih Motor Cursor 9 MT - F2ce - BRLar Tranquilo Diego91% (35)
- Equipamentos da Completação de PoçosDocumento102 páginasEquipamentos da Completação de PoçosMarcos Antonio Quintanilla Tejerina100% (2)
- Forças de Atrito em Parafuso: Como Calcular o Momento NecessárioDocumento13 páginasForças de Atrito em Parafuso: Como Calcular o Momento Necessáriokaren1604Ainda não há avaliações
- Torres de Resfriamento: Tipos, Partes e CálculosDocumento28 páginasTorres de Resfriamento: Tipos, Partes e CálculosSergio Fernandes PereiraAinda não há avaliações
- Lista Da Aula 3 - Cinética QuímicaDocumento5 páginasLista Da Aula 3 - Cinética QuímicaE P Som RJAinda não há avaliações