Escolar Documentos
Profissional Documentos
Cultura Documentos
Vía compartida y específica de señalización de los TLR
Enviado por
Jackeline AbantoTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Vía compartida y específica de señalización de los TLR
Enviado por
Jackeline AbantoDireitos autorais:
Formatos disponíveis
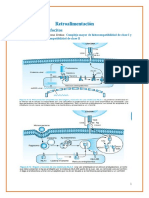
VIA DE SEALIZACION DE LOS TLR La activacin de la va de seales de transduccin por los TLRs da lugar a la induccin de varios genes que
funcionan en la defensa del hospedero, incluyendo citoquinas inflamatorias, quimiocinas, MHC y molculas coestimuladoras. Los TLR de los mamferos inducen multiples molculas efectoras como: sintasa de oxido ntrico y pptidos antimicrobianos q puede matar directamente al patgeno. TLRs y IL-1Rs tienen dominios TIR para activar a las quinasas de NF-kB y MAP (protena activadora de mitosis) e inducen genes. Va de sealizacin de los TRL puede dividirse en dos: compartida y la especifica. La via compartida es inducida por todos los TLRs as como por los IL-1Rs. La via especifica es activada por algunos TLR y puede explicar las diferencias en la sealizacin entre TLR y IL-1R. VIA COMPARTIDA: 4 componentes 1. 2. 3. 4. Adaptador de protenas MyD88 Adaptador de protenas TOLLIP ( protena que interacta con Toll) Protein quinasa (IRAK kinasa asociada a IL-1R) Adaptador TRAF6 ( receptor factor 6 asociado a TNF)
MyD88 : contiene dos dominios: dominio amino terminal letal y otro carboxi terminal TIR. El dominio TIR del MyD88 esta asociado con el TIR del TLR y de IL1R. el dominio amino terminal letal interacta con el dominio amino terminal letal del IRAK y recluta al IRAK para formar el complejo. TOLLIP: puede asociarse con IRAK y con el dominio TIR del TLR, tambin reclutar al IRAK para formar el complejo pero con cintica diferente a la del MyD88. El TOLLIP no tiene dominio TIR pero tiene dominios C2 que se sabe que en otras protenas interacta con la membrana de los lpidos. IRAK se autofosforila para asocia con TRAF6. la formacin del complejo y de esta manera se
TRAF6 induce la activacin de TAK1 (kinasa de activacin del TGF-b) (TGF-b= factor de crecimiento transformante) y MKK6 (kinasa kinasa 6 MAP) (MAP = protena activacin mitosis), las cuales activaran a NF-Kb, JNK( kinasa c-Jun Nterminal)y p38 MAP kinasa respectivamente. La sealizacin dependiente de MyD88, el TLR2 la via de este incluya a la PKB (protein quinasa B). El dominio citoplasmtico de TLR2 interacta con la familia GTPasa RHO, RAC1 y PI3K ( fosfatidilinositol quinasa 3). En la sealizacin de TLR2, PKB fosforila al NF-kB que es requerido para la actividad de transactivacion.
Deficiencia de MyD88: afecta TLR4 y 3. Macrfagos y CD que derivan de un raton al que se le hizo un knockout de MyD88 no producen citoquinas IL-1B, TNF-, IL-6 y IL-12 cuando fue estimulada por LPS, poliIC, MALP-2 (lipoprotena diacetilada de micoplasma) o CpG que sealan a travs de TLR4, 3, 3 y 9 respectivamente. Curiosamente un raton sin MyD88 es resistente al choque endotoxico. Un estudio demostr que solo LPS y poliIC pueden activar NF-kB, JNK y p38 en clulas deficientes de MyD88; no siendo asi para CpG o MALP-2. Igual para el TLR4 tambin hubo activacin en parte aunque insuficiente de estas vas. El TLR4 y 3 usan al menos dos vas de sealizacin transduccional para activar a NF-kB y MAP quinasas. Una de estas vas es MyD88 dependiente y es usada por los TLRs; mientras que la otra via es MyD88 independiente y es desencadenada por TLR4 y posiblemente por 3, pero no por TLR2 o 9. Los receptores IL-1 y IL-18 no inducen una sealizacin en ausencia de MyD88 lo que sugiere que carece de una via MyD88 independiente. La via MyD88 independiente puede conducir a la maduracin de las CD. Cuando las CD inmaduras derivadas de MO (BMDCs) son estimuladas con LPS, poliIC o CpG producen grandes cantidades de IL-12 y regulan la expresin en superficie celular de MHC y molculas co estimuladoras. Las BMDCs con deficiencia de MyD88 que son estimuladas por LPS, poliIC o CpG fallan la produccin de IL-12 e IL-6. Sin embargo ellas pueden inducir una regulacin en la expresin de MHC y molculas co estimuladoras como CD80 y CD86 cuando tratan con LPS o poliIC pero no con CpG. La via MyD88 independiente estimulada por TLR4 y 3 es suficiente para estimular la maduracin de CD. La via MyD88 dependiente es requerida para inducir IL-6 y IL-12. Adems de los eventos de la transcripcin que puede ser inducida a travs de la va MyD88 independiente, se ha demostrado que el procesamiento de la la caspasa-1 de IL-18 en su forma biolgicamente activa tambin puede ser inducida por TLR4 independientemente de MyD88. NUEVO ADAPTADOR DE PROTEINA TIRAP (protena adaptadora que contiene un receptor para Toll7IL-1R) (tambin llamado MAL por MyD88 adaptador) fue demostrada la funcin en la cascada de TLR4. TIRAP tiene un dominio TIR carboxiterminal pero no liga MyD88, TIRAP no tiene un dominio letal en su lugar tiene una regin amino terminal rica en serina/prolina de funcin desconocida. TIRAP se asocia con el dominio TIR del TLR4; una forma dominante negativa de TIRAP inhibe la sealizacin de TLR4 pero no de TLR9 o IL-1R, indicando que TIRAP controla la activacin de la va independiente de MyD88.
Você também pode gostar
- Cascadas de Activación de Células T y BDocumento57 páginasCascadas de Activación de Células T y BFERNANDAAinda não há avaliações
- INMUNIDAD CELULAR Estudiantes PDFDocumento49 páginasINMUNIDAD CELULAR Estudiantes PDFlordgimli77100% (3)
- Activación de Linfocitos T y B: Reconocimiento Antigénico y SeñalizaciónDocumento22 páginasActivación de Linfocitos T y B: Reconocimiento Antigénico y SeñalizaciónDove CameronAinda não há avaliações
- Inmunidad InnataDocumento14 páginasInmunidad InnataMelissa RodriguezAinda não há avaliações
- Activación de LinfocitosDocumento25 páginasActivación de Linfocitoselizabeth890716Ainda não há avaliações
- Maduración y Activación de Linfocitos TDocumento59 páginasMaduración y Activación de Linfocitos TVioleta Tello MedinaAinda não há avaliações
- El Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad InnataDocumento46 páginasEl Papel de Los Receptores de Reconocimiento de Patrones en La Inmunidad InnataKArdo23Ainda não há avaliações
- El Papel de Los TLR en La Activación de NeutrófilosDocumento6 páginasEl Papel de Los TLR en La Activación de NeutrófilosVic VargasAinda não há avaliações
- Actividad Receptores de PRRDocumento11 páginasActividad Receptores de PRRAndres PelayoAinda não há avaliações
- Linfocitos y marcadores fenotípicosDocumento7 páginasLinfocitos y marcadores fenotípicosSam CedilloAinda não há avaliações
- Esquema AntiinfecciosasDocumento6 páginasEsquema AntiinfecciosasfernandaenbsasAinda não há avaliações
- T4 InmunoDocumento21 páginasT4 InmunoCris SánchezAinda não há avaliações
- Receptores Tipo Toll (TLR)Documento36 páginasReceptores Tipo Toll (TLR)Brenda Collantes VidalAinda não há avaliações
- SLAM ResumenDocumento3 páginasSLAM ResumenKathyMkrAinda não há avaliações
- Seminario 2. Inmunidad Innata. Parte 2.Documento29 páginasSeminario 2. Inmunidad Innata. Parte 2.lilianabarbagallo.estilistaAinda não há avaliações
- Citoquinas As Por Linfocitos Cd4Documento9 páginasCitoquinas As Por Linfocitos Cd4Claudia RodriguezAinda não há avaliações
- RESPUESTA INNATADocumento4 páginasRESPUESTA INNATAAndrea Mariel PeñaAinda não há avaliações
- MHC IDocumento8 páginasMHC IXimena SanabriaAinda não há avaliações
- Cap. 5 - Inmunidad Mediada Por Linfocitos TDocumento30 páginasCap. 5 - Inmunidad Mediada Por Linfocitos TDaviid A'SAinda não há avaliações
- Innata 2Documento46 páginasInnata 2henriquecastelanAinda não há avaliações
- Activacion de Los Linfocitos Clase IIDocumento72 páginasActivacion de Los Linfocitos Clase IIOlga Meléndez MayorquinAinda não há avaliações
- Resumen NKDocumento4 páginasResumen NKCristian PeñaAinda não há avaliações
- Receptores Citosólicos para Pamp y DampDocumento4 páginasReceptores Citosólicos para Pamp y DampPame FloresAinda não há avaliações
- Nos Ubicamos Segundo ParcialDocumento17 páginasNos Ubicamos Segundo ParcialBruno Masci MiralAinda não há avaliações
- Guia InmunoDocumento6 páginasGuia InmunoFERNANDA HERNANDEZ LOPEZAinda não há avaliações
- TCR 1Documento14 páginasTCR 1Kevin alberto Pérez de la cruzAinda não há avaliações
- 1 AlergiasDocumento6 páginas1 AlergiasDiana RamirezAinda não há avaliações
- 01 Toll-Like Receptors - Roles in Disease and Therapy - UpToDate PDFDocumento23 páginas01 Toll-Like Receptors - Roles in Disease and Therapy - UpToDate PDFMarceloAinda não há avaliações
- Activación de Linfocitos TDocumento26 páginasActivación de Linfocitos TFernandho Cruz BaciiliioAinda não há avaliações
- URP Seminario 03 Receptores SolublesDocumento13 páginasURP Seminario 03 Receptores SolublesYébeny Tufino AlvaradoAinda não há avaliações
- 08 - Activacion T y Mecanismos EfectoresDocumento32 páginas08 - Activacion T y Mecanismos Efectores25984076Ainda não há avaliações
- Inflamasomas: sensores clave de la respuesta inmune innataDocumento5 páginasInflamasomas: sensores clave de la respuesta inmune innataMarijose Salas VargasAinda não há avaliações
- Receptores Del Tipo RIGDocumento7 páginasReceptores Del Tipo RIGReyner CovarrubiasAinda não há avaliações
- Capítulo 13 Pavón. Linfocitos TDocumento12 páginasCapítulo 13 Pavón. Linfocitos TClaudia PérezAinda não há avaliações
- Guía Segundo Parcial InmunologíaDocumento7 páginasGuía Segundo Parcial Inmunologíaanaca59505Ainda não há avaliações
- GUIA CLASE 12 2023-1 - Activacion Linfocitos TDocumento8 páginasGUIA CLASE 12 2023-1 - Activacion Linfocitos TVale AlvarezAinda não há avaliações
- Expo LT ReguladoresDocumento25 páginasExpo LT ReguladoresPablo VilchesAinda não há avaliações
- Vias de Señalizacion en CancerDocumento13 páginasVias de Señalizacion en CancerFERNANDO GALLARDOAinda não há avaliações
- Receptores y Marcadores LinfocitariosDocumento16 páginasReceptores y Marcadores LinfocitariosSilvana JsbAinda não há avaliações
- Sistema Inmune AdaptativoDocumento6 páginasSistema Inmune AdaptativoJose FernandezAinda não há avaliações
- LPS y Receptores Toll (MAOG)Documento13 páginasLPS y Receptores Toll (MAOG)miguel angel100% (3)
- PRRsDocumento3 páginasPRRsOmar Adrian Hernandez JimenezAinda não há avaliações
- Capitulo 11 InmunoDocumento26 páginasCapitulo 11 InmunoJonatan PintoAinda não há avaliações
- Presentación de AntígenoDocumento5 páginasPresentación de AntígenoFernanda QuilachaminAinda não há avaliações
- Clase 6 R. Linfocitos B y TDocumento25 páginasClase 6 R. Linfocitos B y TRene AlbertoAinda não há avaliações
- Cuestionario HistobioquimicaDocumento3 páginasCuestionario HistobioquimicaSamantha SanchezAinda não há avaliações
- TFG Final Celia CalvoDocumento62 páginasTFG Final Celia Calvowendy pimientaperezAinda não há avaliações
- Cuestionario InmunoDocumento2 páginasCuestionario InmunoRoberto MoralesAinda não há avaliações
- Activación de Linfocitos TDocumento3 páginasActivación de Linfocitos TOctavio ZmAinda não há avaliações
- Generación de Linfocitos T EfectoresDocumento11 páginasGeneración de Linfocitos T EfectoresMariano Félix DemasiAinda não há avaliações
- Citotoxicidad Mediada Por CélulasDocumento6 páginasCitotoxicidad Mediada Por CélulasSuanny ConsuegraAinda não há avaliações
- Investigaciones InmunologiaDocumento15 páginasInvestigaciones InmunologiaErick Salazar ManzanoAinda não há avaliações
- Estructura y función del receptor de célula B y TCRDocumento9 páginasEstructura y función del receptor de célula B y TCRAnny ZhengAinda não há avaliações
- Ontogenia de Los Linfocitos TDocumento6 páginasOntogenia de Los Linfocitos TYamiiLette CorniizAinda não há avaliações
- Resumen Inmunologia AcoDocumento135 páginasResumen Inmunologia AcoManuel González AlayesAinda não há avaliações
- INMUNOLOGÍADocumento6 páginasINMUNOLOGÍADaniela Jiménez LópezAinda não há avaliações
- Linfocitos TDocumento15 páginasLinfocitos TIGNACIO SALVADOR FERNANDEZ GIRONAinda não há avaliações
- Bioquímica básicaDocumento13 páginasBioquímica básicapaula cruzAinda não há avaliações
- Membrana CelularDocumento14 páginasMembrana Celularveronica rieraAinda não há avaliações
- Teoría Del Origen Del QueratoconoDocumento3 páginasTeoría Del Origen Del QueratoconoJhonathan Morán100% (1)
- Clase 3 Albornoz PDFDocumento48 páginasClase 3 Albornoz PDFMILVA ALBORNOZAinda não há avaliações
- Mapa Mental de OvogenesisDocumento1 páginaMapa Mental de OvogenesisMelany AlvarezAinda não há avaliações
- Obste III - CLASE 3 SISTEMA INMUNEDocumento8 páginasObste III - CLASE 3 SISTEMA INMUNESheila Constanza Araya TorresAinda não há avaliações
- Membranas y CélulaDocumento27 páginasMembranas y CélulaodjibwaAinda não há avaliações
- Práctica Tejido SanguíneoDocumento4 páginasPráctica Tejido SanguíneoMónica CantúAinda não há avaliações
- ApoptosisDocumento21 páginasApoptosisArmando EstradaAinda não há avaliações
- Fotosintesis y Fase LuminosaDocumento6 páginasFotosintesis y Fase Luminosamarcela1065Ainda não há avaliações
- EVALUACIÓN PRIMERA PARCIAL 2do BGU BIOLOGÍADocumento2 páginasEVALUACIÓN PRIMERA PARCIAL 2do BGU BIOLOGÍAJohys ArciniegasAinda não há avaliações
- GUÍA - 3 - C.NATURALES-GRADO-9° AlbaniaDocumento3 páginasGUÍA - 3 - C.NATURALES-GRADO-9° AlbaniaalfonsoAinda não há avaliações
- Alteraciones de La Glucolisis Anaerobica y AerobicaDocumento8 páginasAlteraciones de La Glucolisis Anaerobica y AerobicaCarol RuizAinda não há avaliações
- Chaperon AsDocumento35 páginasChaperon Aslord1992Ainda não há avaliações
- Cinetica EnzimaticaDocumento104 páginasCinetica EnzimaticaAngie Grados LopezAinda não há avaliações
- LECTURA 33 2008 Transgenic Approaches For Abiotic Stress Tolerance in Plants, Retrospect and Prospects - En.esDocumento14 páginasLECTURA 33 2008 Transgenic Approaches For Abiotic Stress Tolerance in Plants, Retrospect and Prospects - En.esplanhigion06Ainda não há avaliações
- ATM ArticuloDocumento4 páginasATM ArticulotanianemiAinda não há avaliações
- Antiinflamatorios inhalatorios y sistémicosDocumento38 páginasAntiinflamatorios inhalatorios y sistémicosRodrigo NavaAinda não há avaliações
- Aminoácidos y proteínas: estructura, clasificación y usosDocumento18 páginasAminoácidos y proteínas: estructura, clasificación y usosMaria Victoria Garcia Gomez100% (1)
- 08 Respuesta Inmune Contra Virus y HongosDocumento69 páginas08 Respuesta Inmune Contra Virus y HongosVanessa YapoAinda não há avaliações
- Codigo GeneticoDocumento3 páginasCodigo GeneticoWalter RamirezAinda não há avaliações
- Clase #1Documento8 páginasClase #1Mariana OsorioAinda não há avaliações
- Teoría Respiración CelularDocumento3 páginasTeoría Respiración CelularVale SalinasAinda não há avaliações
- Fisiología Vegetal: Células, Soluciones y Nutrición MineralDocumento104 páginasFisiología Vegetal: Células, Soluciones y Nutrición MineralShamikito Moron Rojas100% (1)
- Preguntas Patogenia ViralDocumento3 páginasPreguntas Patogenia ViralJuan TopoAinda não há avaliações
- Copia de Guía de Clase No 2 Replicación ADN - BioMol2019 - 2Documento1 páginaCopia de Guía de Clase No 2 Replicación ADN - BioMol2019 - 2daniela0% (1)
- Acoplamiento reacciones ATPDocumento7 páginasAcoplamiento reacciones ATPCristhianAinda não há avaliações
- Ciencias ÓmicasDocumento3 páginasCiencias Ómicasandrea laraAinda não há avaliações
- Actividad de Puntos Evaluables - Escenario 2 - PRIMER BLOQUE-TEORICO - VIRTUAL - BIOLOGÍA HUMANA - (GRUPO B01) SEGUNDO INTENTODocumento7 páginasActividad de Puntos Evaluables - Escenario 2 - PRIMER BLOQUE-TEORICO - VIRTUAL - BIOLOGÍA HUMANA - (GRUPO B01) SEGUNDO INTENTOMaria Jose Arcila RuaAinda não há avaliações
- Informe2. MeiosisDocumento9 páginasInforme2. Meiosisvanessa acuna oviedoAinda não há avaliações