Escolar Documentos
Profissional Documentos
Cultura Documentos
Registro de Medicamentos
Enviado por
Vanessa OliveiraTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Registro de Medicamentos
Enviado por
Vanessa OliveiraDireitos autorais:
Formatos disponíveis
REGISTRO MEDICAMENTOS Ensaios Clínicos Fase I:
Objetivos:
• Dados farmacocinéticos.
ETAPAS DO REGISTRO MEDICAMENTOS
I
• Dados farmacodinâmicos.
• Perfil de eventos adversos.
• Estabelecer dose para a atividade farmacodinâmica e/ou toxicológica.
Como um medicamento chega ao mercado? Participantes:
• Voluntários Sadios (exceto para drogas tóxicas).
Fase Clínica Observações:
ESTUDOS ESTUDOS • Dose Inicial baseada em estudos com animais.
ESTUDOS
U
REQUERIMENTO CONCESSÃO FARMACO- Farmacocinética e metabolismo:
CLÍNICOS DE FASE CLÍNICOS DE • Informações iniciais sobre atividade e segurança para subsidiar estudos clínicos de Fase II com pacientes.
PRÉ-CLÍNICOS DE REGISTRO DE REGISTRO VIGILÂNCIA Para a condução das pesquisas clínicas – ou ensaios clínicos - com novos medicamentos
I, II E III no Brasil, primeiramente são necessárias aprovações regulatórias, tanto éticas como sani-
FASE IV tárias. E todos os ensaios clínicos devem ser conduzidos de acordo com as Boas Práticas
PESQUISA
Clínicas. Ensaios Clínicos Fase II:
ANVISA ANVISA ANVISA
CLÍNICA Ensaios clínicos são os estudos do novo medicamento realizados em seres humanos.
II
Objetivos:
Basicamente é composto de quatro fases: Fase I, II, III e IV. •Iniciar as determinações de eficácia e segurança em pacientes - seleção de dose/intervalo.
Para um medicamento ingressar no mercado, ele precisa ser autorizado pela Anvisa. O processo começa com a apresentação de
• Estabelecer dados de ADME (absorção/distribuição/metabolismo/ excreção) para subsidiar estudos de
um pedido de registro feito por uma empresa . A partir daí, a Anvisa vai analisar os estudos apresentados para decidir se o produto fase III.
pode estar no mercado, pois o pedido de registo nem sempre é feito pelo produtor do medicamento, pode ser uma outra empresa.
Notas: Participantes:
Dessa forma, se um medicamento não está no mercado brasileiro, isto acontece devido a uma das quatro situaçãoes abaixo: • Normalmente pacientes apenas com doença/condição pesquisada.
a) Os estudos epidemiológicos observacionais não necessitam de autorização emitida pela Anvisa, mas necessitam de • Em estudos fase II tardios, os pacientes podem ter doenças/terapias concomitantes.
aprovação ética.
A empresa solicitante do registro não comprovou qualidade, eficácia e segurança e,
por isso, o pedido foi indeferido.
b) : Caso um medicamento e/ou especialidade medicinal tenham sido comercializados, mas necessitem demonstrar sua Ensaios Clínicos Fase III:
segurança e eficácia, ou explorar novas indicações, novos métodos de administração ou novas combinações
2 (associações), é necessária a condução de ensaios clínicos controlados de fase III. • Grandes Estudos Controlados com Pacientes portadores da doença pesquisada.
Nenhum pedido de registro foi apresentado à Anvisa. • Significativos endpoints clínicos.
Características:
3 A substância faz parte de uma lista de produtos banidos por falta de segurança ou proibição legal
(exemplos: anfetamínicos, LSD etc.).
Após a Pesquisa Clínica, vem o pedido de registro do medicamento na Anvisa. Que é o
trabalho de análise da Anvisa para avaliar a a qualidade, segurança e eficácia do medica-
• Geralmente são estudos multicêntricos envolvendo centenas de pacientes.
• Rigorosos critérios de exclusão e inclusão.
• Estudos controlados - Placebo e/ou medicamento ativo.
mento. • Estudo Adequado e Controlado.
4 O medicamento ainda está em análise na Anvisa.
No caso de medicamentos genéricos ou similares, o trabalho começa aqui, pois não se
trata de um medicamento inovador. Uma das principais exigências para o registro de medi-
• Objetivos bem definidos.
• Informações claras sobre os métodos de análise.
• Descrição precisa do desenho do estudo.
REGISTRO camentos genéricos e similares são os estudos de bioequivalência e equivalência farma- - Controles Validados.
Algumas regras:
III
- Duração do Tratamento.
cêutica que vão demonstrar se o efeito do produto é igual ao medicamento de referência.
- Cálculos do Tamanho da Amostra.
O registro de medicamento vale por cinco anos e deve ser renovado na Anvisa durante este período. - Critérios adequados de exclusão e inclusão.
Para todos os laboratórios são exigidos a Autorização de Funcionamento da Anvisa e o - Marcadores de eficácia e segurança apropriados e bem definidos
Certificado de Boas Práticas de Fabricação. Isso implica na realização de inspeções nos
laboratórios, seja no Brasil ou exterior. Estudos complementares
Dados de farmacovigilância podem justificar a revisão do perfil de segurança de um medicamento e levar a mudanças em sua indicação ou
até mesmo sua retirada do mercado (é uma atividade dinâmica relacionada ao conhecimento científico). A partir da concessão do registro, o produto pode ser colocado no mercado. Com populações especiais:
• Insuficiência Renal.
O monitoramento de qualidade feito pelos produtores e pelo sistema de vigilância pode levar ao recolhimento de lotes específicos que tenham • Insuficiência Hepática.
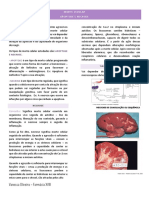
algum desvio de qualidade. Exemplo: produto com cor diferente do normal. • Idosos x Jovens.
Com o registro em mãos, o laboratório pode colocar o medicamento no mercado. Das interações:
• Com alimentos ou líquidos.
Fase Pré-clínica Como no Brasil temos regulação de preço de medicamentos, o produto precisa ter seu
• Com drogas para a mesma indicação.
• Com drogas que interferem com o metabolismo ou excreção.
Desenvolvimento pré-clínico ou não-clínico PÓS - preço máximo aprovado pela Câmara de Regulação do Mercado de Medicamentos • Com drogas que se ligam às proteínas do plasma.
MERCADO (CMED). A CMED é uma câmara interministerial cuja trabalho executivo é realizado pela • Com drogas que modificam propriedades farmacodinâmicas.
Esses ensaios devem ser realizados para se conhecer o mecanismo de ação de uma nova molécula, determinar sua segurança Anvisa. Em condições especiais:
e as doses seguras para o início dos testes em seres humanos. • Alteração em estado de alerta e concentração.
Nesta fase entram todos os entes da cadeia produtiva: fornecedor de matéria-prima / labo- • Testes Psicológicos e Psicométrico.
Os dados de segurança pré-clínicos podem ser obtidos das seguintes maneiras: ratório produtor / transportador / distribuidor / armazenagem / varejo. Para cada uma • Retirada abrupta da droga .
dessas instâncias há regras específicas voltadas para manutenção da qualidade do produ-
Ensaios Clínicos Fase IV:
tos. Todos os entes precisam estar regularizados, seja junto à Anvisa ou à vigilância sanitá-
Modelos In-silico (simulação computacional); ria local. Exemplo: a farmácia tem que ter autorização da Anvisa e alvará sanitário emitido
localmente. São pesquisas realizadas depois de comercializado o produto e/ou especialidade medicinal.
/
IV
Sistemas In-vitro (cultura de células); Farmacovigilância Estas pesquisas são executadas com base nas características com que foi autorizado o medicamento e/ou
especialidade medicinal. Geralmente, são estudos de vigilância pós-comercialização, para estabelecer o
valor terapêutico, o surgimento de novas reações adversas e/ou confirmação da frequência de surgimen-
to das já conhecidas, e as estratégias de tratamento.
Ensaios Ex-vivo (e.g. isolamento de um órgão);
H Ministério da
Nas pesquisas de fase IV devem-se seguir as mesmas normas éticas e científicas aplicadas às pesquisas de
fases anteriores.
Saúde
Modelos animais apropriados.
Você também pode gostar
- Farmacologia - Prova 1 Atm 28 (1)Documento28 páginasFarmacologia - Prova 1 Atm 28 (1)carolbissaniAinda não há avaliações
- Farmacognosia Prova AV1Documento6 páginasFarmacognosia Prova AV1Patrick CorreaAinda não há avaliações
- Relatorio Medicamentos-AbrelpeDocumento14 páginasRelatorio Medicamentos-AbrelpeTainá AlvesAinda não há avaliações
- Quimica FarmaciaDocumento8 páginasQuimica FarmaciaJosefinaAinda não há avaliações
- 5 Tutoria CCRDocumento3 páginas5 Tutoria CCRMoniz EugenioAinda não há avaliações
- Resultado Beta HCG superior a 25 mUI/mlDocumento1 páginaResultado Beta HCG superior a 25 mUI/mlGeovana CarvalhoAinda não há avaliações
- AV1 - Farmácia Hospitalar e Clínica 2019.2 Itaquá ALUNOSDocumento5 páginasAV1 - Farmácia Hospitalar e Clínica 2019.2 Itaquá ALUNOSPatrick CorreaAinda não há avaliações
- Curso Farmácia com 9 semestres e 4000h de carga horáriaDocumento1 páginaCurso Farmácia com 9 semestres e 4000h de carga horáriaBruna LopesAinda não há avaliações
- TepDocumento10 páginasTepEwerton Soares FeitosaAinda não há avaliações
- 1407-Texto Do Artigo-6147-1-10-20161013Documento8 páginas1407-Texto Do Artigo-6147-1-10-20161013joyce.andrade0703Ainda não há avaliações
- Bula Paciente PercofDocumento1 páginaBula Paciente PercofHericaAinda não há avaliações
- Resumos de AidpiDocumento11 páginasResumos de AidpiCRECHE ESCOLA VIVER BEM DE PIRAJÁAinda não há avaliações
- AULA 1 Introdução A FarmacologiaDocumento16 páginasAULA 1 Introdução A FarmacologiaDiego FrankleyAinda não há avaliações
- Plano de Contingencia Nacional para Monkeypox - 1 EdDocumento31 páginasPlano de Contingencia Nacional para Monkeypox - 1 EdRebeca BorgesAinda não há avaliações
- Avaliação Nutricional Aplicada: O Que Compõe?Documento6 páginasAvaliação Nutricional Aplicada: O Que Compõe?Vanessa PachecoAinda não há avaliações
- Normas para o Laboratorio Clinico 3a Edicao Nlc2015 14176588915ab15cee05539Documento20 páginasNormas para o Laboratorio Clinico 3a Edicao Nlc2015 14176588915ab15cee05539Mafalda TeixeiraAinda não há avaliações
- Ensaios ClínicosDocumento4 páginasEnsaios ClínicosJoao MartinsAinda não há avaliações
- Resumao de Enfermagem para EstagiosDocumento181 páginasResumao de Enfermagem para EstagiosNaanahnadyneAinda não há avaliações
- Pcmso - São MatheusDocumento3 páginasPcmso - São MatheusRivaldo Nóbrega JuniorAinda não há avaliações
- Matriz para PES 2021 01 - MCDocumento13 páginasMatriz para PES 2021 01 - MCAlexandre MulhangaAinda não há avaliações
- Anexo 08 - PCMSODocumento5 páginasAnexo 08 - PCMSOmarocAinda não há avaliações
- RG-SEG-KLA-22.01 - Cadastro de Produtos Químicos REV TRIADD 00Documento1 páginaRG-SEG-KLA-22.01 - Cadastro de Produtos Químicos REV TRIADD 00Bernardi Revestimentos e Pintura IndustrialAinda não há avaliações
- Aula2 ClassificaçãodasformasfarmacêuticasDocumento39 páginasAula2 ClassificaçãodasformasfarmacêuticasBruno UgolineAinda não há avaliações
- Coleta de Dados em Enfermagem: Sistematização Da Assistência de Enfermagem ObjetivosDocumento9 páginasColeta de Dados em Enfermagem: Sistematização Da Assistência de Enfermagem ObjetivoscamilinhaaldighieriAinda não há avaliações
- Paulo Arnaldo Copy of Matriz para PES 2021 01 - PADocumento19 páginasPaulo Arnaldo Copy of Matriz para PES 2021 01 - PAAlexandre MulhangaAinda não há avaliações
- Curso Auxiliar e Técnico em EnfermagemDocumento1 páginaCurso Auxiliar e Técnico em EnfermagemLuana LindaAinda não há avaliações
- III TeoricoDocumento30 páginasIII TeoricoAline VasconcelosAinda não há avaliações
- Cit+II CBL+15+16 CG+normalDocumento10 páginasCit+II CBL+15+16 CG+normalRosa PereiraAinda não há avaliações
- Produção de MedicamentosDocumento28 páginasProdução de MedicamentosEmanuel LucenaAinda não há avaliações
- Prontuário odontológico completoDocumento3 páginasProntuário odontológico completoMichelle Sant'AnnaAinda não há avaliações
- Atestado de Saúde Ocupacional para InstaladorDocumento1 páginaAtestado de Saúde Ocupacional para InstaladorAndy Silva RMAinda não há avaliações
- Rev Ijibd 1 2014-4Documento62 páginasRev Ijibd 1 2014-4dzivahAinda não há avaliações
- RPNR1368 04Documento2 páginasRPNR1368 04Gilvan JuniorAinda não há avaliações
- 311AN - Matriz Medicina VeterináriaDocumento1 página311AN - Matriz Medicina VeterináriaSukitaCraftAinda não há avaliações
- AULA 5 Principais Operações UnitáriasDocumento17 páginasAULA 5 Principais Operações UnitáriasTaís CarvalhoAinda não há avaliações
- Tutoria 1-1Documento1 páginaTutoria 1-1tusbeifnfoyshejdjrAinda não há avaliações
- Classe de MedicamentosDocumento14 páginasClasse de MedicamentosAna Karinna BastosAinda não há avaliações
- Responsabilidade Civil por Pesquisas ClínicasDocumento425 páginasResponsabilidade Civil por Pesquisas ClínicasLuiz AndersonAinda não há avaliações
- Farmacoepidemiologia: Estudo do uso e efeitos de medicamentosDocumento40 páginasFarmacoepidemiologia: Estudo do uso e efeitos de medicamentosrozateodosio_1798291Ainda não há avaliações
- Icc Resumo EscritoDocumento2 páginasIcc Resumo EscritoIngryd Capuci MeloAinda não há avaliações
- Trabalho de EstágioDocumento3 páginasTrabalho de EstágioJuliana Vilhena Evangelista da CostaAinda não há avaliações
- Regulamentação Dos Medicamentos em Portugal: - ObjetivosDocumento16 páginasRegulamentação Dos Medicamentos em Portugal: - ObjetivosJuliana TorresAinda não há avaliações
- PanfletoDocumento2 páginasPanfletoa_p_azzevedoAinda não há avaliações
- Análise de riscos ambientais na UTGCADocumento36 páginasAnálise de riscos ambientais na UTGCAWilson PradoAinda não há avaliações
- Avaliação clínica e aprovação regulatória de fármacosDocumento10 páginasAvaliação clínica e aprovação regulatória de fármacosNádiaeFlávio Souza CostaAinda não há avaliações
- Elaboracao de Relatorio em Casos DificeisDocumento26 páginasElaboracao de Relatorio em Casos DificeisLetícia Maria Martins Vasconcelos ParreiraAinda não há avaliações
- Avaliação e Reabilitação de Membros SuperioresDocumento17 páginasAvaliação e Reabilitação de Membros SuperioresFelipe PaivaAinda não há avaliações
- Farmacovigilância detecta RAMDocumento86 páginasFarmacovigilância detecta RAMJéssica StadnikiAinda não há avaliações
- Simulado Enem Primeiro DiaDocumento32 páginasSimulado Enem Primeiro Diajaqueline ramosAinda não há avaliações
- LaudoDocumento1 páginaLaudoBrinquelibrasAinda não há avaliações
- Slide de Aula - Atenção FarmacêuticaDocumento86 páginasSlide de Aula - Atenção FarmacêuticaSusana Carvalho100% (2)
- Relatorio Preliminar de Analise Qualitativa FGV Alcool e Outras Drogas 2010Documento138 páginasRelatorio Preliminar de Analise Qualitativa FGV Alcool e Outras Drogas 2010CaioSigmundAinda não há avaliações
- Pcmso e Exames ModeloDocumento51 páginasPcmso e Exames ModeloGMAX Serviços e ConsultoriaAinda não há avaliações
- Farmacoterapia: Conceitos e AplicaçõesDocumento17 páginasFarmacoterapia: Conceitos e AplicaçõesSilvana Borges100% (1)
- Breno Luis Nery Garcia CorrigidaDocumento75 páginasBreno Luis Nery Garcia CorrigidaThaís LirioAinda não há avaliações
- Plano de cuidados individual para cliente de 86 anosDocumento6 páginasPlano de cuidados individual para cliente de 86 anosSandra MartinsAinda não há avaliações
- Monitoramento ambiental para controle de perigos biológicos e contaminaçõesDocumento5 páginasMonitoramento ambiental para controle de perigos biológicos e contaminaçõesLuana NunesAinda não há avaliações
- Curso de Física - Ênfase em Física MédicaDocumento1 páginaCurso de Física - Ênfase em Física MédicaFelícia MouutinhoAinda não há avaliações
- Manual Estágio Farmácia UNIPDocumento30 páginasManual Estágio Farmácia UNIPAna CamilaAinda não há avaliações
- Instalações FarmacêuticasDocumento2 páginasInstalações FarmacêuticasVanessa OliveiraAinda não há avaliações
- Lauda ParasitologicoDocumento2 páginasLauda ParasitologicoVanessa OliveiraAinda não há avaliações
- Pesquisa, Desenvolvimento e Registro de Medicamentos - AULA 1Documento5 páginasPesquisa, Desenvolvimento e Registro de Medicamentos - AULA 1Vanessa OliveiraAinda não há avaliações
- Panorama Da Indústria FarmacêuticaDocumento2 páginasPanorama Da Indústria FarmacêuticaVanessa OliveiraAinda não há avaliações
- Tratamento Da Amebiase TraduçãoDocumento14 páginasTratamento Da Amebiase TraduçãoVanessa OliveiraAinda não há avaliações
- Protozoários médicosDocumento3 páginasProtozoários médicosVanessa OliveiraAinda não há avaliações
- Estudo Dirigido - Pesquisa de SG, Gordura Nas Fezes, Colorações e ArtefatosDocumento3 páginasEstudo Dirigido - Pesquisa de SG, Gordura Nas Fezes, Colorações e ArtefatosVanessa OliveiraAinda não há avaliações
- Caso clínico amebíaseDocumento2 páginasCaso clínico amebíaseVanessa OliveiraAinda não há avaliações
- Introdução, CQ IFA, Validação e EstabilidadeDocumento6 páginasIntrodução, CQ IFA, Validação e EstabilidadeVanessa OliveiraAinda não há avaliações
- Analgésico FarmacoloigiaDocumento1 páginaAnalgésico FarmacoloigiaVanessa OliveiraAinda não há avaliações
- Método de Ritchie para exames parasitológicosDocumento3 páginasMétodo de Ritchie para exames parasitológicosVanessa OliveiraAinda não há avaliações
- Atlas Parasito Clínica FinalizadoDocumento7 páginasAtlas Parasito Clínica FinalizadoVanessa OliveiraAinda não há avaliações
- Conceitos IniciaisDocumento2 páginasConceitos IniciaisVanessa OliveiraAinda não há avaliações
- Analgésico FarmacoloigiaDocumento1 páginaAnalgésico FarmacoloigiaVanessa OliveiraAinda não há avaliações
- Conceitos Iniciais HematologiaDocumento2 páginasConceitos Iniciais HematologiaVanessa OliveiraAinda não há avaliações
- Métodos de ExtraçãoDocumento1 páginaMétodos de ExtraçãoVanessa OliveiraAinda não há avaliações
- Ansiolíticos, hipnóticos, sedativos e anticonvulsivantesDocumento2 páginasAnsiolíticos, hipnóticos, sedativos e anticonvulsivantesVanessa OliveiraAinda não há avaliações
- HematopoeseDocumento4 páginasHematopoeseCarlosGomesAPAinda não há avaliações
- Anemia SDocumento6 páginasAnemia SarleyejamanaAinda não há avaliações
- Tipos de necrose celularDocumento9 páginasTipos de necrose celularVanessa OliveiraAinda não há avaliações
- EsteatoseDocumento2 páginasEsteatoseVanessa OliveiraAinda não há avaliações
- Introdução A PatologiaDocumento3 páginasIntrodução A PatologiaVanessa Oliveira100% (1)
- Distúrbios Do Crescimento - Câncer - Docx1Documento5 páginasDistúrbios Do Crescimento - Câncer - Docx1Vanessa OliveiraAinda não há avaliações
- LipidosesDocumento1 páginaLipidosesVanessa OliveiraAinda não há avaliações
- Banda Sinfônica de Catanduva propõe apresentações musicaisDocumento4 páginasBanda Sinfônica de Catanduva propõe apresentações musicaisGuilherme MoreiraAinda não há avaliações
- Gestão de Biblioteca e Sistema de Tickets no ITCDocumento24 páginasGestão de Biblioteca e Sistema de Tickets no ITCLuis Nhantumbo0% (2)
- Jornal Ed 4579-1Documento12 páginasJornal Ed 4579-1Eriston XavierAinda não há avaliações
- Pop - Aqt90 FlexDocumento10 páginasPop - Aqt90 FlexHeronHoltzAinda não há avaliações
- Estabilidade muro cais gravíticoDocumento4 páginasEstabilidade muro cais gravíticoFabrício GalvãoAinda não há avaliações
- Dumping Ambiental - Alternativas para Paises Do SulDocumento4 páginasDumping Ambiental - Alternativas para Paises Do SulAmade C NacirAinda não há avaliações
- Revista da Propriedade Industrial no 1831Documento545 páginasRevista da Propriedade Industrial no 1831hk_scribdAinda não há avaliações
- Cosmetologia Avaliacao e Acao Docente PDFDocumento192 páginasCosmetologia Avaliacao e Acao Docente PDFcrisAinda não há avaliações
- Plano de TrabalhoDocumento8 páginasPlano de TrabalhoKellyson OliveiraAinda não há avaliações
- Baixar e compartilhar arquivos pela internetDocumento3 páginasBaixar e compartilhar arquivos pela internetvpadillaAinda não há avaliações
- Manuais de InstalacaoDocumento33 páginasManuais de Instalacaojefferson luizAinda não há avaliações
- Os 10 Mandamentos de Marketing para Engenheiros e Arquitetos - E-CivilDocumento3 páginasOs 10 Mandamentos de Marketing para Engenheiros e Arquitetos - E-CivilPaulo Emyllio StivalAinda não há avaliações
- Ficha de segurança para isca formicidaDocumento7 páginasFicha de segurança para isca formicidaErnesto Seiji SakaiAinda não há avaliações
- Análisis de la novela india de finales del siglo XXDocumento707 páginasAnálisis de la novela india de finales del siglo XXRumman Ul Ahsan100% (1)
- Gestão de PessoasDocumento7 páginasGestão de PessoasJoão100% (1)
- Guia de Sustentabilidade Das Construcoes Fiemg 2008Documento62 páginasGuia de Sustentabilidade Das Construcoes Fiemg 2008Ro_luchoAinda não há avaliações
- Do 18032013Documento13 páginasDo 18032013BACK UP do DIARIO OFICIAL DE CAMPOS DOS GOYTACAZESAinda não há avaliações
- Tags 001Documento61 páginasTags 001ednamariaalvesdossantos7Ainda não há avaliações
- Instalação e uso de sistema de controle inteligente para carroDocumento6 páginasInstalação e uso de sistema de controle inteligente para carroJessé JungerAinda não há avaliações
- Formação em liderança e gestão de pessoasDocumento28 páginasFormação em liderança e gestão de pessoasLeonardo CraveiroAinda não há avaliações
- Transporte de Material Radioativo - Norma CNEN NEDocumento40 páginasTransporte de Material Radioativo - Norma CNEN NEericsonricardo0% (2)
- Manual de boas práticas exploração florestalDocumento59 páginasManual de boas práticas exploração florestalDaniela Fraga100% (1)
- Antônio Domingos Dos Santos Júnior TCC1 Atv2Documento15 páginasAntônio Domingos Dos Santos Júnior TCC1 Atv2Cainã CarvalhoAinda não há avaliações
- Enriquecimento sem causa em Fernando NoronhaDocumento22 páginasEnriquecimento sem causa em Fernando Noronhaenunes1987Ainda não há avaliações
- Apostila de Estudo MATRIZ - CB - 2013Documento133 páginasApostila de Estudo MATRIZ - CB - 2013Karliele SouzaAinda não há avaliações
- Exemplo de TCCDocumento36 páginasExemplo de TCCRafaela AlvesAinda não há avaliações
- 2019 - Contabilidade de Custos Custeio ABC - Grupo PDFDocumento12 páginas2019 - Contabilidade de Custos Custeio ABC - Grupo PDFAlvaro RodriguesAinda não há avaliações
- A capacidade empreendedora para o plano de inovaçãoDocumento34 páginasA capacidade empreendedora para o plano de inovaçãoriqueabreu_daniAinda não há avaliações
- Censo Empresarial de ItacoatiaraDocumento226 páginasCenso Empresarial de ItacoatiaracovildeloboAinda não há avaliações
- Google Docs: tutorial completoDocumento29 páginasGoogle Docs: tutorial completoRoseAinda não há avaliações