Escolar Documentos
Profissional Documentos
Cultura Documentos
Redação Sobre o Sistema Complemento
Enviado por
Victor Jhonata0 notas0% acharam este documento útil (0 voto)
10 visualizações3 páginasTítulo original
Redação sobre o Sistema Complemento
Direitos autorais
© © All Rights Reserved
Formatos disponíveis
PDF, TXT ou leia online no Scribd
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
0 notas0% acharam este documento útil (0 voto)
10 visualizações3 páginasRedação Sobre o Sistema Complemento
Enviado por
Victor JhonataDireitos autorais:
© All Rights Reserved
Formatos disponíveis
Baixe no formato PDF, TXT ou leia online no Scribd
Você está na página 1de 3
Trabalho sobre o Sistema Complemento
Discente: Victor Jhonata Costa Sousa
Docente: Sérgio Ricardo Stuckert Seixas
Disciplina: Imunologia
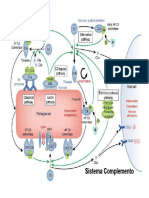
Sistema Complemento
O sistema complemento é um dos mais importantes mecanismos
que atuam para que o reconhecimento de patógenos seja convertido em
uma resposta imune efetiva contra uma possível infecção. É constituído
por uma cascata enzimática que auxilia na defesa, sendo essa a razão
do nome “complemento”. Esse sistema é formado tanto por proteínas
solúveis no plasma quanto por proteínas expressas na membrana
celular.
Entre as funções do sistema complemento, encontram-se:
fagocitose, opsonização, quimiotaxia de leucócitos, liberação de
histamina dos mastócitos e basófilos e de espécies ativas de oxigênio
pelos leucócitos, vasoconstrição, contração da musculatura lisa,
aumento da permeabilidade dos vasos, agregação plaquetária e citólise.
Existem três vias de ativação possíveis para o sistema
complemento: a via clássica, a via alternativa e a via da lectina. As três
vias diferem na forma de iniciação, porém se assemelham nas etapas
finais, visto que todas culminam no complexo de ataque à membrana
(MAC), a fase terminal do sistema.
Os componentes da via clássica
costumam ser rotulados com um C e um
número (p. ex., C1, C3), com base na
ordem em que essas proteínas foram
identificadas. Já na via alternativa, os
componentes são geralmente
classificados por letras (p. ex., fator B,
fator D) ou por nome (p. ex., properdina).
A via de ativação clássica possui um importante papel tanto na
imunidade inata quanto na adaptativa e sua ativação ocorre
principalmente por complexos antígeno-anticorpo. Inicia-se pelo
complexo C1, que se liga através da porção C1q à fração Fc de uma
imunoglobulina já ligada a um antígeno. C1 então passa a clivar C4 e
C2, formando C4b e C2a, que formam a C3 convertase (C4bC2a),
responsável pela clivagem de C3. Ao clivar C3, é formado C3a e C3b, e
este segundo se liga à C3 convertase, formando a C5 convertase
(C4bC2aC3b), que, por sua vez, cliva C5 em C5a e C5b, ativando a
fase terminal do sistema complemento.
C3 não é clivado apenas no processo iniciado por C1, sendo
clivado em pequena escala o tempo inteiro na nossa corrente
sanguínea. Assim, a via alternativa é ativada em pouca intensidade na
fase fluida continuamente. A ativação é intensificada na presença de um
ativador exógeno. C3b (depositada na superfície de partículas
ativadoras da via alternativa) possui um sítio de ligação para fator B,
que se liga a este sítio na presença de Mg. Fator D cliva o fator B,
formando Ba e Bb. Bb permanece ligado a C3b, formando C3bBb que,
estabilizado pela properdina, passa a atuar como C3 covertase, que
catalisa a clivagem de novos C3 em C3a e C3b. C3b pode ser
depositado sobre o microrganismo ou se ligar à C3 convertase,
formando C3bCBb(C3b), que é a C5 convertase da via alternativa.
Os fragmentos C3a, formados nas vias clássica e alternativa,
atuam como anafilotoxinas após serem liberados na corrente
sanguínea, e estimulam o processo inflamatório através da ativação de
fagócitos.
Com a descoberta de que lectinas circulantes podem ligar-se a
resíduos de manose de polissacarídeos microbianos, é caracterizada a
terceira via de ativação do sistema complemento, a via das lectinas. As
lectinas ligadoras de manose (MBL), se assemelham muito à estrutura
tridimensional de C1q. As MBLs se ligam a semiproteases (MASP). As
MASP1 e MASP2 são as responsáveis por clivar as proteínas do
complemento nesta via. Com a formação do complexo MBL-MASP, C4 e
C2 sofrem clivagem. C4b e C2a fixam-se à membrana enquanto os
outros fragmentos são liberados. Assim se forma a C3 convertase
(C4bC2a) na via das lectinas. C3 então é clivada, e C3b se liga ao
complexo, gerando a C5 convertase (C4bC2aC3b).
Em todas as vias é a C5 convertase a responsável pela ativação
da fase terminal do sistema complemento. Com a clivagem de C5, o
fragmento C5b se associa às proteínas C6 e C7, formando o complexo
C5bC6C7. O componente C7 é altamente hidrofóbico, e se insere na
bicamada lipídica da membrana, fixando nela o complexo. C7 também
possui grande afinidade com C8, e sua ligação ao complexo forma
C5bC6C7 (C5b-8). Após isso, proteínas C9 passam a se ligar à parte
C5b-8, resultando no complexo de ataque à membrana (MAC), que
forma um poro na mesma. Isso permite a livre entrada de íons e água,
causando desequilíbrio e resultando na ruptura da célula ou
microorganismo.
Para evitar uma ativação excessiva do SC, são necessários
mecanismos inibitórios, pois esse excesso de ativação resultaria na
formação de MAC em tecidos próprios, formando mediadores
inflamatórios em excesso. Exemplos de moléculas reguladoras são o
fator acelerador da dissociação (DAF), que remove C2a da C3
convertase, e a esterase inibidora de C1 (C1-INH), que impede C1 de
se ligar ao complexo antígeno-anticorpo. Quando o controle sobre o
sistema complemento é quebrado, condições patológicas podem ser
geradas, a exemplo do Angioedema Hereditário (AEH) e da Síndrome
Urêmica Hemolítica Atípica (SHUa).
Portanto, o sistema complemento é essencial para uma resposta
imune eficaz, porém a manutenção de seu equilíbrio é de suma
importância para se evitar a patogênese de algumas doenças.
Você também pode gostar
- Sistema complemento: ativação e funçõesDocumento6 páginasSistema complemento: ativação e funçõesNathalia PompeuAinda não há avaliações
- Sistema Complemento: Vias de AtivaçãoDocumento3 páginasSistema Complemento: Vias de AtivaçãoNataly ToribioAinda não há avaliações
- quiz 4Documento2 páginasquiz 4saudeitapolisAinda não há avaliações
- Sistema ComplementoDocumento21 páginasSistema Complementonoobizinhon2Ainda não há avaliações
- T2 - Sistema Complemento FmupDocumento11 páginasT2 - Sistema Complemento FmupInes RochaAinda não há avaliações
- SistemaComplementoeMHCnaapresentaodeantgenosUniritter20241_20240317204514Documento47 páginasSistemaComplementoeMHCnaapresentaodeantgenosUniritter20241_20240317204514p955kbfbhmAinda não há avaliações
- Sistema Complemento: Cascata e Vias de AtivaçãoDocumento6 páginasSistema Complemento: Cascata e Vias de AtivaçãoOtávio GomesAinda não há avaliações
- Disturbios UrinariosDocumento14 páginasDisturbios UrinariosVanessa MoraesAinda não há avaliações
- Sistema Complemento: Características e FunçõesDocumento32 páginasSistema Complemento: Características e FunçõesJosé Júnior AguiarAinda não há avaliações
- Sistema do complemento: funções e vias de ativaçãoDocumento6 páginasSistema do complemento: funções e vias de ativaçãoJaqueline Gomes Dos SantosAinda não há avaliações
- Plemento e Deficiências Congênitas e AdquiridasDocumento3 páginasPlemento e Deficiências Congênitas e Adquiridascaroline.meed02Ainda não há avaliações
- Aula 5 - ImunoDocumento44 páginasAula 5 - ImunoReinaldo RiquetAinda não há avaliações
- T01 - SistemaComplemento - AnaluFilgueiraDocumento1 páginaT01 - SistemaComplemento - AnaluFilgueiraAnalu FilgueiraAinda não há avaliações
- Sistema Complemento e suas vias de ativaçãoDocumento16 páginasSistema Complemento e suas vias de ativaçãoNaara MatosAinda não há avaliações
- Sistema complemento funções viasDocumento3 páginasSistema complemento funções viasAnna Beatriz Da SilvaAinda não há avaliações
- Sistema complemento - Funções e vias de ativaçãoDocumento11 páginasSistema complemento - Funções e vias de ativaçãoGerson Coelho VianaAinda não há avaliações
- Sistema ComplementoDocumento15 páginasSistema ComplementoBruno VitaliAinda não há avaliações
- Aula 6 Imuno Sistema ComplementoDocumento9 páginasAula 6 Imuno Sistema Complementolourdes rozendoAinda não há avaliações
- Sistema ComplementoDocumento40 páginasSistema ComplementoMillena CoelhoAinda não há avaliações
- 6 - Resumo Sistema ComplementoDocumento1 página6 - Resumo Sistema ComplementoImunoResumo100% (5)
- Sistema complemento e imunidadeDocumento4 páginasSistema complemento e imunidadeTulio QuetoAinda não há avaliações
- Sistema Complemento - Via AlternativaDocumento3 páginasSistema Complemento - Via AlternativaNicoly LesAinda não há avaliações
- Sistema complemento descoberto em 1919Documento1 páginaSistema complemento descoberto em 1919Julia Lopes MouraAinda não há avaliações
- Sistema ComplementoDocumento1 páginaSistema ComplementolaisavgarbachevskiAinda não há avaliações
- Ativação, regulação e deficiências do sistema complementoDocumento11 páginasAtivação, regulação e deficiências do sistema complementoRodrigo Werner ToccoliAinda não há avaliações
- 5IMUNOLOGIA Oral 2022 - Parte 5 ComplementoDocumento41 páginas5IMUNOLOGIA Oral 2022 - Parte 5 ComplementoMarianaAinda não há avaliações
- Sistema ComplementoDocumento6 páginasSistema ComplementoCamille Moura100% (1)
- Sistema ComplementoDocumento35 páginasSistema ComplementoVivian MarthosAinda não há avaliações
- Testes Do Complemento: Imunologia OralDocumento40 páginasTestes Do Complemento: Imunologia OralMarianaAinda não há avaliações
- Estudo Dirigido de ImunologiaDocumento6 páginasEstudo Dirigido de ImunologiaMárcio JorqueraAinda não há avaliações
- Sistema Complemento: Vias Clássica, Lectina e AlternativaDocumento1 páginaSistema Complemento: Vias Clássica, Lectina e AlternativaNatália FerreiraAinda não há avaliações
- Sistema complemento principal defesa inataDocumento23 páginasSistema complemento principal defesa inataThayseVazAinda não há avaliações
- APx1 2022-1 Imunologia - GABARITO Alunos (2) - 220619 - 120017Documento2 páginasAPx1 2022-1 Imunologia - GABARITO Alunos (2) - 220619 - 120017Monica BarbosaAinda não há avaliações
- Sistema ComplementoDocumento5 páginasSistema ComplementoThais OliveiraAinda não há avaliações
- Lista Exercícios Prova 3 Bio 111 UfvDocumento5 páginasLista Exercícios Prova 3 Bio 111 UfvigorAinda não há avaliações
- Sistema ComplementoDocumento19 páginasSistema ComplementoJanaína Andrade100% (1)
- 4 Sistema ComplementoDocumento27 páginas4 Sistema ComplementoRogério ValverdeAinda não há avaliações
- Sistema Complemento: descoberta e funções principaisDocumento56 páginasSistema Complemento: descoberta e funções principaisAnderson da Silva MoreiraAinda não há avaliações
- A Via Alternativa de AtivaçãoDocumento1 páginaA Via Alternativa de AtivaçãothayanaAinda não há avaliações
- Aula Complemento 03-04-2012Documento16 páginasAula Complemento 03-04-2012Lara Goulart SayeggAinda não há avaliações
- Aula #3Documento22 páginasAula #3José Gomes PedrosaAinda não há avaliações
- Sistema ComplementoDocumento3 páginasSistema ComplementoAna Júlia Trierweiler VieiraAinda não há avaliações
- Exercício - MHC e Maturação MyllanaDocumento6 páginasExercício - MHC e Maturação MyllanamyllanaAinda não há avaliações
- Regulação ComplementoDocumento2 páginasRegulação ComplementoFernando JuniorAinda não há avaliações
- Sistema Complemento: A Imunidade Inata e suas FunçõesDocumento35 páginasSistema Complemento: A Imunidade Inata e suas FunçõesKethelin FariaAinda não há avaliações
- Reguladores do ciclo celular: ciclinas, Cdks e APC/CDocumento6 páginasReguladores do ciclo celular: ciclinas, Cdks e APC/CTúlio HenriqueAinda não há avaliações
- Estudo ImunologiaDocumento6 páginasEstudo ImunologiaJanaina NevesAinda não há avaliações
- Imunidade Mediada Por Células B e AnticorposDocumento4 páginasImunidade Mediada Por Células B e Anticorpospires.luis0212Ainda não há avaliações
- Patron Ciclo CelularDocumento10 páginasPatron Ciclo Celularlobo2011Ainda não há avaliações
- PlementotDocumento29 páginasPlementotmatheus.f.costaAinda não há avaliações
- Proteina CDocumento9 páginasProteina CFernandoAinda não há avaliações
- Ciclo celular - Fases e regulaçãoDocumento8 páginasCiclo celular - Fases e regulaçãojoanaAinda não há avaliações
- Ciclo Celular e ApoptoseDocumento6 páginasCiclo Celular e ApoptoseAna CristinaAinda não há avaliações
- Processo de maturação dos linfócitos B e TDocumento3 páginasProcesso de maturação dos linfócitos B e TJúlio CésarAinda não há avaliações
- P3 Citologia Mais DetalhadaDocumento9 páginasP3 Citologia Mais DetalhadaBell MendesAinda não há avaliações
- PlaquetasDocumento24 páginasPlaquetasmarrisimoesAinda não há avaliações
- Plaquetas: estrutura, função e formação do tromboDocumento9 páginasPlaquetas: estrutura, função e formação do tromboGeorge LucasAinda não há avaliações
- Ficha de Preparacao para o Teste Relativo Aos Seguintes Conteudos Mitose Meiose Reproducao Assexuada Reproducao Sexuada e Evolucao BiologicaDocumento13 páginasFicha de Preparacao para o Teste Relativo Aos Seguintes Conteudos Mitose Meiose Reproducao Assexuada Reproducao Sexuada e Evolucao BiologicaTatiana MirandaAinda não há avaliações
- Prolactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoNo EverandProlactina e Diabetes Melito do tipo 2: o efeito protetor de um hormônio sobre o metabolismo glicídicoAinda não há avaliações
- Técnicas Terapêuticas Da Hidroterapia Aplicadas Na Reabilitação de Pacientes Com ARJDocumento6 páginasTécnicas Terapêuticas Da Hidroterapia Aplicadas Na Reabilitação de Pacientes Com ARJDavi Mendonça da CostaAinda não há avaliações
- PSICOPATOLOGIADocumento39 páginasPSICOPATOLOGIALeti MouraAinda não há avaliações
- Aula 1-Saúde Da CriançaDocumento21 páginasAula 1-Saúde Da CriançaThiago Nogueira100% (1)
- Apoptose: Morte Celular ProgramadaDocumento56 páginasApoptose: Morte Celular ProgramadaJéssica Vaz0% (1)
- PCDT Transtorno Esquizoafetivo CP 55Documento51 páginasPCDT Transtorno Esquizoafetivo CP 55thalitaAinda não há avaliações
- Protocolo Clínico para Dor CrônicaDocumento26 páginasProtocolo Clínico para Dor CrônicaMarco SadockAinda não há avaliações
- Ciências Morfofuncionais Dos Sistemas Digestório, Endócrino e Renal SEÇÃO+3.2+PÂNCREASDocumento24 páginasCiências Morfofuncionais Dos Sistemas Digestório, Endócrino e Renal SEÇÃO+3.2+PÂNCREASYam VictorAinda não há avaliações
- Exames LaboratoriaisDocumento164 páginasExames Laboratoriaiscicerosmoreira67% (3)
- Encaminhamento Da CIB e Cosems Junho 2023Documento13 páginasEncaminhamento Da CIB e Cosems Junho 2023Adriele SampaioAinda não há avaliações
- Análise Preliminar de Riscos - APRDocumento3 páginasAnálise Preliminar de Riscos - APRJéssica LimaAinda não há avaliações
- Ae3 Bio 2ano GabaritoDocumento9 páginasAe3 Bio 2ano GabaritoSandra M SilvaAinda não há avaliações
- Condutas Paciente QueimadoDocumento80 páginasCondutas Paciente QueimadoKaremAinda não há avaliações
- Eletrocardiografia I - Bases eletrofisiológicasDocumento54 páginasEletrocardiografia I - Bases eletrofisiológicasDialungana Paulo BenvindoAinda não há avaliações
- Introdução à Inflamação AgudaDocumento32 páginasIntrodução à Inflamação AgudaLivia RodriguesAinda não há avaliações
- Reconstrução Nas Amputações Traumáticas Do Membro Superior. Abel NascimentoDocumento9 páginasReconstrução Nas Amputações Traumáticas Do Membro Superior. Abel NascimentoNuno Craveiro LopesAinda não há avaliações
- Gravidez Ectópica: Carlos, Tânia Francisco, Higino Langa, Gomes Lucas, Gilberto Machava, SidónioDocumento20 páginasGravidez Ectópica: Carlos, Tânia Francisco, Higino Langa, Gomes Lucas, Gilberto Machava, SidónioFenias BoaneAinda não há avaliações
- Roteiro auxiliar para visita domiciliar do ACSDocumento2 páginasRoteiro auxiliar para visita domiciliar do ACSWalter Alvim de Albuquerque100% (6)
- Vida Celeiro 017Documento52 páginasVida Celeiro 017SandraCosta100% (1)
- Triagem Laboratorial - SorologiaDocumento24 páginasTriagem Laboratorial - SorologiaRobson MedeirosAinda não há avaliações
- 5 - Uroanálise - Sedimento e MicrsoDocumento85 páginas5 - Uroanálise - Sedimento e MicrsoMaria EduardaAinda não há avaliações
- Exercício sobre água, propriedades e característicasDocumento3 páginasExercício sobre água, propriedades e característicasLiginho RodriguesAinda não há avaliações
- Aula 3 PsicofarmacologiaDocumento24 páginasAula 3 PsicofarmacologiaHelena Barboza Fraga QueirozAinda não há avaliações
- Corpo Humano IDocumento294 páginasCorpo Humano IeduardoAinda não há avaliações
- Bebês - Receitas de PapinhasDocumento20 páginasBebês - Receitas de PapinhasMarcos FernandesAinda não há avaliações
- Farmacologia B-SicaDocumento24 páginasFarmacologia B-SicaIriz Marinho Correa Rodrigues100% (2)
- Aula SEDAÇAO EspecializaçãoDocumento33 páginasAula SEDAÇAO EspecializaçãoRenato Aló da FontouraAinda não há avaliações
- Teste de Biologia: Produção de Alimentos e SustentabilidadeDocumento4 páginasTeste de Biologia: Produção de Alimentos e SustentabilidadeCatarinaNL0% (1)
- DALGALARRONDO - Religiao e Saude Mental No BrasilDocumento9 páginasDALGALARRONDO - Religiao e Saude Mental No Brasillesspaul8160100% (1)
- Hematologia e Imunologia BásicaDocumento216 páginasHematologia e Imunologia BásicaThiago Laurindo 2Ainda não há avaliações
- Resenha e A Vida Continua - Saúde ColetivaDocumento2 páginasResenha e A Vida Continua - Saúde ColetivaRayssa Maria Tapajos CoqueiroAinda não há avaliações