Escolar Documentos
Profissional Documentos
Cultura Documentos
Enzimas: propiedades y especificidad
Enviado por
Marta Hernández GarcíaDescrição original:
Título original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Enzimas: propiedades y especificidad
Enviado por
Marta Hernández GarcíaDireitos autorais:
Formatos disponíveis
1. Introduccin 2. Las enzimas 3. Propiedades y especificidad de las enzimas 4. Factores enzimticos 5. Conclusiones 6.
Bibliografa
Introduccin
Hablar de enzimas, es un tema no muy conocido por los estudiantes universitarios, lo que nos motiv a realizar este modesto trabajo de investigacin y esperamos desarrollarlo con el mayor empeo posible. La vida de diferentes seres unicelulares o pluricelulares dependen de una serie compleja de reacciones qumicas perfectamente ordenadas, este orden es debido a que esas reacciones qumicas estn catalizadas por protenas denominadas enzimas, cuyas propiedades permiten modular las velocidades de estas reacciones. Uno de los propsitos es dar a conocer la importancia de las enzimas dentro del metabolismo celular, con ello podremos entender el comportamiento de nuestro organismo. No ha sido muy fcil la bsqueda de la informacin y ms an la terminologa usada en la disertacin de tan importe proceso bioqumico. En mayor parte estas reacciones no se daran en ausencia de las enzimas o procederan a velocidades despreciables, cada ser vivo tiene mas de un millar de enzimas diferentes y de la accin enzimtica de una determinada clula condiciona sus posibilidades y determinar sus funciones biolgicas. CAPTULO I
Las enzimas
1.1 LOCALIZACIN Muchas de las enzimas se encuentran en el citoplasma de la clula, otros estn unidas a otras clulas como las enzimas respiratorias que catalizan el metabolismo del acido lctico y tambin las sustancias derivadas al cidos aminados y cidos grasos. Hay otros que intervienen en la sntesis de la protena, son parte integrantes de partculas citoplasmticas llamadas: Ribosomas 1.2 CARACTERSTICAS DE LAS ENZIMAS Las enzimas contienen los mismos aminocidos que el resto de las proteinas. Unas enzimas se presentan en forma soluble y otras forman parte de la estructura de las diferentes membranas celulares o de la agrupaciones proteicas que constituyen las fibras o de las partculas En algunos, casos la enzima y el sustrato, sustancia que se convierte en producto, constituyen el conjunto funcional mnimo que no requiere de ninguna sustancia para ser activo, sin embargo, para muchas enzimas la actividad de catalizadores dependen de la presencia de las molculas, orgnicas no proteicas y que se conocen con el nombre de coenzimas. Si forman parte de la estructura de la enzima de modo estable se denominan Grupos prostticos. Muchas enzimas requieren tambin de la presencia de metales. Determinadas enzimas existen en las clulas en una forma prcticamente inactiva, la Pro enzima o Zimogeno y pasa mediante proteolisis limitada, en que se rompen selectivamente determinados enlaces peptdico a la forma activa.
Algunas enzimas existen en mas de una forma molecular catalizando todas ellas la misma reaccion. La Pluralidad de las formas pueden darse dentro de una misma clula o en los diversos tejidos de un organismo estas diferentes formas moleculares se denominan isoenzimas. En algunos casos las diferentes enzimas catalizan un determinado proceso en estn agrupadas, interaccionando entre si a travs de enlaces no covalentes y constituyendo lo que se denomina un complejo multienzimatico. La actividad de cada una de las enzimas que lo integran depende de esas interacciones de forma que la disociacin del complejo trae consigo generalmente la perdida de actividad de sus componentes. 1.3 CARACTERISTICAS D E LAS ENZIMAS 1.3.1 ENZIMAS COMO CATALIZADORES Casi toda reaccion qumica en las clulas es catalizadas por enzimas especficas. Como todos los catalizadores las enzimas no afectan la capacidad de reaccion la cual es determinada por el cambio de energa libre. "AG" entre reactivos y productos para las reacciones que son energticamente favorables las enzimas incrementan la velocidad de reaccion bajando energa de activacin. Otras enzimas estn presentes solo en un tipo particular de clula que catalizan reacciones exclusivas para este tipo de clulas( en las clulas nerviosas). Aunque la mayora de las enzimas estn ubicadas dentro de las clulas, algunas son secretadas y funcionan en sitios extracelulares, como la sangre, la luz del tubo digestivo o incluso fuera del organismo. La actividad cataltica de algunas enzimas es critica para los procesos celulares diferentes de la sntesis o degradacin de las molculas por ejemplo: muchas protenas regulatorias y protenas sealizadotas intracelulares catalizan la fosforilizacion de protenas y algunas protenas de transporte catalizan la hidrlisis de ATP acoplada al movimiento de molculas a lo largo de la membranas por lo general solo a altas temperaturas o presiones a PH extremos elevados o bajos o en solventes orgnicos. Sin embargo como catalizadores proteicos de las clulas, las enzimas deben funcionar eficazmente en ambientes acuosos a 37C a un PH de 6,5 7,5
Dos notables propiedades de las enzimas las habilitan para funcionar como catalizadores bajo las apacibles condiciones presentes en las clulas: su enrome poder cataltico y su alto grado de especificad. El inmenso poder cataltico hace que las velocidades de las reacciones catalizadas enzimaticamente sean 10 veces mayores de que las reacciones no catalizadas no correspondientes en condiciones similares La especificad exquisita de las enzimas su habilidad para actuar selectivamente en un sustrato o un numero selecto de sustratos qumicamente similares No sorprende que las reacciones catalizadas por enzimas de los aminocidos tengan lugar mucho mas rpidamente de lo que hacen la de los aminocidos a pesar de que ambos esteroionomeros de un aminocido dado son los mismos tamaos y poseen el mismo grupo R. Se han clasificado en la base de datos mas de 3.700 enzimas cada una con las cuales cataliza una reaccion qumica nica o un conjunto de reacciones estrechamente relacionadas. 1.3.2 MODO DE ACCION Una enzima por si misma no puede llenar acabo de una reaccion, sin funcin es modificar la velocidad de reaccion entendindose como tal la cantidad del producto formada por una unidad
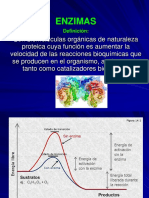
de tiempo. Tal variacin se debe a la disminucin de energa de activacin en una reaccion qumica. La energa de activacin es la energa necesaria para convertir los reactivos activos en formas moleculares inestables denominadas especies en estado de transicin que pueden ser mayor energa libre que los reactivos y los productos Su modote accin se refieren a que tienen protenas que tienen uno o mas lugares denominados sitios activos a los cuales se une al sustrato es decir la sustancia sobre la que acta la enzima. El sustrato es modificado qumicamente y convertido en uno o ms productos. Como esta reaccion es generalmente reversible puede ser expresada de la siguiente manera:
Fuente: http://www.ehu.es/biomoleculas/enzimas/enz2.htm Donde ES es un complejo enzima sustrato intermediario. Las enzimas aceleran la reaccion hasta que se alcanza un equilibrio y pueden ser tan eficaces como para que la velocidad de reaccion sea de 10 a 18 mayor veces mas rpida que en ausencia de un catalizador Una caractersticas de las enzimas es su especificad de manera que cada enzima particular acta solo sobre un determinado sustrato. Las enzimas suelen ser tan especificas que son encapaces de actuar sobre sustancias estrechamente relacionadas. 1.4 NOMENCLATURA DE LAS ENZIMAS Como la funcin de las enzimas es catalizar reacciones especficas es conveniente denominar las enzimas de acuerdo con estos reacciones determinadas. El mtodo general se basa en la adicin del sufijo asa el nombre del sustrato es un lpido atacado por la enzima lipasa. No obstante aun se utilizan nombres como el de la tripsina y pepsina atribuidos a ciertas enzimas que se propusieran una nomenclatura mas adecuadas Una comisin sobre nzimas a ideado a una enzima completo aunque complejo para la clasificacin y nomenclatura de las enzimas estos se clasifican en 6 grupos principales de acuerdo con el tipo de reaccin que catalizan los grupos son los siguientes: - Oxido reductasa: Estas enzimas que catalizan las reacciones de oxidacin- reduccin, incluyen oxidasas, peroxidasas y Transferasa: Enzima que catalizan la transferencia de un grupo qumico de una molcula a otra ejemplo: transaminasas y y y y Hidrolasas: Este es un gran grupo de enzimas que catalizan la Hidrlisis de diversos sustratos : peptidazas Liasas: En este grupo se incluyen las enzimas que catalizan la eliminacin de grupos sustratos Isomerazas: Enzimas que catalizan diferentes tipos de reacciones de isomerazion Ligazas: La funcin de esta enzimas es la de unir dos molculas mediante enlaces
1.5 CLASIFICACION DE LAS ENZIMAS - Oxido reductasa: Estas enzimas que catalizan las reacciones de oxidacin- reduccin, incluyen oxidasas, peroxidasas y Transferasa: Enzima que catalizan la transferencia de un grupo qumico de una molcula a otra ejemplo: transaminasas
y y y y
Hidrolasas: Este es un gran grupo de enzimas que catalizan la Hidrlisis de diversos sustratos : peptidazas Liasas: En este grupo se incluyen las enzimas que catalizan la eliminacin de grupos sustratos Isomerazas: Enzimas que catalizan diferentes tipos de reacciones de isomerazion Ligazas: La funcin de esta enzimas es la de unir dos molculas mediante enlaces CAPITULO II
Propiedades y especificidad de las enzimas
2.1 PROPIEDADES DE LAS ENZIMAS Como sucede con todos los catalizadores, las enzimas tienen las siguientes propiedades: -No sufren cambios irreversibles durante a reaccin por lo que cada molcula de enzima puede participar de manera repetida en reacciones individuales -No tienen efecto en la termodinmica de la reaccin esto quiere decir que las enzimas no aportan energa para una reaccin qumica por o que no determina si una reaccin es favorable( exorgonica) o desfavorable (endorgonica) desde el punto de vista termodinmico. -Las enzimas son catalizadores muy eficientes -Son altamente especficos para sus sustratos y para cada uno de su reaccin -pueden estar sujetos a regulacin en su actividad: Regulacin alosterica -Son eficiente en pequeas cantidades, las enzimas no sufre cambios al catalizar las reacciones qumicas de manera que una pequea cantidad de enzima puede catalizar repetidas veces una reaccion -Aceleran las reacciones qumicas su sufrir modificaciones. No alteran las concentraciones de equilibrio de la reaccion solo que esta al alcance , mas rpidamente cambiando el mecanismo de reaccion -Modifican el carcter exotrmico o endotrmico de la reaccion. 2.2 ESPECIFIDAD ENZIMATICA Una de las caractersticas mas importantes de las enzimas es su alta especificad sobre la reaccion que catalizan. Cada enzima cataliza un solo tipo de reaccion y casi siempre acta sobre un nico sustrato o un grupo reducido de ellos. Esta especificad se debe a la complementariedad que debe existir entre el sustrato y el centro activo de la enzima. En 1984, Emil fisher propuso la hiptesis de la llave y la cerradura para explicar la especificad enzimatica. Segn esta hiptesis la especificad entre la enzima y el sustrato es como la que existe entre una llave y una cerradura. Se pensaba que el centro activo tenia una forma tridimensional determinada y el sustrato seria complementario a el y encajara perfectamente. Otra teora fue la de Daniel Koshland propuso la Hiptesis del ajuste inducido o se la mano y el guante que es la que se acepta en la actualidad. Dice que la especificad radica en los aminocidos de union del centro activo, que son los encargados de establecer enlaces dbiles con el sustrato. Realizada la fijacin la enzima posee libertad para cambiar su forma y amoldarse al sustrato de tal manera que el centro activo quede correctamente situado. Esta teora afirma que no hay una adaptacin predeterminada como ocurre en el modelo de la llave cerradura, sino una adaptacin inducida por los aminocidos de union La especificad se estable a dos niveles: 2.2.1 Especifidad de accin: es decir una enzima solo puede realizar un determinado tipo de reaccion: Hidrlisis, Oxido Reduccin 2.2.2 Especifidad de sustrato: Esto significa que cada enzima solo puede actuar sobre un sustrato o sobre un reducido de sustratos Absoluta: La enzima acta sobre un nico sustrato
De grupo: La enzima acta sobre un grupo de sustratos 2.3 EL SITIO ACTIVO Es el lugar de unin entre el sustrato a una enzima y donde se da la reaccion de catlisis se denomina centro activo. En el centro activo encontramos restos de aminocidos con sustituyentes funcionales para la catlisis de un sustrato. Al haber pero muchsimas variedades de reacciones que pueden ser catalizadas, no hay suficientes combinaciones de restos de aminocidos para hacer catlisis especfica para una de estas combinaciones, por tanto nuestras clulas utilizan las llamadas Coenzimas. Las Coenzimas acostumbran a sr complejas molculas orgnicas que sufren modificaciones durante la reaccion enzimatica para ayudar a la modificacin final del sustrato. Tambin puede servir como donadoras o aceptadoras de hidriones y electrones o pueden transferir grupos funcionales, Tras la catlisis la coenzima vuelve a su estado original. Si la coenzima se queda unida de forma temporal a la enzima es llamada cosustrato. Siesta anclada a la enzima la lamamos Grupo prosttico. Los centros activos de las enzimas pueden ser desnaturalizados, es decir, inactivada su especificad de unin por la modificacin de las protenas de la unin con el sustrato. La desnaturalizacin puede darse por una variacin alta de temperatura o de PH del ambiente donde se encuentre. 2.4 EL COMPLEJO ENZIMA SUSTRATO Las enzimas dirigen las transformaciones qumicas y energticas que tienen lugar en cada clula. Pero para realizar estas funciones bsicas y vitales para nuestra vida deben tener una capacidad de interaccionar de forma especifica y reversible con ligandos, que viene dad por su conformacin espacial en el lugar de la union. Para que la enzima modifique el ligando(sustrato a partir de ese momento) este debe encajar en el lugar de la union de la enzima. Por esto decimos que hay una complementariedad geomtrica entre la enzima y sustrato. Los lugares de union acostumbran a estar en unas hendiduras de la superficie de de la enzima formando como un bolsillo en el cual entra el sustrato. De esta manera la superficie de interaccin entre el sustrato y enzima es mayor y las posibilidades de conferir especificad con el sustrato aumenta. La especificad de la union es tan alta que la enzima es capaz de distinguir entre sustratos esteroisomeros, por lo que decimos que las enzimas presentan electroespecifidad. La electroespecifidad puede servir en casos concretos para separar rutas de formacin y degradacin de productos, que se realizan de forma simultanea. Este hecho se debe a que las enzimas son molculas asimtricas. La union se mantiene gracias a las fuerzas de enlaces no covalentes entre tomos del sustrato y la enzima, como los enlaces de van der. walls , enlace por puente de hidrogeno o puentes salinos durante la catlisis pero la union es temporal por tanto cuando la reaccion enzimatica finalizan se separan la enzima y el producto. 2.4.1 Enlace Llave cerradura: El sustrato encaja perfectamente en e centro activo gracias a una complementariedades moleculares y electroestticas con la enzima de manera tal que este no cambia su forma(El sustrato seria la llave y el centro activo o la enzima seria la cerradura)
FUENTE: http://es.wikipedia.org/wiki/Complejo_enzima-sustrato 2.4.2 Enlace inducido : El sustrato NO encaja perfectamente en e centro activo cambia su formacin espacial provocando un ambiente favorable a la unin y reaccion con el sustrato de manera que se une a este para proceder con la catlisis. En este caso no encontramos la misma especificad como en el enlace de tipo llave- cerradura, por lo que la enzima pude reaccionar con varios sustratos de conformaciones parecidas.
FUENTE:http://es.wikipedia.org/wiki/Complejo_enzima-sustrato CAPITULO III
Factores enzimticos
3.1 FACTORES QUE AFECTAN LA ACTIVIDAD ENZIMATICA 3.1.1Temperatura: Las enzimas son inactivadas por e calor a temperaturas de 50C-60C inactivan rpidamente la mayor parte de las enzimas. Esta inactivaron es irreversible, pues al enfriar no se obtiene actividad otra vez. Esto explica que casi todo los organismos resulten muertos a una exposicin a temperatura elevada: Sus enzimas se inactivan y resultan incapaces de reanudar su metabolismo. Las Enzimas no son inactivadas por la congelacin; las reacciones que producen tienen a lugar muy lentamente a temperaturas bajas, o se detienen, pero la actividad cataltica reaparece si la temperatura vuelve a su estado normal 3.1.2 Acidez: Las enzimas son sensibles a los cambios de PH o sea de acidez o alcalinidad en el medio. La mayor parte de enzimas intracelulares tienen PH ptimos cerca de la neutralidad, por lo que no actan en medios cidos ni alcalinos, los cidos y bases enrgicos las inactivan irreversiblemente. 3.1.3Concentracin de Enzima, substrato y Cofactor: Si el PH y la temperatura de un sistema enzimtico se mantiene constante pero hay exceso de substrato, la intensidad de la reaccion es directamente proporcional a la cantidad de enzima presente. 3.1.4Venenos Enzimticos: Algunas enzimas resultan muy sensibles a ciertos venenos como el acido cianuro fluoruro lewisita etc. Resultan inactivadas aun frente a concentraciones bajas de estos venenos Aun las enzimas pueden actuar como venenos si se encuentran en lugar in adecuado. Varios tipos de venenos que viene de los animales como la de la serpiente abeja y escorpin deben su poder letal a las enzimas que destruyen glbulos rojos y otros tejidos. 3.1.5 PH: Los cambios de PH alteraran considerablemente la naturaleza inica de los enzimas se sabe poco de las variaciones del PH en las enzimas.
http://www.ehu.es/biomoleculas/enzimas/enz2.htm 3.2 INHIBIDORES ENZIMATICOS Son molculas que se unen a enzimas y disminuyen su actividad puesto que el Bloqueo de una enzima puede matar a un organismo patgeno o corregir un desequilibrio metlico. Sin embargo no todas las molculas que se unen a las enzimas sin inhibidores, los activadores enzimticos se unen a las enzimas y se incrementan su actividad. La union de un inhibidor puede impedir la entrada del sustrato al sitio activo de la enzima y obstaculizar que la enzima catalice su reaccion correspondiente. La union del inhibidor puede ser reversible e irreversible. Normalmente los inhibidores irreversibles reaccionan con la enzima de forma covalente y no clasifican su estructura qumica a nivel de residuos esenciales de los aminocidos necesarios para la actividad enzimatica. En cambio los reversibles se unen a la enzima de forma no covalente donde da lugar a diferentes tipos de inhibicin dependiendo si el inhibidor se una a la enzima, al complejo: enzima sustrato o ambos -se unen a las enzimas mediantes interacciones no covalentes= puentes de hidrogeno, enlaces inicos - Los inhibidores y el sitio activo se combinan para producir una union fuerte y especifica. Al contrario que ocurre con el sustrato y los inhibidores irreversibles no experimentan reacciones qumicas cuando se une a la enzima y pueden ser eliminados fcilmente por dilucin o por dilisis. 3.2.1TIPOS DE INHIBIDORES 3.2.1.1 Inhibidor Reversible: 3.2.1.1.1 Inhibicin Competitiva : El sustrato y el inhibidor no se pueden unir a la misma enzima al mismo tiempo, esto ocurre cuando el inhibidor tiene afinidad por el sitio activo de una enzima en el que se una el sustrato. El sustrato y el inhibidor compiten por el acceso al sitio activo de la enzima. Este tipo de inhibidor se puede superar con concentraciones suficientes altas del sustrato, es decir dejando afuera el inhibidor.
FUENTE: http://es.wikipedia.org/wiki/Complejo_enzima-sustrato 3.2.1.1.2 Inhibicin Mixta : El sustrato en el inhibidor afecta la unin del sustito y viceversa; este tipo de inhibidor se puede reducir pero no se puede superar al aumentar la concentraciones del sustrato aunque si se dan las cosas que se unan el sitio activo.
Aunque es posible que los inhibidores de tipo mixta se unen al sitio activo (efecto alosterico) Donde el inhibidor se une a otro sitio activo que no es el sitio activo de la enzima todo esto es un sitio alosterico cambia con la formacin da la afinidad del sustrato por el sitito activo reducido. 3.2.1.1.3Inhibicin No Competitiva : Es una forma de una inhibicin mixta donde la unin del inhibidor con la enzima reduce su actividad pero no acepta la unin del sustrato. El grado de inhibicin depende de su concentracin.
Fuente: http://es.wikipedia.org/wiki/Complejo_enzima-sustrato 3.2.1.2 Inhibidor Irreversible: La inhibicin irreversible es diferente de la in activacin enzimtico reversible. Los inhibidores irreversibles son generalmente especficos para un tipo de enzima y no inactivan todas las protenas. No funcionan destruyendo la estructura proteinica, sino alterando especficamente la estructura tridimensional del sitio activo inhabilitndola. Los inhibidores irreversibles dan lugar a una inhibicin dependiente del tiempo y por ello su potencia no puede ser caracterizada mediante la determinacin del valor. Esto se debe a la cantidad de enzima activa a la concentracion dada de inhibidor irreversible ser diferente dependiendo del tiempo de preincubacin del inhibidor con la enzima.
Conclusiones
- La clula puede compararse con un minsculo laboratorio, en el cual tiene la sntesis y la degradacin de un gran numero de sustancias. Estos procesos son efectuados por enzimas a la temperatura normal del organismo ya que a temperaturas sobre lo normal se produce la desnaturalizacin y la in activacin de las enzimas y con PH normal para efectuar sus procesos. - Las enzimas son los catalizadores biolgicos. que es una sustancia que acelera las reacciones qumicas si modificarse lo que significa que puede ser utilizado una y otra vez. - Las enzimas son protenas que tienen uno o ms lugares llamados sitios activos a los cuales se les unen el sustrato, es decir, la sustancia sobre la que acta la enzima. El sustrato es modificado qumicamente y convertido uno o mas productos E + S = [ES] = E+P Donde [ES] es un complejo enzima - sustrato intermediario. Las enzimas aceleran la reaccin hasta que se alcanza un equilibrio y puedan ser eficientes como para que la velocidad de reacciones sea de 10 a 10 veces mas rpida que en ausencia de un catalizador. - Una caracterstica muy importante de la actividad enzimtico es su especificad de manera que cada enzima particular acta sobre un determinado sustrato. - Las enzimas suelen ser tan especficas que son incapaces de actuar sobre las sustancias estrechamente relacionadas. - Las enzimas vienen a ser las protenas catalticas que aceleran la velocidad de las reacciones celulares al bajar la energa de activacin y estabilizar las intermediaciones del estado de
transicin. - El sitio activo de la enzima comprende dos partes adicionales una regin de unin de sustrato y la otra cataltica. - En el centro activo encontramos restos de aminocidos constituyentes funcionales para la catlisis del sustrato, estos utilizan las llamadas coenzimas que son molculas orgnicas que sufren modificaciones durante la reaccin enzimtico para ayudar a la modificacin final del sustrato.
Bibliografa
Plank M. Biologa. 4ta ed. Mxico: Interamericana; 1994. Depical R. Biologa Celular Molecular. 5ta ed. Argentina: Ateneo; 2005. Miller M. Biologa General. 3ra ed. Navarra: Navarra; 1981. -Ambrose E. Biologa Acelular. 1ra ed. Madrid: Atlanta; 1977. -Lam J. Biologa. 4ta ed. Machasuiite. Whesley IberoAmrica; 2000. -Ladish H. Biologa Celular. 5ta ed. Mxico: Panamericana; 2008. -Lexmarck P. Enzimas Catalizadoras. 2da ed. Barcelona: Atlanta; 1989. DEDICATORIA A mis padres: Manuel Antonio Mesones Salazar y Ofelia Alvitres Coronado y en especial a Dios que son el motivo de mi inspiracin para este trabajo de investigacin. AGRADECIMIENTO Al Profesor Jos Genaro Cabrera Rojas encargado del curso de metodologa del trabajo intelectual por los consejos y su valioso tiempo para hacer de este trabajo algo del que me sienta orgulloso.
Autor: Manuel Antonio Mesones Alvitres Asesor: Jos Genaro Cabrera Rojas Chiclayo, Julio 2010 Facultad de Medicina Escuela de Odontologa
Você também pode gostar
- Enzimas SeminarioDocumento31 páginasEnzimas SeminarioJanet PonceAinda não há avaliações
- Bioquimica Tema PDFDocumento20 páginasBioquimica Tema PDFLouise Clemente DoroteoAinda não há avaliações
- Monografia de EnzimasDocumento7 páginasMonografia de EnzimasJINX XNIJAinda não há avaliações
- Enzimas y su importancia en las reacciones bioquímicasDocumento11 páginasEnzimas y su importancia en las reacciones bioquímicasxiomaGuzmanAinda não há avaliações
- Concepto de Enzimas Capsula 1Documento4 páginasConcepto de Enzimas Capsula 1Ariel MojicaAinda não há avaliações
- 2 Bioquimica Texto Paralelo 1Documento8 páginas2 Bioquimica Texto Paralelo 1Santos PalenciaAinda não há avaliações
- Practica de Accion EnzimaticaDocumento8 páginasPractica de Accion EnzimaticaMichaelZhelmiCaEsAinda não há avaliações
- ENZIMASDocumento18 páginasENZIMASDaniela RoviraAinda não há avaliações
- Clasificación y mecanismos de las enzimasDocumento22 páginasClasificación y mecanismos de las enzimasFercho MariscalAinda não há avaliações
- Que Son Las EnzimasDocumento12 páginasQue Son Las EnzimasXiomara MarinAinda não há avaliações
- Glosario de Bioquimica de AndresDocumento6 páginasGlosario de Bioquimica de AndresEl Refugio de Rangel 357Ainda não há avaliações
- Taller de EnzimasDocumento9 páginasTaller de EnzimasLau Ortiz TerrazaAinda não há avaliações
- Para Que Una Célula Viva Se Desarrolle y ReproduzcaDocumento5 páginasPara Que Una Célula Viva Se Desarrolle y ReproduzcaElder CulajayAinda não há avaliações
- Las enzimas son moléculas proteicas que catalizan reacciones químicasDocumento6 páginasLas enzimas son moléculas proteicas que catalizan reacciones químicasdifat franciscoAinda não há avaliações
- Taller EnzimasDocumento4 páginasTaller EnzimasRosman Ramos MartinezAinda não há avaliações
- CUESTIONARIODocumento11 páginasCUESTIONARIOClaudia PalmaAinda não há avaliações
- Arreglado para ImprimirDocumento31 páginasArreglado para ImprimirMilton Cesar Rodrigo TantaleanAinda não há avaliações
- Enzimas: Generalidades y características claveDocumento29 páginasEnzimas: Generalidades y características claveLuis MarquinezAinda não há avaliações
- Solucion Tarea 2 de BioquimicaDocumento6 páginasSolucion Tarea 2 de BioquimicaAndresFelipeSoto100% (1)
- Xpo Bbio y GenDocumento5 páginasXpo Bbio y GenHilary De La CruzAinda não há avaliações
- ENZIMASDocumento23 páginasENZIMASEsther Salazar Vásquez100% (1)
- Apunte Teã Rico - EnzimasDocumento16 páginasApunte Teã Rico - EnzimasMercedes GranelliAinda não há avaliações
- Informe EnzimasDocumento17 páginasInforme EnzimasJunior Andrade JaqueAinda não há avaliações
- BacteriasDocumento4 páginasBacterias5B SyM VARGAS RODRIGUEZ LAURA ALEJANDRAAinda não há avaliações
- Enzimas catalizadoras vitalesDocumento36 páginasEnzimas catalizadoras vitalesMarcos antonio suarez vergaraAinda não há avaliações
- Definición de Enzima y EstructuraDocumento10 páginasDefinición de Enzima y EstructuraImnova TecAinda não há avaliações
- ENZIMAS bIOQUÍMICADocumento37 páginasENZIMAS bIOQUÍMICANoelis LimonAinda não há avaliações
- Biocatalizadores y Referencias BibliograficasDocumento6 páginasBiocatalizadores y Referencias BibliograficasMaria Elizabeth M. Alberca0% (1)
- Las Enzimas y Sus CaracterísticasDocumento7 páginasLas Enzimas y Sus CaracterísticasWily ChavezAinda não há avaliações
- Decreto 4320Documento9 páginasDecreto 4320Leydi Yulieth CastiblancoAinda não há avaliações
- Serie #6. Enzimas y CoenzimasDocumento8 páginasSerie #6. Enzimas y CoenzimasMarianoAinda não há avaliações
- Bioq EnsayoEnzimasDocumento13 páginasBioq EnsayoEnzimasAriel TorresAinda não há avaliações
- Informe BioquimicDocumento12 páginasInforme BioquimicDarwin AmasifuenAinda não há avaliações
- BIOLOGIA Terminado2Documento62 páginasBIOLOGIA Terminado2Milton Cesar Rodrigo TantaleanAinda não há avaliações
- ENZIMASDocumento3 páginasENZIMAShola soy agustinaAinda não há avaliações
- Enzimas: definición, estructura, clasificación y funciónDocumento53 páginasEnzimas: definición, estructura, clasificación y funciónNelson BeltranAinda não há avaliações
- EnzimasDocumento9 páginasEnzimasAshleyAinda não há avaliações
- Cuestionario Practica EnzimasDocumento5 páginasCuestionario Practica EnzimasRocio GutierrezAinda não há avaliações
- ENZIMASDocumento28 páginasENZIMASAlfredo MéndezAinda não há avaliações
- BIOQUICUES2Documento7 páginasBIOQUICUES2matsuo kamAinda não há avaliações
- Ezimas PDFDocumento11 páginasEzimas PDFunknow270223Ainda não há avaliações
- Información BiologiaDocumento3 páginasInformación BiologiaEmerson Tiago Camacho DíazAinda não há avaliações
- Estructura trifosfato isomerasaDocumento15 páginasEstructura trifosfato isomerasaluis fernandoAinda não há avaliações
- S02A Material S15.s2Documento16 páginasS02A Material S15.s2Camila AlessandraAinda não há avaliações
- Bioquímica. Tema 6 EnzimasDocumento3 páginasBioquímica. Tema 6 EnzimasLucia GandarillasAinda não há avaliações
- Demostración Proteica EnzimasDocumento3 páginasDemostración Proteica EnzimasElky Fernandez LaizaAinda não há avaliações
- Enzimas clasificación propiedadesDocumento12 páginasEnzimas clasificación propiedadesKiefer MedinaAinda não há avaliações
- Cinetica EnzimaticaDocumento14 páginasCinetica EnzimaticaStiven De Los StivensonAinda não há avaliações
- Enzimas y CoenzimasDocumento11 páginasEnzimas y CoenzimasAntonella Elda CarrizoAinda não há avaliações
- En ZimasDocumento19 páginasEn ZimasKarlita MoránAinda não há avaliações
- Escrito Las EnzimasDocumento3 páginasEscrito Las EnzimasDeissy Vanessa Contreras JaimesAinda não há avaliações
- Enzimas y VitaminasDocumento9 páginasEnzimas y VitaminasRaúlAinda não há avaliações
- Las Enzimas PDFDocumento9 páginasLas Enzimas PDFTriny VilladiegoAinda não há avaliações
- Bioquimica Tercer ParcialDocumento39 páginasBioquimica Tercer Parcialsabriii Mapofseul7 BTSAinda não há avaliações
- Guia 3 - Actividad EnzimaticaDocumento2 páginasGuia 3 - Actividad EnzimaticaisabelAinda não há avaliações
- Repartido EnzimasDocumento34 páginasRepartido Enzimasgenet2015Ainda não há avaliações
- Enzimas Guía CompletaDocumento11 páginasEnzimas Guía CompletaAlvaro Andres Sanchez HurtadoAinda não há avaliações
- Enzimas catalizadoras de la vidaDocumento27 páginasEnzimas catalizadoras de la vidaNanci Llampa VilamaniAinda não há avaliações
- EnzimaDocumento3 páginasEnzimaAdrianyela TeixeiraAinda não há avaliações
- Acción de Inaplicabilidad Por Decisión de No Perseverar en El ProcedimientoDocumento23 páginasAcción de Inaplicabilidad Por Decisión de No Perseverar en El ProcedimientoCarlos CartesAinda não há avaliações
- Cambio Organizacional para Una Mayor CompetitividadDocumento6 páginasCambio Organizacional para Una Mayor CompetitividadvaleAinda não há avaliações
- Instructiva de Poder Notariado-Declaratoria de HerederoDocumento2 páginasInstructiva de Poder Notariado-Declaratoria de HerederoDavid Limon Padilla100% (2)
- 1 01 03 Introduccion-a-la-MatematicaDocumento4 páginas1 01 03 Introduccion-a-la-MatematicaFranRibaAinda não há avaliações
- Espacios-Ana Kely Andrade Q.Documento15 páginasEspacios-Ana Kely Andrade Q.Kely AndradeAinda não há avaliações
- Plan de Mejoramiento Lengua Castellana 2019 Elian PedrazaDocumento4 páginasPlan de Mejoramiento Lengua Castellana 2019 Elian PedrazaOscar Ardila ChaparroAinda não há avaliações
- Cuestionario Desiderativo VocacionalDocumento3 páginasCuestionario Desiderativo Vocacionalfamiliaensamblada100% (9)
- Ac - ReumatologíaDocumento18 páginasAc - ReumatologíaducAinda não há avaliações
- Linea de TiempoDocumento2 páginasLinea de TiempoAndrea BorjaAinda não há avaliações
- Historia de La Psicología - Autores y Teorías PrincipalesDocumento10 páginasHistoria de La Psicología - Autores y Teorías PrincipalesDanilsa Milena Pérez0% (1)
- Opinión Pública y Censura en Nueva España PDFDocumento598 páginasOpinión Pública y Censura en Nueva España PDFFrancisco Javier Cervantes BelloAinda não há avaliações
- Proyecto Final de Literatura IDocumento4 páginasProyecto Final de Literatura IBrigette NicoletteAinda não há avaliações
- Plan tutorial sobre el valor del amorDocumento7 páginasPlan tutorial sobre el valor del amorclia28Ainda não há avaliações
- Ejercicio Plastic ContainersDocumento1 páginaEjercicio Plastic ContainersFrancisco GomezAinda não há avaliações
- Análisis estructural por pendiente-deflexión y SAP 2000Documento23 páginasAnálisis estructural por pendiente-deflexión y SAP 2000Andres Daniel Moreno BecerraAinda não há avaliações
- VLN196408291Documento10 páginasVLN196408291luismoya2369Ainda não há avaliações
- Lumbalgia Aguda y Cronica AhrDocumento58 páginasLumbalgia Aguda y Cronica AhrVictor ApolonioAinda não há avaliações
- Introducción a la Enfermería UNIAPADocumento7 páginasIntroducción a la Enfermería UNIAPAESMARLIS BELLO JOSEAinda não há avaliações
- Negociación Esencial Gavin KennedyDocumento6 páginasNegociación Esencial Gavin KennedyYago Nahuel EscobarAinda não há avaliações
- Predicciones Ifá Cuba 2023Documento10 páginasPredicciones Ifá Cuba 2023YeneyAinda não há avaliações
- La Toma de DesicionesDocumento12 páginasLa Toma de DesicionesGimena LeónAinda não há avaliações
- Historia y Origen de La DemocraciaDocumento6 páginasHistoria y Origen de La DemocraciaEdisonMesiasAinda não há avaliações
- EL JUEGO DE TRAFICAR CON LA VIDA Y LA INTEGRIDAD RedaccionDocumento4 páginasEL JUEGO DE TRAFICAR CON LA VIDA Y LA INTEGRIDAD RedaccionAnderson Steven Muñoz CastroAinda não há avaliações
- Diagnostico Psi 101Documento5 páginasDiagnostico Psi 101Daniela CarrascoAinda não há avaliações
- 407209665-CUESTIONARIO-actividad 1 de 1.odtDocumento8 páginas407209665-CUESTIONARIO-actividad 1 de 1.odtsaul fraguaAinda não há avaliações
- EXCESO DE LEGITIMA DEFENSA-Desproporción en La ReacciónDocumento7 páginasEXCESO DE LEGITIMA DEFENSA-Desproporción en La Reacciónyency yasnith Niño RosasAinda não há avaliações
- Conociendo elementos de citaciónDocumento3 páginasConociendo elementos de citaciónManuel Norambuena OrtizAinda não há avaliações
- LEVICDocumento96 páginasLEVICconstancias imssAinda não há avaliações
- Ensayo SindicatoDocumento17 páginasEnsayo SindicatoKevin Orlando Flores RodasAinda não há avaliações
- Números cuánticos y distribución electrónicaDocumento2 páginasNúmeros cuánticos y distribución electrónicaJheison Eliacer Quispe HolguinAinda não há avaliações