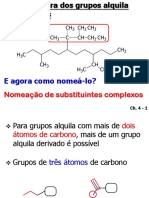
Escolar Documentos
Profissional Documentos
Cultura Documentos
Estrutura Atomica
Enviado por
Victor Hugo PerroneTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
Estrutura Atomica
Enviado por
Victor Hugo PerroneDireitos autorais:
Formatos disponíveis
Estrutura atmica
Roberto A. Salmeron - USP
Distinguimos duas regies nos tomos: a) uma com carga eltrica positiva, e muito pesada, que concentra quase todo o peso do tomo: chamadancleo. b) uma regio ocupada por eltrons, que giram ao redor do ncleo. Ncleo constitudo por neutrons e prtons. O neutron no tem carga eltrica. O prton tem carga eltrica positiva, que se representa por +e. Representase por Z o nmero de prtons de um tomo. A carga positiva do ncleo ento +Ze. Eltrons Possuem carga eltrica negativa, de mesmo valor absoluto que a dos prtons, e que se representa por -e. Como o tomo neutro, conclumos que o nmero de eltrons igual ao de prtons. H Z prtons, cuja carga total +Ze, e Z eltrons, cuja carga total -Ze. A carga total do tomo nula. Os eltrons giram ao redor do ncleo dispostos em vrias rbitas. A distncia dos eltrons ao ncleo muito grande, relativamente ao tamanho do ncleo. Por isso se diz que o tomo parece um sistema solar em miniatura. As rbitas dos eltrons so representadas, de dentro para fora, pelas letras K, L, M, N, O, P, Q. A rbita K a mais interna, Q a mais externa. A distribuio dos eltrons nessas rbitas conhecida para cada elemento (exemplo: hidrognio, ouro, urnio etc.). Para cada rbita h um nmero mximo de eltrons admissvel, que nunca ultrapassado, em nenhum elemento. Esses nmeros figuram na tabela abaixo:
rbita K L M N O P Q
Exemplos
Nmero mximo de eltrons 2 8 18 32 32 18 2
1 O tomo de hidrognio tem o ncleo constitudo por um nico prton. E tem somente um eltron, na nica rbita, K.
2 O tomo de hlio tem o ncleo constitudo por dois prtons e dois neutrons. E tem dois eltrons, na nica rbita, K. 3 O tomo de ltio tem o ncleo constitudo por trs prtons e quatro neutrons. Tem trs eltrons: dois na rbita K, um na L.
4 O tomo de neon tem o ncleo constitudo por dez prtons e nove neutrons. Tem dez eltrons: dois na rbita K, e oito na L. 5 O tomo de sdio tem o ncleo constitudo por onze prtons e dez neutrons. Tem onze eltrons: dois na rbita K, oito na L, um na M. 6 O tomo de urnio, o maior que existe na natureza, tem o ncleo formado por 92 prtons e 146 neutrons. Tem 92 eltrons, dispostos do seguinte modo: 2 na rbita K, 8 na L, 18 na M, 32 na N, 18 na O, 12 na P, 2 na Q. A estrutura do tomo como a conhecemos hoje, com os eltrons girando ao redor de um ncleo positivo, chamada Estrutura de Rutherford-Bohr. Isso porque, Ernest Rutherford, grande fsico experimental, realizou uma experincia decisiva, mostrando que a estrutura do tomo s pode ser essa. E Niels Bohr, grande fsico terico, foi o primeiro a tentar uma exposio matemtica dessa estrutura. NMERO ATMICO E NMERO DE MASSA Chama-se o nmero atmico de um elemento o nmero de prtons no seu ncleo. Para um tomo neutro, este tambm o nmero de eltrons que o tomo possui. O nmero atmico geralmente representado pela letra Z. Chama-se o nmero de massa de um elemento a soma do nmero de prtons com o nmero de neutrons, isto , o nmero de partculas que constituem o ncleo. Representa-se geralmente pela letra A. Assim, sendo N o nmero de neutrons de um ncleo, evidente que: ISTOPOS, ISBAROS, ISTONOS Chamam-se istopos os elementos que possuem igual nmero atmico, mas no possuem igual nmero de massa. Os istopos possuem mesmo nmero de prtons em seus ncleos, mas, no possuem mesmo nmero de neutrons. Exemplos 1) H 5 istopos do oxignio, todos de nmero atmico 8, mas de massas diferentes. les so: oxignio 15 (que tem A = 15); massa atmica = 15,0078 oxignio 16 (que tem A = 16); massa atmica = 16,0000 oxignio 17 (que tem A = 17); massa atmica = 17,0045 oxignio 18 (que tem A = 18); massa atmica = 18,0037 oxignio 19 (que tem A = 19); massa atmica = ?
2) H 3 istopos do hidrognio, todos de nmero atmico 1: hidrognio 1 (A = 1); massa atmica = 1,00813 hidrognio 2 (A = 2); massa atmica = 2,01472 hidrognio 3 (A = 3); massa atmica = 3,01705 Indicamos o nome de um istopo de um elemento, escrevendo adiante do nome do elemento, o nmero de massa do istopo. Exemplo: oxignio 15, hidrognio 1, urnio 235, urnio 238 etc. Chamam-se isbaros os elementos que tm mesmo nmero de massa. Exemplos Existe um hidrognio 3 (A = 3), e um hlio 3 (A = 3). les so, portanto, isbaros. Chamam-se istonos os elementos cujos tomos tm mesmo nmero de neutrons. UNIDADE DE MASSA ATMICA O oxignio tem 5 istopos. O mais abundante na natureza o de nmero de massa 16. A sse istopo atribumos arbitrariamente massa atmica 16,0000. Considerando os 5 istopos do oxignio e suas abundncias relativas, atribuindo massa atmica 16,0000 ao istopo de nmero de massa 16, e calculando uma mdia para a massa atmica do oxignio, encontramos o valor 16,00435. Adota-se geralmente, como unidade de massa atmica, de massa atmica mdia do oxignio. Representaremos essa unidade por u.m.a. A massa do prton 1,007582 u.m.a. A do neutron 1,008930 u.m.a. Ambas so quase iguais a 1 u.m.a.. por isso que o nmero de massa de um elemento d aproximadamente sua massa atmica. Compare os nmeros de massa e as massas atmicas dos istopos do oxignio e os do hidrognio, dados no pargrafo anterior. DIMENSES DO TOMO E DO NCLEO O volume ocupado por um tomo o de uma esfera de raio da ordem de 10-8cm (= 10-10m = 1 . / ou Angstrm). O volume ocupado pelo ncleo o de uma esfera de raio da ordem de 10-12cm. Portanto, o raio do tomo cerca de 10.000 vezes maior que o do ncleo. O volume do ncleo ento muito pequeno. Os prtons e neutrons que o constituem esto muito prximos, atraindo-se com foras muito grandes, formando um conjunto compacto. Quando se consegue romper sse conjunto, liberta-se grande quantidade de energia. a energia atmica.
Você também pode gostar
- Balanço de massa em processos industriaisDocumento3 páginasBalanço de massa em processos industriaisPaulo HenriqueAinda não há avaliações
- Tratamento Por Oxidação Química In-Situ de Solventes CloradosDocumento19 páginasTratamento Por Oxidação Química In-Situ de Solventes CloradosTecnohidro Engenharia AmbientalAinda não há avaliações
- Carvao Portugal PDFDocumento80 páginasCarvao Portugal PDFricardo4emeiaAinda não há avaliações
- Forças Intermoleculares PDFDocumento8 páginasForças Intermoleculares PDFlucas senaAinda não há avaliações
- Armazenamento Geológico de Co2Documento18 páginasArmazenamento Geológico de Co2isasiepierskiAinda não há avaliações
- Manual Do Usuario Familia OPzSDocumento51 páginasManual Do Usuario Familia OPzSRobson DeusdetteAinda não há avaliações
- Aula 14 Alcoois e Eteres PDFDocumento57 páginasAula 14 Alcoois e Eteres PDFSamuel MacarioAinda não há avaliações
- Reações de Eliminação OrgânicaDocumento10 páginasReações de Eliminação OrgânicanapotarioAinda não há avaliações
- Questões de Química GeralDocumento53 páginasQuestões de Química GeralMarkim Rolim100% (1)
- Fórmulas químicasDocumento5 páginasFórmulas químicasAline OliveiraAinda não há avaliações
- Atividade 1 - A Hibridação de OrbitaisDocumento4 páginasAtividade 1 - A Hibridação de OrbitaisRamon CardosoAinda não há avaliações
- 04 - Conformação e Compostos CíclicosDocumento107 páginas04 - Conformação e Compostos CíclicosJoão AfonsoAinda não há avaliações
- Tricologia Básica Aula 1 - Grupo PDFDocumento5 páginasTricologia Básica Aula 1 - Grupo PDFAndreia CardosoAinda não há avaliações
- Unifesp2008 3diaDocumento9 páginasUnifesp2008 3diaAlexandre LimaAinda não há avaliações
- Eletrolise Salmora PDFDocumento139 páginasEletrolise Salmora PDFNeider FilhoAinda não há avaliações
- 1 - Cap 2 Libes - TraduzidoDocumento19 páginas1 - Cap 2 Libes - TraduzidoAna Julia PeixotoAinda não há avaliações
- Manual Do Instalador-HiWall (MS - SVN21C - PB)Documento26 páginasManual Do Instalador-HiWall (MS - SVN21C - PB)tfkrochaAinda não há avaliações
- Quimica Geral Exercicios Resolvidos PolaridadeDocumento15 páginasQuimica Geral Exercicios Resolvidos PolaridadeMarina Serra100% (1)
- Olimpíada 2019 EM2 SeeducDocumento12 páginasOlimpíada 2019 EM2 SeeducleonardoolliveiraAinda não há avaliações
- Material Suplementar 100 Experiencias de Quimica OrganicaDocumento433 páginasMaterial Suplementar 100 Experiencias de Quimica OrganicaLEE MARX100% (1)
- Nomenclatura de HidrocarbonetosDocumento21 páginasNomenclatura de Hidrocarbonetosjoelson dos santos bessaAinda não há avaliações
- Isomeria (Teoria e Exercícios Com Gabarito) - Internet - 2013Documento30 páginasIsomeria (Teoria e Exercícios Com Gabarito) - Internet - 2013Josimar Lima FerreiraAinda não há avaliações
- Apresentação Unidade de HidrotratamentoDocumento24 páginasApresentação Unidade de HidrotratamentoCarine RebelloAinda não há avaliações
- Elementos Químicos BingoDocumento5 páginasElementos Químicos BingoJanice75% (4)
- Química - Pré-Vestibular Impacto - Lei de HessDocumento2 páginasQuímica - Pré-Vestibular Impacto - Lei de HessQuímica QuiAinda não há avaliações
- Teachers Book PortoDocumento88 páginasTeachers Book PortoalexandrekorteAinda não há avaliações
- Materiais de Moldagem ResumoDocumento12 páginasMateriais de Moldagem ResumoGuilherme Schmitt de Andrade100% (2)
- Enem ResolvidoDocumento5 páginasEnem ResolvidoEd GomesAinda não há avaliações
- XII Maratona Cearense de Quimica 8o Ano - PDF - XIIDocumento3 páginasXII Maratona Cearense de Quimica 8o Ano - PDF - XIISouza VieiraAinda não há avaliações
- Preparação de SoluçõesDocumento23 páginasPreparação de SoluçõesAna Celia MendesAinda não há avaliações