Escolar Documentos
Profissional Documentos
Cultura Documentos
"Les Essentiels": Les Essais Cliniques, Pourquoi Sont-Ils Indispensables ?
Enviado por
LeemTítulo original
Direitos autorais
Formatos disponíveis
Compartilhar este documento
Compartilhar ou incorporar documento
Você considera este documento útil?
Este conteúdo é inapropriado?
Denunciar este documentoDireitos autorais:
Formatos disponíveis
"Les Essentiels": Les Essais Cliniques, Pourquoi Sont-Ils Indispensables ?
Enviado por
LeemDireitos autorais:
Formatos disponíveis
Les essentieLs du mdicament 1
Essais cliniquEs Pourquoi ils sont indispensables
Avec 920* essais cliniques raliss en 2010, la France reste un grand pays de recherche et de dveloppement du mdicament.
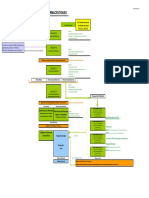
les essais cliniques sont la phase pivot du dveloppement dun mdicament : aprs les phases de recherche en laboratoire et sur les animaux (phase prclinique), qui permettent dvaluer lactivit dun produit et sa toxicit, des tudes cliniques, c'est--dire ralises chez l'homme sont organises : pour valuer et prciser la scurit demploi (phase 1), le devenir du produit dans lorganisme et confirmer l'efficacit thrapeutique de la molcule sur une maladie donne (phases 2 et 3). les trois phases dessais sont des tapes incon tournables car leurs rsultats conditionnent la mise sur le march du nouveau mdicament. Elles sont compltes dtudes dites post-AMM , car intervenant aprs la mise sur le march du mdicament, qui valuent le mdicament dans la vraie vie , cest--dire lorsquil est prescrit grande chelle. les essais construisent le disque dur du nou veau mdicament : parce quils sont raliss sur lhomme, ils contribuent crer un mdicament, efficace et sr, partir des donnes accumules dans cette tape dapprentissage. conduits sur le sol franais, ils y maintiennent la chane dexpertise de la R&D pharmaceutique et font ainsi profiter les patients des soins les plus prometteurs le plus tt possible.
Les phases successives de recherche et de dveloppement dun mdicament
Objectif Phase 1 scurit du mdicament tude du devenir dans lorganisme (PK) Efficacit du produit Dterminer la posologie optimale tudier le rapport bnfice/risque Comparaison (SMR) Dure Quelques jours/mois Effectifs Petit nombre de volontaires Petits groupes homognes de patients (10 40) Plusieurs centaines de malades Rsultat 70 % des produits expriments franchissent le cap des essais de phase 1 Un tiers des produits tests franchissent le cap des essais de phases 1 et 2 70 90 % des mdicaments entrant en phase 3 sont retenus pour une demande dAMM
Phase 2
Quelques mois 2 ans
Phase 3
1 anne ou +
lissue de la phase 3, les rsultats peuvent tre soumis aux autorits europennes de sant (EMEA) pour lobtention de lautorisation de mise sur le march (aMM) Essais raliss une fois le mdicament commercialis, sur un nombre de patients souvent trs important (jusqu plusieurs dizaines de milliers de personnes). Phase 4 Meilleure connaissance du mdicament valuation de tolrance grande chelle : dtecter des effets indsirables trs rares non dtects en phase dessai
*Afssaps, rapport 2010. Les essentieLs du mdicament, une publication des entreprises du mdicament (Leem) Essais cliniques 1/2
La course linnovation sant fait de la recherche clinique un enjeu de comptition mondiale
la France est bien place dans cette comp tition mondiale : elle reprsente 8 % des patients recruts dans les essais cliniques internationaux. Elle participe prs de 10 % des tudes de phase 1 (dites prcoces) ralises dans le monde et plus de 20 % de celles ralises en Europe. Elle est rpute pour son expertise dans le domaine de la cancrologie qui concentre 30 % des tudes ralises en France, mais aussi dans le domaine des vaccins et du cardiovasculaire/mtabolisme avec 50 % des patients recruts pour ces deux axes de recherche. la France recrute un nombre de patients gal la moyenne mondiale en oncologie et largement suprieur cette mme moyenne dans le champ des maladies rares. La France se distingue aussi dans ces deux aires thrapeutiques en termes de vitesse de recrutement, qui est bien suprieure aux moyennes mondiales. Elle est reconnue pour la qualit de sa prise en charge mdicale et de ses infrastructures hospita lires, terreau favorable la ralisation dessais. cependant, sa position srode au fil des ans : les pays de lEst mergent dsormais en tte de peloton en termes de productivit globale. Globalement, la France progresse moins vite que ses concurrents dAsie ou dAmrique latine.
Les entreprises du mdicament sont conscientes de limportance des essais cliniques pour lattractivit du territoire franais
la cration du centre national de gestion des essais cliniques des produits de sant (cenGEPs) a t lune des dcisions phares des runions du Conseil stratgique des industries de sant (2005). il est financ par les industriels depuis sa mise en place en 2007, avec pour objectif de maintenir lattractivit du territoire franais pour la ralisation dessais cliniques industriels, leur professionnalisation et leur bonne gestion administrative. le cenGEPs est la concrtisation de lenga gement des industriels aux cts des hospitaliers pour recruter plus de patients, plus vite et mieux dans les essais cliniques. Il constitue un modle russi de partenariat publicpriv, indispensable la construction dun systme de sant novateur, efficient et attractif. Le CeNGEPS a t reconduit jusquen 2015. Les industriels explorent dautres voies pour inten sifier les partenariats avec les acteurs de la recherche clinique en travaillant sur lidentification de centres dexcellence franais ainsi que les facteurs qui ont contribu leur succs ou sur la standar disation des contrats hospitaliers. Cest un chantier majeur pour les industriels qui savent que ce sont les essais cliniques qui font le mdicament.
Tous les chiffres cits sont issus de lenqute Leem sur les essais cliniques, recensant les tudes internationales avec une participation franaise inities entre 2008 et 2009 par les entreprises du mdicament. Lenqute 2010 du Leem attractivit de la France pour les essais cliniques est disponible et tlchargeable sur www.leem.org Les essentieLs du mdicament, mieux comprendre le mdicament et ceux qui le font Direction de la communication du Leem, dition mai 2011
Les essentieLs du mdicament, une publication des entreprises du mdicament (Leem) Essais cliniques 2/2
Você também pode gostar
- Vaccination PDFDocumento10 páginasVaccination PDFLeemAinda não há avaliações
- Les Essentiels - Biomarqueurs CompagnonsDocumento2 páginasLes Essentiels - Biomarqueurs CompagnonsLeemAinda não há avaliações
- Étude Prospective Sur Les Facteurs D'évolution de L'industrie Du Médicament Et Leur Impact À 10 Ans Sur L'emploiDocumento54 páginasÉtude Prospective Sur Les Facteurs D'évolution de L'industrie Du Médicament Et Leur Impact À 10 Ans Sur L'emploiLeemAinda não há avaliações
- Brochure Fondation PDFDocumento4 páginasBrochure Fondation PDFLeemAinda não há avaliações
- La Lettre CQP 2013 de L'industrie Du MédicamentDocumento6 páginasLa Lettre CQP 2013 de L'industrie Du MédicamentLeemAinda não há avaliações
- Rse Rapport 2012Documento36 páginasRse Rapport 2012LeemAinda não há avaliações
- Codeem Actes-2012 PDFDocumento6 páginasCodeem Actes-2012 PDFLeemAinda não há avaliações
- Etude Bipe 2005 2013 PDFDocumento11 páginasEtude Bipe 2005 2013 PDFLeemAinda não há avaliações
- Economies Medicaments PDFDocumento1 páginaEconomies Medicaments PDFLeemAinda não há avaliações
- Baromètre Médicament - Ipsos Pour Leem Mars 2013Documento44 páginasBaromètre Médicament - Ipsos Pour Leem Mars 2013Le Quotidien du MédecinAinda não há avaliações
- Rapport Cpneis PDFDocumento30 páginasRapport Cpneis PDFLeemAinda não há avaliações
- Les Essentiels - Maladies RaresDocumento2 páginasLes Essentiels - Maladies RaresLeemAinda não há avaliações
- Bilan Eco 2012 PDFDocumento94 páginasBilan Eco 2012 PDFLeemAinda não há avaliações
- Comment Ameliorer Securite Medicament-V2Documento23 páginasComment Ameliorer Securite Medicament-V2LeemAinda não há avaliações
- Observatoire Sociétal Du Médicament - Chiffres Clés 2013Documento5 páginasObservatoire Sociétal Du Médicament - Chiffres Clés 2013LeemAinda não há avaliações
- Les Essentiels - Les Français Et Le Médicament Le Temps de La Maturité ?Documento2 páginasLes Essentiels - Les Français Et Le Médicament Le Temps de La Maturité ?LeemAinda não há avaliações
- Etude BIPE - Septembre 2012Documento4 páginasEtude BIPE - Septembre 2012LeemAinda não há avaliações
- Infographie - CancerDocumento2 páginasInfographie - CancerLeemAinda não há avaliações
- Etude R.BergerDocumento17 páginasEtude R.BergerLeemAinda não há avaliações
- Les Essentiels - Qualite Du MédicamentDocumento2 páginasLes Essentiels - Qualite Du MédicamentLeemAinda não há avaliações
- Brochure - Participation À Un Essai Clinique Sur Un MédicamentDocumento20 páginasBrochure - Participation À Un Essai Clinique Sur Un MédicamentLeemAinda não há avaliações
- Les Essentiels - Essais CliniquesDocumento2 páginasLes Essentiels - Essais CliniquesLeemAinda não há avaliações
- Brochure - Participation D'un Enfant Ou D'un Adolescent À Un Essai Clinique Sur Un MédicamentDocumento20 páginasBrochure - Participation D'un Enfant Ou D'un Adolescent À Un Essai Clinique Sur Un MédicamentLeemAinda não há avaliações
- Etude A.DLittleDocumento15 páginasEtude A.DLittleLeemAinda não há avaliações
- Les Essentiels - Maladie AlzheimerDocumento2 páginasLes Essentiels - Maladie AlzheimerLeemAinda não há avaliações
- Etude Leem COE Rexecode Septembre 2012Documento56 páginasEtude Leem COE Rexecode Septembre 2012LeemAinda não há avaliações
- Essais CliniquesDocumento3 páginasEssais CliniquesLeemAinda não há avaliações
- De La Molécule Au MédicamentDocumento3 páginasDe La Molécule Au MédicamentLeem50% (2)
- Le Parcours Du MédicamentDocumento1 páginaLe Parcours Du MédicamentLeem100% (3)
- La Découverte Et Le Développement de VaccinsDocumento3 páginasLa Découverte Et Le Développement de VaccinsLeemAinda não há avaliações
- Delf Pro b2 Comprehension Des Ecrits Exercice 1 PDFDocumento3 páginasDelf Pro b2 Comprehension Des Ecrits Exercice 1 PDFBego BegoñaAinda não há avaliações
- Sater CD11Documento114 páginasSater CD11Mustapha AmineAinda não há avaliações
- Carnet de Stage 6iémDocumento61 páginasCarnet de Stage 6iémfanfouna100% (1)
- Delf Pro b2 Comprehension Des Ecrits Exercice 2Documento3 páginasDelf Pro b2 Comprehension Des Ecrits Exercice 2Corina DraguţanAinda não há avaliações
- Cordier PH12Documento100 páginasCordier PH12hhAinda não há avaliações
- 2 SanogoDocumento53 páginas2 SanogoIbrahima Sory Camara100% (1)
- Gestpharma Logiciel Gestion PharmacieDocumento26 páginasGestpharma Logiciel Gestion PharmacieGr Rch Ami50% (2)
- Autohémothérapie Luiz MouraDocumento37 páginasAutohémothérapie Luiz Mourazolazoba100% (1)
- Scdpha T 2001 Martin SeverineDocumento258 páginasScdpha T 2001 Martin SeverineAna PopescuAinda não há avaliações
- Erection Plus Longue Avec VigarocDocumento2 páginasErection Plus Longue Avec Vigarocmenheathcare100% (1)
- Rapport de Stage de Fin D'étudesDocumento165 páginasRapport de Stage de Fin D'étudesLahoucineKicha100% (7)
- 01 Receptologie 12 13 PDFDocumento14 páginas01 Receptologie 12 13 PDFcomanavAinda não há avaliações
- Douleur - Mal de Dos PDFDocumento38 páginasDouleur - Mal de Dos PDFnkapnangluther3099Ainda não há avaliações
- Fusion Sanofi AventisDocumento17 páginasFusion Sanofi AventisHa Truong0% (1)
- A 1056 FDocumento213 páginasA 1056 FKhyarhoum BrahimAinda não há avaliações
- Rapport de Stage Pharmacie Hospitalière - DZDocumento15 páginasRapport de Stage Pharmacie Hospitalière - DZIkram Mezghiche91% (23)
- Le Cycle Du MédicamentDocumento3 páginasLe Cycle Du MédicamentLeemAinda não há avaliações
- PEUPLECONSCIENT Emagazine 01 PDFDocumento36 páginasPEUPLECONSCIENT Emagazine 01 PDFmimapaul88Ainda não há avaliações
- Rapport Sectoriel - Industrie Pharmaceutique PDFDocumento40 páginasRapport Sectoriel - Industrie Pharmaceutique PDFinsafAinda não há avaliações
- 1998 Thèse Jean Pierre Nicolas Pharmacopée Traditionnelle Des Maya Kiché Plantes Médicinales GuatemalaDocumento518 páginas1998 Thèse Jean Pierre Nicolas Pharmacopée Traditionnelle Des Maya Kiché Plantes Médicinales Guatemalabenignoson989100% (1)
- Blg121 Cours 09oct10Documento41 páginasBlg121 Cours 09oct10kmeriemAinda não há avaliações
- GM D0 Dernier EspoirDocumento20 páginasGM D0 Dernier EspoirJean-Philippe DelhayeAinda não há avaliações
- SM05 Activite1 Questions Film MedicamentsDocumento2 páginasSM05 Activite1 Questions Film MedicamentsMohamed DahmaneAinda não há avaliações
- Jeanne Perros-L'Argent Colloidal, Un Remede en or (OCR From Scan: FormatDocumento49 páginasJeanne Perros-L'Argent Colloidal, Un Remede en or (OCR From Scan: FormatustensilAinda não há avaliações
- Guide Du Pharmacien Résident 2012-2013 (2014 Pas de Guide)Documento38 páginasGuide Du Pharmacien Résident 2012-2013 (2014 Pas de Guide)Khaled En Crève100% (6)
- Maladie de Forestier-Dish Foarte CompletDocumento3 páginasMaladie de Forestier-Dish Foarte CompletIulian IvasciucAinda não há avaliações
- 1'Documento11 páginas1'Belgacem LassouedAinda não há avaliações
- AyurvedaDocumento11 páginasAyurvedaFred RocherAinda não há avaliações
- Referentiel National Semiologie Respiratoire 30 MAI 10Documento141 páginasReferentiel National Semiologie Respiratoire 30 MAI 10MacTwisT2Ainda não há avaliações
- Copie de SCHEMA ETUDES PHARMACEUTIQUES 2011 Version Definitive PDFDocumento2 páginasCopie de SCHEMA ETUDES PHARMACEUTIQUES 2011 Version Definitive PDFMHANDAinda não há avaliações